修回日期: 2003-04-10
接受日期: 2003-05-31
在线出版日期: 2004-02-15
目的: 研究胃溃疡对大鼠G细胞分泌胃泌素(D细胞分泌生长抑素)和对G(D)细胞变化的影响.
方法: 建立冰乙酸性大鼠胃溃疡模型, 采用大体、光镜、透射电镜观察胃窦黏膜组织学表现和胃窦黏膜细胞超微结构表现, 采用放射免疫法检测血清和胃窦组织中的胃泌素、生长抑素含量, 采用免疫组化法及定量分析检测G(D)细胞形态、数目、面积、和G/D细胞数目、面积比值, 采用免疫电镜及定量分析观察与检测G(D)细胞及G(D)细胞中的胃泌素(生长抑素)分泌颗粒.
结果: 免疫电镜观察到了G(D)细胞和G(D)细胞中的胃泌素(生长抑素)分泌颗粒. 大鼠胃溃疡后, G细胞内胃泌素分泌量增加, D细胞内生长抑素分泌量减少, G细胞数目增加、面积减少, D细胞数目减少、面积减少, G/D细胞数目比值和G/D细胞面积比值增加, 并且血清、胃窦组织中胃泌素含量增加, 生长抑素含量减少.
结论: 大鼠胃溃疡可引起G、D细胞的变化, 引起G、D细胞分泌胃泌素、生长抑素的变化, 和引起胃泌素、生长抑素含量的变化.
引文著录: 孙凤蓬, 宋于刚, 覃汉荣. 胃溃疡大鼠胃泌素、生长抑素和GD细胞的变化. 世界华人消化杂志 2004; 12(2): 363-366
Revised: April 10, 2003
Accepted: May 31, 2003
Published online: February 15, 2004
AIM: To investigate the alterations of gastrin secretion of G cells, somatostatin secretion of D cells and the change of G (D) cells in rat gastric ulcer.
METHODS: An acetic-acid-induced rat gastric ulcer model was established. The histological structure of rat antral mucosa and the ultrastructure of mucosal cells were observed generally, through microscope and through electron microscope. The content of gastrin or somatostatin in serum or in antral tissue was measured via radioimmunoassay. The shape, number, size of G (D) cells, and the ratio of number and size of G/D cells were viewed and analyzed with immunohistochemical technique and image analysis system. G (D) cells and the secretive gastrin (somatostatin) granules in G (D) cells were observed through immunoel-ectron microscope and analyzed in image analysis system.
RESULTS: G (D) cells and the secretive gastrin (somatostatin) granules in G (D) cells were observed through immunoelectron microscope successfully. In gastric ulcer rat the secretive gastrin in G cells increased, the secretive somatostatin in D cells declined, the number of G cells increases and the size of G cells declined; both the number and the size of D cells declined, both the ratio of the number and size of G/D cells increased, both the content of gastrin in serum and in antral tissue increased, and both the content of somatostatin in serum and in antral tissue declined.
CONCLUSION: The rat gastric ulcer induces the changes of G cells and D cells, secretive gastrin in G cells and secretive somatostatin in D cells, as well as the contents of gastrin and somatostatin.
- Citation: Sun FP, Song YG, Qin HR. Alterations of gastrin, somatostatin, G and D cells in rat gastric ulcer. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 363-366
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/363.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.363
胃肠激素调控着消化道的分泌、运动、吸收、血流和细胞营养等功能. 就溃疡过程与胃肠激素的关系方面来说, 仍有相当多的问题需要加以研究[1-13]. 我们循同步研究的思路, 应用冰乙酸性大鼠胃溃疡模型, 采用大体、光镜、透射电镜、放射免疫、免疫组化、免疫电镜等方法与技术, 检测分析了胃溃疡大鼠血清、胃窦组织中胃泌素、生长抑素含量的变化, 和胃窦组织中胃泌素分泌细胞(G细胞)、生长抑素分泌细胞(D细胞)在形态、数量、超微结构等方面的变化, 旨在探讨胃溃疡对胃泌素、生长抑素和G、D细胞变化的影响.
健康成年♂ Wistar大鼠14只, 体质量240±10 g, 购于中山医科大学实验动物中心, 合格证号98A018. 大鼠随机分为溃疡组和正常组各7只. 胃泌素放免试剂盒购自天津千叶公司, 生长抑素放免试剂盒购自第二军医大学神经生物学教研室. 牛血清白蛋白、兔抗胃泌素抗体购自美国Sigma公司, 兔抗生长抑素抗体购自美国Zymed Laboratories公司, 免疫组化SABC试剂盒、10 nm葡萄球菌A蛋白胶体金购自武汉博士德公司.
溃疡组大鼠以戊巴比妥钠腹腔内麻醉, 仰卧固定、常规消毒皮肤, 上腹部皮肤正中切口、打开腹腔找到鼠胃, 以1 mL注射器在胃窦前壁注入冰乙酸0.05 mL、达胃壁肌层与浆膜层之间, 将大网膜组织与注射部位胃窦壁浆膜组织缝合一针, 缝合腹膜、腹壁、皮肤, 术后单笼饲养, 于4 d处死取材. 正常组大鼠不做任何处理, 饲养4 d后处死取材. 处死取材日的前1 d午餐起, 大鼠禁食, 但不禁水. 于取材日将各组大鼠麻醉后开腹、开胸, 直视下心室内取血4 mL, 置于含40 μL 500 u抑肽酶、60 μL 100 g/L EDTA的塑料管中混匀, 4 ℃离心, 取上清液分装冻存于-20 ℃冰箱备检. 分离并解剖鼠胃, 迅速在胃窦溃疡边缘部分剪取数块约0.5 mm×0.5 mm组织, 分别置于30 g/L戊二醛液、30 g/L多聚甲醛-1 g/L戊二醛液中固定. 剪取约1 cm×0.5 cm含溃疡胃窦组织, 置40 g/L多聚甲醛液中固定. 剪取约0.1 g胃窦溃疡边缘部分组织, 迅速用电子分析天平称重, 加热煮沸后放入盛有0.5 mol/L乙酸1 mL的组织匀浆器中匀浆, 再用1 mol/L NaOH 1 mL中和, 将组织匀浆液于4 ℃离心, 取上清液分装冻存于-20 ℃冰箱备检. 按常规方法大体观察胃窦. 4%多聚甲醛液固定的胃窦组织于24 h后, 常规HE染色, 光镜观察. 30 g/L戊二醛液固定的胃窦组织于24 h后, 按常规方法10 g/L锇酸后固定、梯度丙酮脱水、纵向Spurr树脂包埋、超薄切片、铀铅染色, CM10 (荷兰PHILIPS公司)透射电镜观察.
1.2.1 胃泌素和生长抑素检测: 采用放射免疫法(RIA)测定大鼠血清、胃窦组织匀浆液中胃泌素、生长抑素含量, 加样步骤按照药盒说明书进行, 结果经换算后, 表达为血清标本单位ng/L, 胃窦组织标本单位pg/g.
1.2.2 免疫组化染色及定量分析: 分别采用兔抗胃泌素抗体、兔抗生长抑素抗体, 检测胃窦膜中的G细胞和D细胞. 按免疫组化SABC法进行常规染色, 不使用胰蛋白酶消化, 用微波处理法. 采用Quantimet 500图像分析系统(德国Leica公司)对结果进行图像分析. 在标记G细胞的每张切片上随机选取5个视野, 测量G细胞的平均数目、面积. 取与G细胞相邻的标记D细胞的切片, 用上述方法测量D细胞平均数目、面积. 将标记GD细胞的相邻切片中的G细胞平均数目、面积分别除以D细胞平均数目、面积, 得G/D细胞数目比值和G/D细胞面积比值.
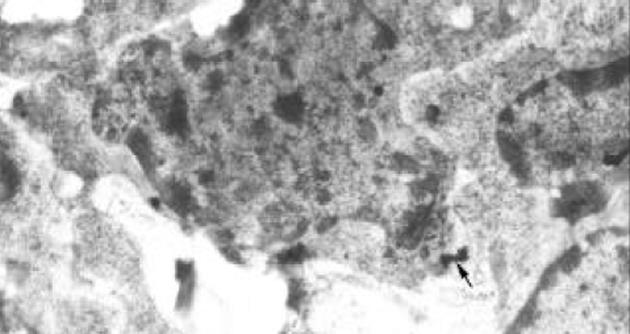
1.2.3 免疫电镜观察及定量分析: 30 g/L多聚甲醛-1 g/L戊二醛液固定的胃窦组织标本于2 h后, 经10 g/L锇酸后固定1 h, 梯度丙酮脱水, 纵向Spurr树脂包埋, 40 ℃聚合72 h, 70-80 nm超薄切片, 贴附于镍网上, 将溃疡组切片和对照组切片再分别分为胃泌素切片组、生长抑素切片组、对照切片组3个组. 随后切片置30 mL/L过氧化氢蚀刻10 min, 双蒸水冲洗3次, 10 g/L过碘酸钠5 min, 0.05 mol/L pH7.4 TBS漂洗3次, 15 g/L牛血清白蛋白非特异性阻断黏附30 min. 胃泌素切片组加入1: 80兔抗胃泌素抗体、生长抑素切片组加入1: 80兔抗生长抑素抗体、对照切片组加入蒸馏水以代替胃泌素抗体或生长抑素抗体, 温盒中4 ℃ 24 h、37 ℃ 1 h孵育, 0.02 mol/L pH7.4 TBS漂洗1次, 15 g/L牛血清白蛋白再次非特异性阻断黏附30 min, 1: 60葡萄球菌A蛋白胶体金37 ℃孵育1h, 0.02mol/L pH7.4 TBS漂洗1次、0.05 mol/L pH7.4 TBS漂洗3次、双蒸水冲洗3次, 铀铅复染, CM10透射电镜观察. 分别自胃泌素切片组切片中和生长抑素切片组切片中随机拍摄含有金颗粒聚集体的50个任意细胞, 照片输入Quantimet 500图像分析系统, 测量G细胞内金颗粒聚集体中的平均金颗粒数目和D细胞内金颗粒聚集体中的平均金颗粒数目.
统计学处理 采用SPSS软件8.0版本进行数据统计处理, 计量资料描述方法采用mean±SD表示, 对两个变量之间计量资料的比较进行t检验.
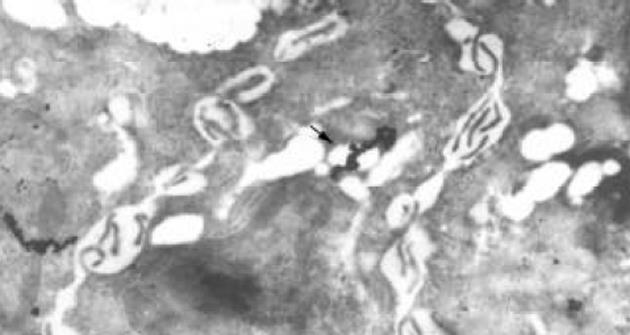
溃疡组胃内容物明显增多, 胃窦前壁膜面有一处溃疡, 直径0.5-0.7cm, 溃疡呈圆形, 中心颜色苍白, 表面覆以灰白色苔膜, 底部平坦, 边界清楚, 周围黏膜充血、水肿. 正常组胃内容物贮存量适中, 胃膜皱襞明显, 膜色淡红, 表面无溃疡, 无充血、水肿. 光镜观察见溃疡组胃窦溃疡部位膜腺体正常结构消失, 表层为坏死组织, 其下肉芽组织增生, 并可见中性粒细胞、单核细胞、巨噬细胞、淋巴细胞等炎性细胞. 溃疡边缘膜腺体间质充血水肿、可见新生毛细血管和增生的纤维结缔组织. 正常组胃窦膜结构完整, 膜腺体排列整齐, 未见明显的炎性细胞浸润. 透射电镜观察见溃疡组溃疡边缘胃窦膜黏液细胞胞膜结构模糊不清, 线粒体肿胀、嵴断裂. 壁细胞胞膜破裂、微绒毛消失, 线粒体肿胀, 内质网扩张、互相离散, 细胞内的分泌小管系统发育不良. 主细胞粗面内质网减少、扩张, 酶原颗粒增大且有融和. 见有数种类型的内分泌细胞. 还见有细胞质浓缩、细胞核碎裂的坏死细胞, 和核染色质颗粒状聚集、核质比例降低、出现凋亡小体的凋亡细胞, 以及中性粒细胞、嗜酸粒细胞、肥大细胞、巨噬细胞等炎性细胞. 正常组胃窦膜黏液细胞、壁细胞、主细胞的膜结构、线粒体、内质网、分泌颗粒等细胞器未见明显异常, 也见有数种类型的内分泌细胞, 未见坏死细胞、凋亡细胞和各种炎性细胞.
溃疡组和正常组血清胃泌素含量、胃窦组织胃泌素含量、血清生长抑素含量、胃窦组织生长抑素含量之间的差异皆具有非常显著意义(P<0.01, 表1).
| 参数 | 溃疡组 | 正常组 |
| 血清胃泌素(ng/L) | 396.65±130.09a | 146.94±40.68 |
| 胃窦胃泌素(pg/g) | 6 734.71±2 286.92a | 3 713.52±1 133.27 |
| 血清生长抑素(ng/L) | 13.48±4.93a | 45.28±12.14 |
| 胃窦生长抑素(pg/g) | 374.05±149.80a | 1 358.24±406.82 |
| G细胞数目 | 50.14±6.67a | 33.42±5.50 |
| G细胞面积(×10-6m2) | 86.51±6.64a | 98.77±7.18 |
| D细胞数目 | 10.29±1.60a | 14.57±1.72 |
| D细胞面积(×10-6m2) | 5.62±8.02a | 70.38±11.04 |
| G/D细胞数目比值 | 4.89±0.30a | 2.28±0.12 |
| G/D细胞面积比值 | 1.57±0.13a | 1.42±0.13 |
| G细胞中金颗粒数目 | 121.60±22.79a | 107.04±19.68 |
| D细胞中金颗粒数目 | 72.92±15.30a | 83.36±17.58 |
G细胞主要分布于胃窦膜的中、下1/3, 偶见于膜上部, 其形态呈圆形、椭圆形、梭形、三角形或不规则形, 有的G细胞发出细长突起, 末端呈棒状, 伸向邻近细胞, 有的细胞顶部可达腺腔. D细胞主要分布于胃窦膜的下1/3, 偶见于膜中、上部, 其形态与G细胞相似. 溃疡组和正常组的GD细胞数目、面积的差异皆具有非常显著意义(P<0.01, 表1).
胃泌素主要由胃窦及小肠上部黏膜的G细胞分泌, 中枢神经系统的延髓迷走神经背核也含有胃泌素. 胃泌素是胃酸分泌的主要调节激素, 在壁细胞、ECL细胞中有胃泌素受体, 胃泌素通过直接刺激壁细胞的胃泌素受体而刺激壁细胞分泌胃酸, 也间接通过ECL细胞的胃泌素受体刺激ECL细胞释放组胺, 组胺再以旁分泌方式激活壁细胞H2受体而使之泌酸. 胃泌素还促进胃肠道内胃蛋白酶、促胰液素、胰液、胆汁中水和盐的分泌, 促进胰岛素和降钙素的释放. 胃泌素对胃黏膜具有营养和促增生作用, 并具有生长因子样功能, 其水平增高会增加壁细胞和ECL细胞数目, 并且与类癌瘤的发生相关. 胃泌素也增加胃肠道的运动, 使胃、肠、胆囊的收缩作用加强. 此外, G细胞是主细胞、ECL细胞、肠神经丛神经纤维之外的第4个胃内组胺来源. 胃内pH升高、进食、胃内压上升、迷走神经及黏膜神经丛介导的兴奋可使G细胞分泌胃泌素增加, 胃内酸度增高、生长抑素等其他胃肠激素刺激、交感神经兴奋则可抑制胃泌素的分泌[14-20]. 生长抑素在体内分布十分广泛, 存在于下丘脑、脑的其他部位、外周神经、胃肠道等处. 在消化系统, 生长抑素由D细胞分泌, 主要分布于肠壁神经丛、胃、胰腺. 生长抑素对消化系统的生物学作用主要是抑制, 他可抑制胃、肠、胆囊的蠕动, 抑制黏膜细胞的增生, 减少胃肠道壁血流量, 抑制胃酸、胃蛋白酶、肝胆汁、小肠液的分泌, 抑制胃泌素等各种胃肠激素的分泌, 减少小肠对水、电解质、葡萄糖、氨基酸、甘油三酯的吸收. 交感神经兴奋和迷走神经兴奋分别抑制和刺激D细胞对生长抑素的分泌. 胃泌素对胃内生长抑素分泌具有独特的区域性调节作用, 胃泌素可直接作用于D细胞而刺激生长抑素分泌, 在一些物种的胃D细胞中检出了胃泌素受体. 有研究发现内源性组胺通过对H3受体的旁分泌作用抑制生长抑素的分泌, 还有研究发现内皮素通过与其受体作用而抑制生长抑素的分泌[21-26].
消化道中内分泌细胞种类繁多, 尽管以常规透射电镜观察到的不同种类内分泌细胞可按其超微结构, 以及按其细胞中内分泌颗粒的数目、位置、大小、形态、致密度等特征加以判别定性, 然而就确切标明特定内分泌细胞的内分泌颗粒中具体分泌的胃肠激素来说, 免疫电镜技术以胶体金探针具有的特异性强、分辨率高、定位准确、定量精确而具有更为重要的意义[27-28]. 本实验采用免疫电镜观察到了G(D)细胞和G(D)细胞中的胃泌素(生长抑素)分泌颗粒, 相应地明确判定了G(D)细胞. 本实验结果表明大鼠胃溃疡后, G细胞内胃泌素分泌量增加, D细胞内生长抑素分泌量减少, G细胞数目增加、面积减少, D细胞数目减少、面积减少, G/D细胞数目比值和G/D细胞面积比值增加, 并且血清、胃窦组织中胃泌素含量增加, 生长抑素含量减少. 我们认为溃疡大鼠的血清、胃窦组织胃泌素含量增加应是G细胞数目增加和G细胞中胃泌素分泌量增加的结果, 生长抑素含量减少应是D细胞数目减少和D细胞中生长抑素分泌量减少的结果. G(D)细胞面积减少则有可能是G(D)细胞分泌胃泌素(生长抑素)后, G(D)细胞体积相应缩小的表现, 也有可能是胃溃疡对G(D)细胞的影响所致其体积相应缩小的表现, 这有待于进一步研究加以探讨. G/D细胞比值可作为了解这两种细胞功能相对变化的指标, 正常大鼠胃黏膜中G/D细胞数目和面积的比值是相对稳定的. 本结果表明, 溃疡组大鼠G/D细胞数目和G/D细胞面积比值都较正常组增大, 这一方面进一步表明溃疡引起了G、D细胞的变化, 另一方面也印证了胃溃疡后胃泌素分泌的增加和生长抑素分泌的减少.
编辑: N/A
| 1. | Sun FP, Song YG, Cheng W, Zhao T, Yao YL. Gastrin, somatostatin, G and D cells of gastric ulcer in rats. World J Gastroenterol. 2002;8:375-378. [PubMed] |
| 2. | MacIntosh CG, Horowitz M, Verhagen MA, Smout AJ, Wishart J, Morris H, Goble E, Morley JE, Chapman IM. Effect of small intestinal nutrient infusion on appetite, gastrointestinal hormone release, and gastric myoelectrical activity in young and older men. Am J Gastroenterol. 2001;96:997-1007. [PubMed] [DOI] |
| 3. | Chen D, Zhao CM, Al-Haider W, Håkanson R, Rehfeld JF, Kopin AS. Differentiation of gastric ECL cells is altered in CCK(2) receptor-deficient mice. Gastroenterology. 2002;123:577-585. [PubMed] [DOI] |
| 4. | Arebi N, Healey ZV, Bliss PW, Ghatei M, Van Noorden S, Playford RJ, Calam J. Nitric oxide regulates the release of somatostatin from cultured gastric rabbit primary D-cells. Gastroenterology. 2002;123:566-576. [PubMed] [DOI] |
| 5. | Cobb S, Wood T, Tessarollo L, Velasco M, Given R, Varro A, Tarasova N, Singh P. Deletion of functional gastrin gene markedly increases colon carcinogenesis in response to azoxymethane in mice. Gastroenterology. 2002;123:516-530. [PubMed] [DOI] |
| 6. | Peghini PL, Annibale B, Azzoni C, Milione M, Corleto VD, Gibril F, Venzon DJ, Delle Fave G, Bordi C, Jensen RT. Effect of chronic hypergastrinemia on human enterochromaffin-like cells: insights from patients with sporadic gastrinomas. Gastroenterology. 2002;123:68-85. [PubMed] [DOI] |
| 7. | Silva JC, Santos JL, Barbosa AJ. Gastrinaemia, tissue gastrin concentration and G cell density in the antral mucosa of swine with and without gastric ulcer of the pars oesophagea. J Comp Pathol. 2002;126:235-237. [PubMed] [DOI] |
| 8. | Wang X, Wang BR, Zhang XJ, Xu Z, Ding YQ, Ju G. Evidences for vagus nerve in maintenance of immune balance and transmission of immune information from gut to brain in STM-infected rats. World J Gastroenterol. 2002;8:540-545. [PubMed] [DOI] |
| 9. | Xia L, Yuan YZ, Xu CD, Zhang YP, Qiao MM, Xu JX. Effects of epidermal growth factor on the growth of human gastric cancer cell and the implanted tumor of nude mice. World J Gastroenterol. 2002;8:455-458. [PubMed] [DOI] |
| 10. | Liu CY, Chen LB, Liu PY, Xie DP, Wang PS. Effects of progesterone on gastric emptying and intestinal transit in male rats. World J Gastroenterol. 2002;8:338-341. [PubMed] |
| 11. | Wang X, Zhong YX, Zhang ZY, Lu J, Lan M, Miao JY, Guo XG, Shi YQ, Zhao YQ, Ding J. Effect of L-NAME on nitric oxide and gastrointestinal motility alterations in cirrhotic rats. World J Gastroenterol. 2002;8:328-332. [PubMed] |
| 12. | Wang H, Zhang YQ, Ding YQ, Zhang JS. Localization of neurokinin B receptor in mouse gastrointestinal tract. World J Gastroenterol. 2002;8:172-175. [PubMed] [DOI] |
| 13. | Wang X, Zhong YX, Lan M, Zhang ZY, Shi YQ, Lu J, Ding J, Wu KC, Jin JP, Pan BR. Screening and identification of proteins mediating senna induced gastrointestinal motility enhancement in mouse colon. World J Gastroenterol. 2002;8:162-167. [PubMed] [DOI] |
| 14. | Björkqvist M, Dornonville de la Cour C, Zhao CM, Gagnemo-Persson R, Håkanson R, Norlén P. Role of gastrin in the development of gastric mucosa, ECL cells and A-like cells in newborn and young rats. Regul Pept. 2002;108:73-82. [PubMed] [DOI] |
| 15. | Sipponen P, Ranta P, Helske T, Kääriäinen I, Mäki T, Linnala A, Suovaniemi O, Alanko A, Härkönen M. Serum levels of amidated gastrin-17 and pepsinogen I in atrophic gastritis: an observational case-control study. Scand J Gastroenterol. 2002;37:785-791. [PubMed] [DOI] |
| 16. | Kirton CM, Wang T, Dockray GJ. Regulation of parietal cell migration by gastrin in the mouse. Am J Physiol Gastrointest Liver Physiol. 2002;283:G787-G793. [PubMed] [DOI] |
| 17. | Pagliocca A, Wroblewski LE, Ashcroft FJ, Noble PJ, Dockray GJ, Varro A. Stimulation of the gastrin-cholecystokinin(B) receptor promotes branching morphogenesis in gastric AGS cells. Am J Physiol Gastrointest Liver Physiol. 2002;283:G292-G299. [PubMed] [DOI] |
| 18. | Schmassmann A, Reubi JC. Cholecystokinin-B/gastrin receptors enhance wound healing in the rat gastric mucosa. J Clin Invest. 2000;106:1021-1029. [PubMed] [DOI] |
| 19. | Tuo BG, Yan YH, Ge ZL, Ou GW, Zhao K. Ascorbic acid secretion in the human stomach and the effect of gastrin. World J Gastroenterol. 2000;6:704-708. [PubMed] [DOI] |
| 20. | Du YP, Zhang YP, Wang SC, Shi J, Wu SH. Function and regulation of cholecystokinin octapeptide, beta-endorphin and gastrin in anorexic infantile rats treated with ErBao Granules. World J Gastroenterol. 2001;7:275-280. [PubMed] [DOI] |
| 21. | Abdu F, Hicks GA, Hennig G, Allen JP, Grundy D. Somatostatin sst(2) receptors inhibit peristalsis in the rat and mouse jejunum. Am J Physiol Gastrointest Liver Physiol. 2002;282:G624-G633. [PubMed] [DOI] |
| 22. | Larsson LI. Developmental biology of gastrin and somatostatin cells in the antropyloric mucosa of the stomach. Microsc Res Tech. 2000;48:272-281. [PubMed] [DOI] |
| 23. | Lu SJ, Liu YQ, Lin JS, Wu HJ, Sun YH, Tan YB. VIP immunoreactive nerves and somatostatin and serotonin containing cells in Crohn's disease. World J Gastroenterol. 1999;5:541-543. [PubMed] [DOI] |
| 24. | Zhang QX, Dou YL, Shi XY, Ding Y. Expression of somatostatin mRNA in various differentiated types of gastric carcinoma. World J Gastroenterol. 1998;4:48-51. [PubMed] [DOI] |
| 25. | He SW, Shen KQ, He YJ, Xie B, Zhao YM. Regulatory effect and mechanism of gastrin and its antagonists on colorectal carcinoma. World J Gastroenterol. 1999;5:408-416. [PubMed] [DOI] |
| 26. | Zhu JY, Leng XS, Wang D, Du RY. Effects of somatostatin on splanchnic hemodynamics in cirrhotic patients with portal hypertension. World J Gastroenterol. 2000;6:143-144. [PubMed] [DOI] |
| 27. | Li QF, Ou Yang GL, Li CY, Hong SG. Effects of tachyplesin on the morphology and ultrastructure of human gastric carcinoma cell line BGC-823. World J Gastroenterol. 2000;6:676-680. [PubMed] [DOI] |
| 28. | Ding SP, Li JC, Xu J, Mao LG. Study on the mechanism of regulation on the peritoneal lymphatic stomata with Chinese herbal medicine. World J Gastroenterol. 2002;8:188-192. [PubMed] [DOI] |