修回日期: 2003-07-02
接受日期: 2003-07-24
在线出版日期: 2004-02-15
目的: 观察血红素氧合酶在肝硬化大鼠小肠组织中的表达.
方法: 建立大鼠四氯化碳肝硬化模型, 采用免疫组化法显示血红素氧合酶异构酶HO-1、HO-2在肝硬化实验组与正常对照组大鼠小肠组织中的表达, 应用图像分析系统对免疫组化的结果进行定量分析.
结果: 肝硬化实验组大鼠的门静脉压力较正常对照组显著增高(2.609±0.144及0.916±0.034, t = 39.37, P<0.01), 而平均动脉压降低则低于正常对照组(13.411±1.208及17.423±1.472, t = 7.297, P<0.05). 肝硬化实验组大鼠小肠黏膜下层的小动脉及小静脉、肌层、浆膜层, 甚至黏膜腺体内HO-1的表达均较强, 而正常对照组中的表达则较弱(0.4 813±0.1 223及0.3762±0.0 689, t = 19.022, P<0.01). HO-2在两组大鼠的小肠组织中差异无统计学意义(0.4 834±0.0 997及0.4 813±0.1 056, t = 0.595, P>0.05). 并且, 肝硬化实验组小肠HO-1的表达与门静脉压力呈正相关, 而与外周动脉压呈负相关.
结论: 肝硬化大鼠小肠组织中HO-1的表达增高, 可能参与了肝硬化门静脉高压性肠病的发生.
引文著录: 田德安, 周晓黎. 实验性肝硬化大鼠小肠血红素氧合酶的表达. 世界华人消化杂志 2004; 12(2): 351-354
Revised: July 2, 2003
Accepted: July 24, 2003
Published online: February 15, 2004
AIM: To investigate the expression of heme oxygenase(HO) in the small intestine in cirrhotic rats and control rats.
METHODS: The expression of heme oxygenase isoenzyme 1 and 2 (HO-1, HO-2) proteins in the small intestine was assessed by immunohistochemistry. The change of expression of HO was studied by computer image system and quantitative analysis.
RESULTS: The portal venous pressure (PVP) of cirrhotic rats was significantly higher than that of controls (2.609±0.144 vs 0.916±0.034, t = 39.37, P < 0.01), whereas the mean arterial pressure (MAP) was significantly lower than that of controls (13.411±1.208 vs 17.423±1.472, t = 7.297, P < 0.05). It was found that HO-1 positive staining localized in submucosal small artery and small vein, the layer of muscle, serosa, even in submucosal gland of cirrhotic rats, but only poor positive staining in those of normal controls (0.4 813±0.1 223 vs 0.3 762± 0.0 689, t = 19.022, P < 0.01). In both groups, HO-2 was observed in submucosal blood vessel and gland, the layer of muscle, serosa. In cirrhotic rats, HO-2 staining did not display any notable changes compared with that of in control rats (0.4 834±0.0 997 vs 0.4 813±0.1 056, t = 0.595, P > 0.05). In addition, the expression levels of heme oxygenase were correlated positively with portal venous pression (r = 0.655, P < 0.05) and negatively with the mean arterial pressure (r = -0.852, P < 0.01).
CONCLUSION: The expression of HO-1 is elevated in the small intestine of cirrhotic rats. It may play an important role in the development of portal hypertension enteropathy.
- Citation: Tian DA, Zhou XL. Heme oxygenase expression in small intestine of experimental hepatic cirrhosis rats. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 351-354
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/351.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.351
肝硬化门静脉高压时, 内脏血流动力学发生了明显的变化, 整个胃肠道的血流增加, 心排血量增加, 外周阻力下降. 肠黏膜血管扩张是门静脉高压性肠病的主要且具有特征性的病理变化, 肠道各个部位均有静脉曲张出血的报道, 但肝硬化门静脉高压时小肠病理生理改变的发生机制尚未完全阐明. 血红素氧合酶(heme oxygenase, HO)是合成内源性一氧化碳(endogenous carbon monoxide, CO)的起始酶和限速酶, HO/CO系统已成为当前的一项研究热点. 我们应用免疫组化法研究肝硬化大鼠小肠组织中血红素氧合酶异构酶HO-1, HO-2的表达, 探讨HO/CO系统在肝硬化小肠组织病变中的作用.
抗HO-1和HO-2多克隆羊抗鼠抗体购于美国Santa Cruz生物技术公司, 免疫组化过氧化物酶标记的链霉素卵白素(SP)染色试剂盒购于北京中山公司, 浓缩型DAB试剂盒北京中山公司.
选择健康成年♂SD大鼠, 体重为(250±25 g)(由华中科技大学同济医学院实验动物中心提供), 随机分为肝硬化实验组及正常对照组. 肝硬化实验组大鼠给予500 mL/L四氯化碳(3 mL/g)皮下注射, 2次/wk, 连续16 wk. 成功制得肝硬化模型12只(肝硬化形成经病理证实). 正常对照组大鼠(12只)给予生理盐水(3 mL/g)皮下注射. 于第16 wk进行血流动力学测定, 以3%戊巴比妥钠腹腔注射麻醉, 游离回结肠静脉和右侧股动脉, 分别穿刺, 连接压力换能器, 多道生理仪记录, 测定门静脉压力(PVP)和平均动脉压力(MAP). 取新鲜大鼠小肠组织, 放入中性甲醛溶液中固定, 制成石蜡切片. 切片脱蜡至水, 放入新鲜配制的30 mL/L H2O2中, 室温10 min以灭活内源性过氧化物酶, 置入1 g/L TritonX-100/PBS溶液内15 min, 增加胞膜的通透性, 滴加正常血清封闭液, 室温20 min, 以封闭非特异性结合位点. 滴加0.2 mol/L磷酸盐缓冲液(PB)稀释的一抗, HO羊抗鼠多克隆抗体(HO-1, 1: 200; HO-2, 1: 200), 4 ℃孵育过夜, 0.01 mol/L PBS洗5 min×3次; 滴加生物素化二抗(兔抗羊IgG), 湿盒内室温下孵育45 min, 0.01 mol/L PBS洗5 min×3次; 3, 3-二甲基联苯胺(DAB)显色, 苏木素复染, 封片. 免疫组化检测结果应用HPIAS-1000型全自动医学彩色图像分析系统(由同济医学院提供)进行HO染色的定量分析, 测定其阳性反应产物的面积和平均积分光密度值. 每个标本取连续3张切片进行测量, 每张切片测量10个视野的参数, 取平均值. 以上参数均在相同光强度、相同面积下以同种方法测量.
统计学处理 数据采用均数±标准差(mean±SD)表示, 两组间差异用t检验, 以P<0.05为差异有统计学意义; 两变量之间的关系应用线性相关与回归分析.
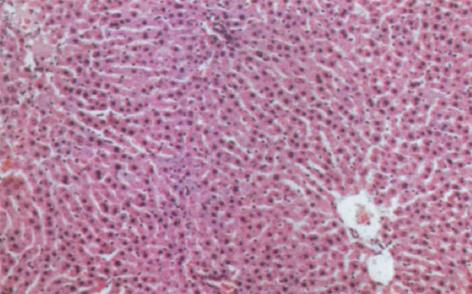
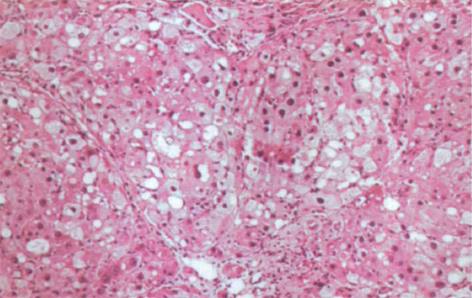
肝硬化动物模型成功建立. 肝脏大体形态观察: 正常对照组大鼠肝脏体积基本正常, 呈鲜红色; 肝硬化组大鼠肝脏体积明显缩小, 色灰暗, 表面呈颗粒隆起状, 肝脏切面呈豆渣样改变, 可见圆形或类圆形岛屿状结节. HE染色后光镜观察: 正常对照组大鼠肝内可见中央静脉周围排列正常的肝小叶结构, 肝细胞索排列正常(图1). 肝硬化组大鼠肝内正常肝小叶结构被破坏, 由广泛增生的纤维组织将原来的肝小叶分割包绕成大小不等, 圆形或椭圆形的肝细胞团即假小叶形成. 假小叶内肝细胞呈不同程度的浊肿变性、脂肪浸润, 有再生肝细胞结节形成, 肝细胞排列紊乱, 胞体较大, 核大着色较深, 可见双核肝细胞. 汇管区内结缔组织增生形成条索, 伴有不同程度的炎性细胞浸润(图2).
表1所示可见: 实验性肝硬化组大鼠的(PVP)门静脉压力较正常对照组高(P<0.05), 而平均动脉压(MAP)低于正常对照组(P<0.05).
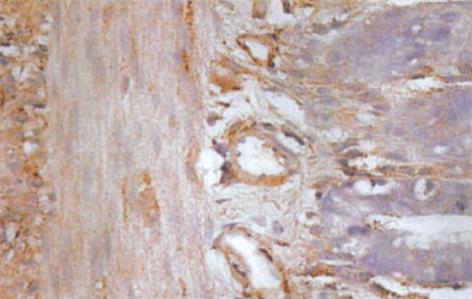
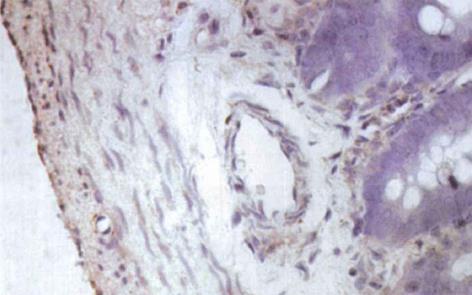
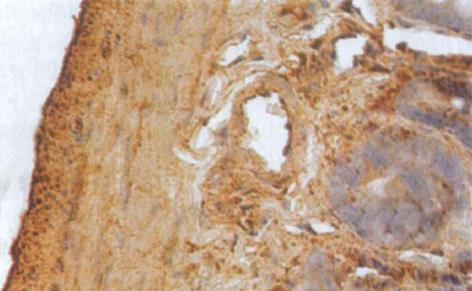
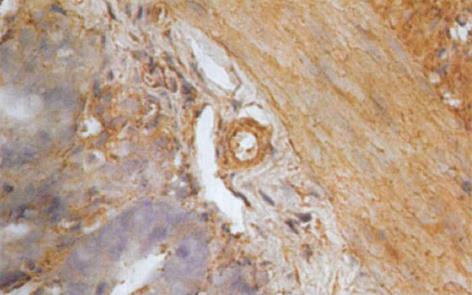
HO-1与HO-2 蛋白属膜结合蛋白类, 主要表达于核被膜及核周的胞质内[1], 呈棕黄色. 光镜下观察, 肝硬化大鼠小肠黏膜下层的小动脉、小静脉、肌层及浆膜层HO-1染色强阳性, 黏膜腺体亦可见HO-1的表达(图3); 正常对照组大鼠小肠的HO-1染色呈弱阳性(图4). 正常对照组及肝硬化组大鼠小肠组织中HO-2呈弥漫性表达, 在小肠黏膜下血管、肌层、浆膜层及黏膜腺体内染色均呈强阳性(图5, 6). 比较肝硬化组与正常组大鼠的小肠组织, 可见肝硬化组大鼠的小肠黏膜充血、水肿, 黏膜下血管扩张, 甚至变形, 部分有上皮细胞脱落.
从表2可以看出, 肝硬化实验组小肠组织中HO-1的着色面积为14.4859±7.0148, 较正常对照组显著升高(P<0.01), 平均光密度值(0.4813±0.1223)较正常对照组(0.3762±0.0689)升高, 差异有显著性意义(P<0.01), 说明肝硬化实验组大鼠小肠组织中HO-1的表达明显强于正常对照组. 而HO-2的着色面积和平均光密度值在两组间差异无统计学意义(P>0.05).
内脏高动力循环为肝硬化门静脉高压的发生及存在的重要因素, 这种高动力循环状态(hyperdynamic circulatory state, HCS)主要表现为: 心输出量增加, 心率加快, 内脏血流量增加, 外周血管阻力和内脏血管阻力下降. 高动力循环状态主要由外周动脉扩张引起, 在腹腔内脏中尤为突出. 肠黏膜下血管扩张、淤血、血流量增加, 动-静脉短路, 以及毛细血管内皮和黏膜上皮细胞超微结构改变是门静脉高压性肠病的特征性病变. 血红素氧合酶(heme oxygenase, HO)是催化血红素在体内氧化降解的起始酶和限速酶, 具有重要的生物学作用. 迄今为止, 在人和哺乳动物体内发现HO有3种异构体, 即HO-1, HO-2和HO-3. HO-1为诱生型HO, Mr为30 000-32 000, 主要分布于脾脏、肝脏、网状内皮细胞系统和骨髓, 多种因素可诱导HO-1表达增高, 包括血红素[2-4]、重金属[5-6]、低氧[7]、高氧[8-9]、化学物[10]、感染[11-13]、损伤[14]、高温[15]等. HO-2为组成型HO, Mr为36000, 主要分布于脑和睾丸中, 其表达不受氧应激等的诱导, 仅受肾上腺糖皮质激素的诱导. HO-3是近几年内发现的又一种HO异构酶, 亦为组成型, 多种诱导因素均不能诱导其表达增高, 其特异性酶活性很低. HO几乎分布于人体所有组织和器官. HO在NADPH、细胞色素P450还原酶和氧分子存在的条件下氧化降解血红素生成等摩尔数的胆绿素(biliverdin)、一氧化碳及铁. 血红素的分解产物具有重要的生理功能. 胆绿素在胆绿素还原酶(biliverdin reductase, BVR)的作用下很快生成胆红素, 胆绿素和胆红素均具有抗氧化功能, 保护血管壁细胞, 抑制黏附分子及炎症细胞入侵血管壁. 铁能诱导产生铁蛋白, 铁蛋白与游离的铁结合, 减少自由态铁的含量, 从而中和铁的氧化毒性. 由HO催化血红素分解产生的CO是内源性一氧化碳的主要来源, 另一种是由依赖NADPH通过微粒体的脂质过氧化产生. 内源性CO在体内具有广泛的生物学活性, 目前研究发现内源性CO参与了多种疾病的病理生理过程, 包括调节血压[16-17]、维持血管紧张度[18-20]、神经递质的传递、氧应激、血小板的激活及松弛平滑肌等.
本组研究结果显示四氯化碳诱导的肝硬化大鼠门静脉压力增高、平均动脉压降低. 我们观察到HO-1在肝硬化组大鼠的小肠组织中表达较高, 而在正常对照组中的表达较弱, 且肝硬化组小肠HO-1表达与门静脉压力呈正相关, 与平均动脉压呈负相关. 结果提示肝硬化大鼠的小肠组织内HO-1的诱生增加, 继而局部组织产生的内源性CO增加, 使肠血管持续处于扩张状态, 从而增加门静脉血流量, 与肠淤血等因素一起, 构成门静脉高压性肠病的病理生理基础, 且黏膜腺泡中HO-1的表达亦增加, 可能影响肠道的分泌与吸收功能. HO-2在两组大鼠的小肠中的表达均较高, 提示HO-2与正常生理条件下肠道平滑肌的肌电活动、小肠液的分泌等生理活动相关. 门静脉高压症发病的液递物质假说认为肝功能损害使肝脏对循环中有血管活性作用的液递物质的灭活能力下降, 而侧枝循环的形成使大量液递物质得以绕过肝脏对其的灭活作用, 导致循环中扩血管物质过多, 诱发循环紊乱, 是门静脉高压症的高动力循环状态得以维持的基础. 基于上述假说, 我们认为HO/CO系统可能参与了肝硬化门静脉高压的发病机制. Fernandez et al在部分结扎门静脉引起鼠门静脉高压模型中发现肝细胞、Kupper细胞、肝星状细胞及腹腔内脏器均有HO-1mRNA的高表达, 肠系膜、小肠、肝脏、脾脏血红素氧合酶活性明显升高, 且血红素氧合酶抑制剂可逆转肠系膜血管床对氯化钾的低反应性.
本研究中肝硬化小肠组织HO-1合成增加的因素可能有: (1)交感神经系统兴奋性增高, 去甲肾上腺素水平增加可激活HO/CO系统; (2)肝硬化时机体血液循环中内毒素及其他细胞因子增多有关; (3)Chica et al研究发现肝硬化肠道组织中自由基代谢产物较正常增加, 致肠道黏膜屏障被破坏, HO 可通过抗氧化应激作用对机体起保护作用; (4)研究认为门静脉高压时一氧化氮(NO)产生的第二信使(cGMP)能激活周期蛋白核苷酸反应元件和应急蛋白-1刺激HO-1的转录. 因此我们认为, HO/CO系统参与了肝硬化门静脉高压性肠病的病理生理进程, 其确切的作用机制及HO抑制剂或激动剂在临床上的应用尚值得进一步深入探讨.
编辑: N/A
| 1. | Parfenova H, Neff RA 3rd, Alonso JS, Shlopov BV, Jamal CN, Sarkisova SA, Leffler CW. Cerebral vascular endothelial heme oxygenase: expression, localization, and activation by glutamate. Am J Physiol Cell Physiol. 2001;281:C1954-C1963. [PubMed] |
| 2. | Regan RF, Kumar N, Gao F, Guo Y. Ferritin induction protects cortical astrocytes from heme-mediated oxidative injury. Neuroscience. 2002;113:985-994. [PubMed] [DOI] |
| 3. | Hosein S, Marks GS, Brien JF, McLaughlin BE, Nakatsu K. An extracellular source of heme can induce a significant heme oxygenase mediated relaxation in the rat aorta. Can J Physiol Pharmacol. 2002;80:761-765. [PubMed] [DOI] |
| 4. | Ndisang JF, Wu L, Zhao W, Wang R. Induction of heme oxygenase-1 and stimulation of cGMP production by hemin in aortic tissues from hypertensive rats. Blood. 2003;101:3893-3900. [PubMed] [DOI] |
| 5. | Regan RF, Kumar N, Gao F, Guo Y. Ferritin induction protects cortical astrocytes from heme-mediated oxidative injury. Neuroscience. 2002;113:985-994. |
| 6. | Ishizaka N, Saito K, Mitani H, Yamazaki I, Sata M, Usui S, Mori I, Ohno M, Nagai R. Iron overload augments angiotensin II-induced cardiac fibrosis and promotes neointima formation. Circulation. 2002;106:1840-1846. [PubMed] [DOI] |
| 7. | Ryter SW, Xi S, Hartsfield CL, Choi AM. Mitogen activated protein kinase (MAPK) pathway regulates heme oxygenase-1 gene expression by hypoxia in vascular cells. Antioxid Redox Signal. 2002;4:587-592. [PubMed] [DOI] |
| 8. | Lu R, Peng J, Xiao L, Deng HW, Li YJ. Heme oxygenase-1 pathway is involved in delayed protection induced by heat stress against cardiac ischemia-reperfusion injury. Int J Cardiol. 2002;82:133-140. [PubMed] [DOI] |
| 9. | Singhal AB, Wang X, Sumii T, Mori T, Lo EH. Effects of normobaric hyperoxia in a rat model of focal cerebral ischemia-reperfusion. J Cereb Blood Flow Metab. 2002;22:861-868. [PubMed] [DOI] |
| 10. | Naughton P, Foresti R, Bains SK, Hoque M, Green CJ, Motterlini R. Induction of heme oxygenase 1 by nitrosative stress. A role for nitroxyl anion. J Biol Chem. 2002;277:40666-40674. [PubMed] [DOI] |
| 11. | Fujii H, Takahashi T, Nakahira K, Uehara K, Shimizu H, Matsumi M, Morita K, Hirakawa M, Akagi R, Sassa S. Protective role of heme oxygenase-1 in the intestinal tissue injury in an experimental model of sepsis. Crit Care Med. 2003;31:893-902. [PubMed] [DOI] |
| 12. | Vicente AM, Guillín MI, Alcaraz MJ. Participation of heme oxygenase-1 in a model of acute inflammation. Exp Biol Med (Maywood). 2003;228:514-516. [PubMed] [DOI] |
| 13. | De las Heras D, Fernández J, Ginès P, Cárdenas A, Ortega R, Navasa M, Barberá JA, Calahorra B, Guevara M, Bataller R. Increased carbon monoxide production in patients with cirrhosis with and without spontaneous bacterial peritonitis. Hepatology. 2003;38:452-459. [PubMed] [DOI] |
| 14. | Carratu P, Pourcyrous M, Fedinec A, Leffler CW, Parfenova H. Endogenous heme oxygenase prevents impairment of cerebral vascular functions caused by seizures. Am J Physiol Heart Circ Physiol. 2003;285:H1148-H1157. [PubMed] [DOI] |
| 15. | Grasso S, Scifo C, Cardile V, Gulino R, Renis M. Adaptive responses to the stress induced by hyperthermia or hydrogen peroxide in human fibroblasts. Exp Biol Med (Maywood). 2003;228:491-498. [PubMed] [DOI] |
| 16. | Ndisang JF, Zhao W, Wang R. Selective regulation of blood pressure by heme oxygenase-1 in hypertension. Hypertension. 2002;40:315-321. [PubMed] [DOI] |
| 17. | Ndisang JF, Wang R. Alterations in heme oxygenase/carbon monoxide system in pulmonary arteries in hypertension. Exp Biol Med (Maywood). 2003;228:557-563. [PubMed] [DOI] |
| 18. | Motterlini R, Clark JE, Foresti R, Sarathchandra P, Mann BE, Green CJ. Carbon monoxide-releasing molecules: characterization of biochemical and vascular activities. Circ Res. 2002;90:E17-E24. [PubMed] [DOI] |
| 19. | Jaggar JH, Leffler CW, Cheranov SY, Tcheranova D, E S, Cheng X. Carbon monoxide dilates cerebral arterioles by enhancing the coupling of Ca2+ sparks to Ca2+-activated K+ channels. Circ Res. 2002;91:610-617. [PubMed] [DOI] |
| 20. | Naik JS, Walker BR. Heme oxygenase-mediated vasodilation involves vascular smooth muscle cell hyperpolarization. Am J Physiol Heart Circ Physiol. 2003;285:H220-H228. [PubMed] [DOI] |