修回日期: 2004-09-13
接受日期: 2004-09-19
在线出版日期: 2004-12-15
目的: 探讨抗血管生成基因转染治疗胰腺癌的可行性.
方法: 构建反向插入VEGF165cDNA的复制缺陷型腺病毒载体, 体外转染SW1990细胞, MTT法检测重组腺病毒转染对细胞生长的影响. Northern blot和ELISA检测转染前后SW1990细胞VEGF的mRNA水平和蛋白表达. 裸鼠皮下种植瘤瘤体内注射重组腺病毒, CD31染色观察反义VEGF重组腺病毒转染对裸鼠种植瘤微血管密度和肿瘤生长速度的影响.
结果: 重组腺病毒体外转染并不影响SW1990细胞的生长速度. Northern blot和ELISA检测在mRNA水平和蛋白水平证实反义VEGF重组腺病毒转染对体外培养的SW1990细胞内源性VEGF表达有明显的下调作用. 体内实验表明反义VEGF重组腺病毒转染可减少肿瘤内微血管数量, 肿瘤生长受到抑制.
结论: 反义VEGF165重组腺病毒可以抑制胰腺癌的血管生成和肿瘤的生长, 为抗血管生成的基因治疗奠定了基础.
引文著录: 邵成浩, 胡先贵, 刘瑞, 张怡杰, 唐岩, 曹贵松. 血管内皮生长因子反义核酸治疗裸鼠皮下种植胰腺癌. 世界华人消化杂志 2004; 12(12): 2916-2918
Revised: September 13, 2004
Accepted: September 19, 2004
Published online: December 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2916-2918
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2916.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2916
胰腺癌细胞能过度表达并分泌血管内皮生长因子(vascular endothelial growth factor, VEGF), VEGF表达与胰腺癌的微血管数量、肿瘤的局部进展和肝脏转移密切相关, 高VEGF表达的患者预后不良[1-3]. 我们构建反向携带VEGF165cDNA的重组腺病毒载体, 观察VEGF165反义核酸对胰腺癌裸鼠皮下种植瘤的生长及血管生成的影响, 为抗胰腺癌血管生成的基因治疗提供依据.
含有513 bp的人全长VEGF165cDNA基因片断的质粒由长海医院心脏外科研究所黄盛东博士惠赠; 腺病毒表达载体试剂盒购自日本Takara公司; 限制性内切酶等各种工 具酶购自BioLabs公司; 质粒纯化试剂盒和RNA抽提试剂盒购自Qiagen公司; 胎牛血清购自Gibco公司; PCR引物由上海生工公司合成; VEGF ELISA试剂盒购自美国R&D公司; 免疫组化一抗购自福建迈新公司; EnVision二步法免疫组化试剂盒购自Daco公司; 报告基因大肠杆菌Lac-Z重组腺病毒(Ad-LacZ)由长海医院心脏外科研究所董书强博士惠赠; 人胚肾细胞株293(ATCC CRL-1573)购自美国ATCC; 人胰腺癌细胞标准株SW1990为本院消化内科实验室保存并提供; 健康纯种SPF级BALB/C 6周龄♀裸鼠18只, 购自上海药物研究所实验中心.
反义VEGF重组腺病毒(Ad-αVEGF)的制备方法见文献[4]. 对数生长期拟传代的SW1990细胞, 消化重悬后用培养液调整细胞浓度为103 /孔, 接种于96孔板. 细胞分3组, 每组设3排平行复孔. 用107PFU的Ad-αVEGF, Ad-LacZ各10 μL(MOI = 100)加入各组的每孔细胞转染1 h, PBS作对照组. 再分别加入培养液, 终体积为200 μL. 3, 5 d更换培养液. 以转染当天为0 d, 以后各组每天取3孔, 吸除培养液, 加入MTT液15 μL, 放入培养箱中孵化4 h. 吸除MTT液, 加入DMSO150 μL, 振荡10 min后, 在96孔酶标仪570 nm处读取OA值. 结果取均值. 扩增VEGF165pBV220质粒, 碱裂解法抽提质粒, EcoR I/BamH I双酶切质粒DNA, 酶切产物10 g/L琼脂糖凝胶电泳后获得长度为513 bp的cDNA探针, 割胶回收, 最后电泳判断所得VEGFcDNA探针浓度为约10 mg/L, -20 ℃保存备用. 探针标记: 按随机引物标记盒说明书进行, 即1.5 mL离心管中加TE40 μL, 探针5 μL(约50 ng), 引物P1, P2各2 μL, 离心混匀, 100 ℃水浴变性5 min, 冰浴2 min, 转移到标记试管中, 混匀, 加入[α-32P]dCTP 5 μL, 混匀, 37 ℃水浴20 min, 加入0.2 moL/L的EDTA5 μL终止反应, 备用.
1.2.1 反义VEGF对SW1990 VEGFmRNA表达的影响: 对数生长期拟传代的SW1990细胞, 消化重悬后按密度为2×106接种于15 cm的培养平皿中, 细胞过夜培养. 用MOI = 100即109PFU的Ad-αVEGF 200 μL转染细胞1 h后加入10 mL培养液. 分别于1, 2, 3, 4, 5, 6 d消化、离心收集细胞沉淀液氮冷冻备RNA抽提. 按Qiagen公司试剂盒说明行细胞总RNA抽提. 制备含甲醛的10 g/L琼脂胶, 加入20 mg的样本总RNA, 电泳后转到尼龙膜, 55 ℃预杂交6 h, 弃预杂交液, 加入杂交液, 将标记好的VEGF探针, 95 ℃变性5 min, 加入杂交管中, 杂交18 h. 洗膜后用X光片放射自显影, 经显影、定影、水洗后, 室温凉干, 计算机图像分析仪扫描分析, 测定各点杂交信号的面积和灰度, 用同一样品的GAPDH杂交信号值作对照.
1.2.2 反义VEGF转染后SW1990细胞VEGF蛋白的表达: 对数生长期拟传代的SW1990细胞, 消化重悬后用培养液调整细胞浓度为1×105 /孔. 接种于4块6孔板, 加入培养液2 mL. 细胞过夜培养, 分3组, 每组3孔. 吸尽培养液, 用100 MOI, 即108PFU的Ad-αVEGF、Ad-LacZ各10 μL转染细胞1 h后加入2 mL培养液, 用100 mL/L的小牛血清RPMI1640培养液作对照组(mock infection). 分别于3, 5, 7, 9 d收集培养上清. 收集上清前36 h, 吸除培养液, 用2 mL无血清培养液洗3次, 加入无血清培养液2 mL孵育6 h.吸除培养液, 用2 mL无血清培养液洗1次. 加入1 mL含20 mL/L小牛血清RPMI1640培养液孵育24 h. 吸取上清液, 放入Eppendorf管中-70 ℃冻存. 采用人VEGF ELISA检测试剂盒. 严格按照试剂盒操作说明书进行, 最后用Bio-Rad3550-UV型酶标仪在波长450 nm纠正波长570 nm条件下读取OA值. 样品VEGF浓度从VEGF标准曲线查得. 结果取均值.
1.2.3 裸鼠皮下种植瘤模型实验: SW1990细胞数1×1010 /L, 0.2 mL(5×106)注射于18只6周龄裸鼠颈部皮下. 种植瘤生长1 wk后, 按裸鼠荷瘤体积的大小分为3部分, 各部分间随机编号, 用系统抽样法分为3组, 每组各6只. 分别为: PBS对照组、Ad-LacZ对照组和Ad-αVEGF治疗组. 抽取经调整滴度为109PFU的重组腺病毒100 μL, 在肿瘤长径注射点处多方向瘤内注射, 对照组注射等量的Ad-LacZ和PBS. 隔日1 次, 共4次. 转染1 mo后颈椎脱臼法处死裸鼠, 切取肿瘤, 常规病理切片, 行CD31染色检测肿瘤的微血管密度.
统计学处理 实验数据以mean±SD表示, 组内显著性检验采用t检验, 采用SPSS10.0软件实施统计.
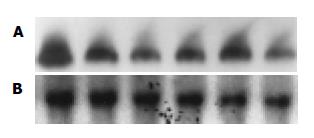
按公式计算VEGFmRNA表达的相对量, 即VEGFmRNA = (VEGFmRNA杂交信号面积×杂交信号灰度)/(GAPDH杂交信号面积×杂交信号灰度), 图像分析仪扫描杂交信号的密度(图1A, B). 结果表明, 反义VEGF后转染3 d, 肿瘤细胞内源性VEGFmRNA表达下降, 4 d达高峰, 5 d开始回升. 使用美国R&D公司VEGF ELISA检测试剂盒定量检测肿瘤细胞分泌到培养上清中VEGF蛋白(表1).
| 分组 | 第3 d | 第5 d | 第7 d | 第9 d |
| Ad-αVEGF | 633.3±90.9 | 913.6±65.4 | 652.0±42.1 | 683.6±33.6 |
| Ad-LacZ | 860.7±72.2 | 1 515.7±329.6 | 2 020.7±126.5 | 2 346.7±126.5 |
| 未转染组 | 813.0±68.2 | 1 479.7±92.1 | 1 903.7±117.6 | 2 202.7±37.6 |
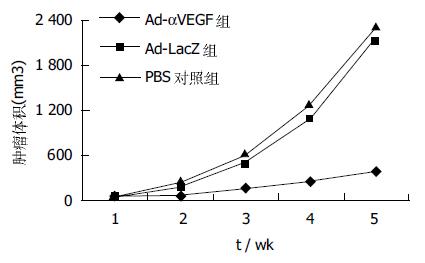
瘤体内直接注射重组腺病毒, 隔日用游标卡尺测量肿瘤的长、短径, 按公式肿瘤体积=长径×短径2×0.4计算肿瘤的体积. 结果, 治疗组和对照组的肿瘤体积均有增加, 反义VEGF组比LacZ组、PBS对照组肿瘤增幅明显减少(P<0.01, 图2). LacZ组与PBS对照组之间无明显差异(P>0.05). 提示治疗组裸鼠肿瘤生长受到抑制.
CD31染色定位于血管内皮细胞, 经免疫组化染色的微血管呈棕黄色, 微血管计数参照Weidner et al[5]报道的方法. Ad-αVEGF组、LacZ组、PBS对照组肿瘤MVD分别为12±3, 26±5, 25±4, 反义VEGF组肿瘤微血管密度明显少于LacZ组和对照组(P<0.01), LacZ组与对照组之间无明显差别(P>0.05).
我们的前期研究已证实VEGF表达水平能反映胰腺癌细胞的恶性程度, 可作为胰腺癌分化、转移与预后分析的指标[3]. 以VEGF及其受体为靶点的抗血管治疗是目前研究的一个热点, 多项研究表明, 阻断VEGF信号传导能抑制胰腺癌的发展、浸润和转移[6-8]. 反义RNA系将某种特异基因cDNA反向连接到质粒或病毒等表达载体上, 导入肿瘤细胞后转录出反义RNA, 他与相应信使RNA(mRNA)形成双链后阻止其翻译和表达, 在mRNA水平阻断靶基因的表达[9-11]. 我们采用复制缺陷性腺病毒介导的反义核酸技术, 探讨阻断VEGF的表达对胰腺癌的血管生成和肿瘤生长的影响.
MTT检测结果表明, 转染Ad-αVEGF、Ad-LacZ和对照组细胞增生速度无明显差别, 没有发现反义VEGF转染、LacZ转染对肿瘤细胞生长有抑制或促进作用, 提示腺病毒转染反义VEGF和LacZ基因对SW1990细胞的体外生长没有影响. 反义VEGF转染能否下调SW1990细胞表达VEGF是实验的关键. Northern blot是定量检测mRNA的最常用方法. 实验结果表明反义VEGF能明显下调肿瘤细胞内源性VEGF的表达, 转染后3、4 d抑制作用达高峰. ELISA结果在蛋白分泌水平上证实反义VEGF转染可以下调SW1990细胞分泌VEGF蛋白, 反义VEGF转染后, 肿瘤细胞培养上清中分泌型VEGF蛋白含量下降, 5-7 d达最高点.
体内实验结果表明, 反义VEGF治疗组肿瘤的生长速度比Ad-LacZ对照组和PBS对照组明显减慢, 用CD31染色标记肿瘤内微血管, 发现反义VEGF治疗组瘤体内微血管密度明显少于对照组. 上述结果提示反义VEGF能通过抑制肿瘤细胞VEGFmRNA的表达, 肿瘤细胞内VEGF的蛋白表达和分泌减少, 其特异性促进血管内皮细胞有丝分裂的作用下降, 导肿瘤内血管生成受抑制, 肿瘤的生长减慢. 我们使用腺病毒介导的反义VEGF可以抑制胰腺癌种植瘤的血管生成和生长; 同时也说明, VEGF可能是胰腺癌血管生成的主要调节因子, 缺少VEGF不能被其他血管生成因子, 如表皮生长因子或碱性成纤维细胞生长因子等所完全补偿. 本实验结果为今后继续开展胰腺癌的抗血管生成基因治疗奠定了基础.
编辑: N/A
| 1. | Niedergethmann M, Hildenbrand R, Wostbrock B, Hartel M, Sturm JW, Richter A, Post S. High expression of vascular endothelial growth factor predicts early recurrence and poor prognosis after curative resection for ductal adenocarcinoma of the pancreas. Pancreas. 2002;25:122-129. [PubMed] [DOI] |
| 2. | Kuwahara K, Sasaki T, Kuwada Y, Murakami M, Yamasaki S, Chayama K. Expressions of angiogenic factors in pancreatic ductal carcinoma: a correlative study with clinicopathologic parameters and patient survival. Pancreas. 2003;26:344-349. [PubMed] [DOI] |
| 4. | 邵 成浩, 胡 先贵, 刘 瑞, 唐 岩, 曹 贵松, 黄 盛东, 李 白翎, 仲 剑平. 腺病毒介导的反义血管内皮生长因子基因转染治疗胰腺癌的实验研究. 第二军医大学学报. 2002;23:995-998. |
| 5. | Weidner N, Folkman J, Pozza F, Bevilacqua P, Allred EN, Moore DH, Meli S, Gasparini G. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma. J Natl Cancer Inst. 1992;84:1875-1887. [PubMed] [DOI] |
| 6. | Baker CH, Solorzano CC, Fidler IJ. Blockade of vascular endothelial growth factor receptor and epidermal growth factor receptor signaling for therapy of metastatic human pancreatic cancer. Cancer Res. 2002;62:1996-2003. [PubMed] |
| 7. | Büchler P, Reber HA, Ullrich A, Shiroiki M, Roth M, Büchler MW, Lavey RS, Friess H, Hines OJ. Pancreatic cancer growth is inhibited by blockade of VEGF-RII. Surgery. 2003;134:772-782. [PubMed] [DOI] |
| 8. | Wei D, Wang L, He Y, Xiong HQ, Abbruzzese JL, Xie K. Celecoxib inhibits vascular endothelial growth factor expression in and reduces angiogenesis and metastasis of human pancreatic cancer via suppression of Sp1 transcription factor activity. Cancer Res. 2004;64:2030-2038. [PubMed] [DOI] |
| 9. | Gu ZP, Wang YJ, Li JG, Zhou YA. VEGF165 antisense RNA suppresses oncogenic properties of human esophageal squamous cell carcinoma. World J Gastroenterol. 2002;8:44-48. [PubMed] [DOI] |
| 10. | Gu S, Liu CJ, Qiao T, Sun XM, Chen LL, Zhang L. Inhibitory effect of antisense vascular endothelial growth factor 165 eukaryotic expression vector on proliferation of hepatocellular carcinoma cells. World J Gastroenterol. 2004;10:535-539. [PubMed] [DOI] |
| 11. | Förster Y, Meye A, Krause S, Schwenzer B. Antisense-mediated VEGF suppression in bladder and breast cancer cells. Cancer Lett. 2004;212:95-103. [PubMed] [DOI] |