修回日期: 2004-09-13
接受日期: 2004-09-30
在线出版日期: 2004-12-15
目的: 筛选并克隆人肝细胞cDNA文库中与乙型肝炎病毒(HBV)前-前-S蛋白相互作用蛋白的基因, 探讨前-前-S在HBV致病中的作用.
方法: 构建前-前-S的酵母细胞表达载体, 采用酵母双杂交系统筛选人肝细胞cDNA文库, 利用核苷酸数据库及生物信息学技术, 对于筛选结果进行分析.
结果: 获得了54个与前-前-S蛋白特异性结合的阳性克隆, 其中包括30种已知蛋白基因和8个未知功能基因.
结论: 克隆出与乙型肝炎病毒前-前-S蛋白结合的肝细胞蛋白基因, 为进一步研究前-前-S在HBV致病中的作用奠定了基础.
引文著录: 蔺淑梅, 张树林, 成军, 刘敏, 王琳, 王建军, 杨倩, 黄燕萍, 白桂芹. 肝细胞cDNA文库中乙型肝炎病毒前-前-S蛋白结合蛋白基因筛选. 世界华人消化杂志 2004; 12(12): 2907-2910
Revised: September 13, 2004
Accepted: September 30, 2004
Published online: December 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2907-2910
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2907.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2907
乙型肝炎病毒(HBV)感染常见, 不仅引起急、慢性病毒性肝炎, 而且与肝纤维化(LF)、肝细胞癌(HCC)的发生发展密切相关[1-12]. HBV是很小的包膜病毒, 病毒基因组结构精密, 约3 200个碱基对(bp), HBV至少有含4个开放读码框架(ORF), 分别命名为S、C、P、X区, 4个ORF中表达的氨基酸长度不同, 其生物学功能也不相同, 其中全S区又因不同的起始密码子(ATG)而又人为的分为前-S1、前-S2和S三个区, 前-S1、前-S2和表面抗原主蛋白是按照同一开放读码顺序(in frame)进行翻译的. 最近董菁et al[13]对于中国HBV流行株的全基因序列进行克隆和序列分析, 发现在前-S1区之前还存在一个ORF, 长度135 bp, 编码45 aa, 将其命名为前-前-S区, 并在既往已克隆的HBV基因组中得到了证实. 杨倩et al[14]对前-前-S基因启动子序列的鉴定和转录活性的研究证实, 前-前-S-基因ORF上游的序列具有启动子活性, 进一步证实了董菁发现的前-前-S编码基因存在. 基因是通过蛋白质之间的相互作用而实现其功能的, 病毒蛋白和肝细胞蛋白之间的作用是病毒致病的关键[15-16]. 为进一步研究前-前-S-基因在HBV致病中的作用, 我们利用酵母双杂交技术寻找其与肝细胞中相互作用的蛋白, 并进一步探明其作用机制, 这对于明确HBV致病机制, 有效防治乙型肝炎有着重要意义.
pGBKT7-BD克隆载体, Saccharomyces cerevisiae AH109酵母株、Y187酵母株(K1612-1)、人cDNA肝细胞文库等均购自Clontech公司. 酵母YPDA培养基、SD/-Trp、SD/-Leu、SD/-Trp/-Leu、SD/-Trp/-Leu/-His、SD/-Trp/-Leu/-His/-Ade培养基, X-α-半乳糖苷酶(Gal)等购自Clontech公司, 半硫酸腺苷、醋酸锂购自Sigma公司. 复杂高效感受态(FSB), 本室自制. 大肠杆菌(DH5α), 本室保存.
1.2.1 肝细胞文库的扩增与转化: 按照文库扩增手册操作滴定肝细胞文库原液, 欲达到3×1012 cfu/L, 于LB-Amp琼脂平板进行扩增, 刮取收集菌液, 以Qiagene Maxi试剂盒提取质粒DNA, 高效醋酸锂法转入酵母细胞Y187, 于SD/Leu琼脂培养基生长扩增, 同时滴定转化文库, 收集酵母菌落, 以1×106 /份分装备用.
1.2.2 诱饵质粒载体的构建及酵母配合实验: 用多聚酶链反应(PCR)法扩增HBV前-前-S蛋白编码基因, 连接入酵母表达载体pGBKT-7中构建诱饵质粒, 酶切鉴定后, 用醋酸锂法转入酵母细胞AH109. 挑取2-3 mm大小在SD/-Trp培养基上生长的转化了pGBKT7-前-前-S质粒的酵母AH109单菌落接种于SD/-Trp培养基中, 30 ℃ 250 r/min振摇过夜, 次日离心后用2×YPDA培养液5 mL重悬细胞, 计数浓度大于1×1012 /L, 与肝细胞文库酵母细胞在50 mL 2×YPDA中30 ℃轻摇配合约22 h, 离心后用0. 25×YPDA 8 mL重悬细胞, 分别铺板于150 mm的SD/-Trp/-Leu/-His(3缺), SD/-Trp/-Leu/-His/-Ade(4缺)培养基板各25块上, 同时将配合产物按1:100、1:1 000、1:10 000铺于SD/-Trp、SD/-Leu及SD/-Trp/-Leu培养基上检验配合效率. 生长6-18 d后挑取直径大于3 mm的菌落再次画线于铺有X-α-gal的4缺培养基上检查α-半乳糖苷酶活性, 认为在此培养基上能生长且变成蓝色的为真阳性菌落.
1.2.3 阳性质粒的克隆和分析: 挑取真正的阳性集落按照试剂盒提供的操作指南Lyticase法提取酵母质粒. 提取的质粒以复杂冰冻高效感受态方法转化大肠杆菌, 于含有氨苄青霉素的SOB平板培养, 所获得的菌落酶切鉴定后测序. 阳性克隆DNA测序后, 提交GenBank比对, 进行生物信息学分析, 并把所获新的基因序列存入GenBank数据库.
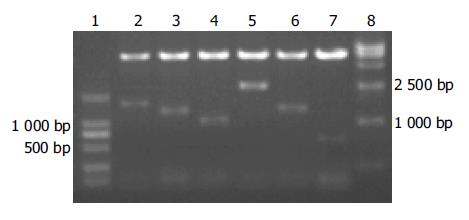
因质粒pACT2内含有两个BglⅡ酶切位点, 分别位于多克隆位点两侧, 故使用该内切酶消化将释放出所筛选到的肝细胞文库的基因片段(图1). 图1中出现的各个大小不同的DNA片段表明我们筛选的克隆为阳性克隆.
我们共挑选54个阳性克隆测序, 测序结果与GenBank数据库进行初步比较, 其中8个克隆为未知功能基因, 其余46个均与已知基因序列高度同源(96-100%), 详细结果(表1).
| 筛选出的目的基因 | 相同克隆数 | 同源性(%) |
| 人类醛缩酶B | 9 | 99-100 |
| 人类金属硫蛋白2A | 4 | 99-100 |
| 人类铁蛋白轻链 | 3 | 97-100 |
| 人类转铁蛋白受体2α | 1 | 99 |
| 人类金属蛋白酶组织抑制因子1 | 2 | 99 |
| 人类成纤维细胞生长因子受体4 | 1 | 99 |
| 人类精氨酸酶(肝) | 2 | 100 |
| 人类补体C8α亚单位 | 1 | 99 |
| 人类补体C8β亚单位 | 1 | 100 |
| 人类核孔p54蛋白质 | 1 | 100 |
| 人类羧酸酯酶1(单核细胞/巨噬细胞丝氨酸酯酶1) | 1 | 99 |
| 人类羟酰辅酶A脱氢酶 | 1 | 99 |
| 人类细胞色素C氧化酶Ⅱ | 1 | 99 |
| 人类细胞色素P-450 s-甲基乙苯妥英-4-羟化酶 | 1 | 99 |
| 细胞色素P-450(家族2, 亚家族E) | 2 | 99 |
| 人类支链alpha酮酸脱氢酶激酶前体 | 1 | 98 |
| 人类氨基己糖酯(苷)酶A(α多肽) | 1 | 99 |
| 人类苯丙氨酸羟化酶 | 1 | 99 |
| 人类NADH脱氢酶(辅酶Q10)β亚成分 | 1 | 98 |
| 人类乙酰乳酸合酶同功酶 | 1 | 99 |
| 人类高半胱氨酸甲基转移酶2 | 1 | 98 |
| 人类3-羟-3-甲基戊二酰辅酶A裂解酶 | 1 | 99 |
| 人类谷氨酸氨连接酶 | 1 | 100 |
| 人类alpha-2糖蛋白1(人类锌alpha-2糖蛋白) | 1 | 99 |
| 人类蛋白酶体26S亚单位 | 1 | 100 |
| 人类视黄醇结合蛋白4 | 1 | 100 |
| 人类锌alpha2糖蛋白 | 1 | 96 |
| 人类酶原颗粒蛋白16 | 1 | 100 |
| 人类DAZ相关蛋白2 | 1 | 98 |
| 人类RNA聚合酶Ⅱ羧基末端结构域(CTD)小磷酸酯酶2 | 1 | 100 |
| 未知功能基因 | 8 | 98-100 |
董菁et al[17-19]利用长距离精确聚合酶链反应(LA-PCR)和TA克隆-测序技术展示了同一患者来源的HBV基因组不同克隆之间的变异程度, 证明患者血清内的序列是不完全相同的, 符合准种表现. 董菁et al[13]在分析所获得的5个克隆的过程中, 在前-S1区之上游发现还存在一个ORF, 长度135 bp, 编码45 aa, 并将其命名为前-前-S区. 选择的GenBank中6个其他克隆株进行比较, 其中3个克隆具有前-前-S区ORF, 另3个克隆由于在前-前-S起始密码子的部位发生点替换突变而导致前-前-S区不能表达. 董菁在GenBank中选择不同血清型的HBV基因组全序列, 应用DNASIS软件重新确定其ORF, 结果发现甘人宝et al[20]、Mukaide et al[21]、Okamoto et al[22]克隆的HBV基因组序列中均存在前-前-S区ORF. 同时利用NIH网站的BLAST软件, 将前-前-S区编码氨基酸序列输入后进行同源性搜索, 结果发现5个克隆中含有的氨基酸序列与董菁获得的序列有较高的同源性, 由此认为前-前-S区是真实存在的.
HBV表面抗原不仅是病毒遗传结构的包装蛋白, 而且截短型表面抗原中蛋白和大蛋白具有反式激活作用[13], 这种功能是与表面抗原的多种形式激活癌基因有关[23], 董菁进一步应用DNA SIS软件的蛋白质分析功能分析了前-前-S、前-S1、前-S2和S基因的完全表达产物, 前-前-S区较以往认为的大蛋白多出一个小的疏水区, 那么全S蛋白(含前-前-S区)与大蛋白有不小的差异. 其中的19(21)个疏水氨基酸在前-前-S区形成了一个小的疏水功能域, 可能与蛋白的空间折叠或表面蛋白合成后分泌有关. 进一步研究前-前-S所编码蛋白的功能及与之相互作用的蛋白具有重要意义.
我们应用酵母双杂交技术成功的筛选出肝细胞文库中与前-前-S蛋白相互作用蛋白, 共获得54个阳性克隆, 经过测序分析及与GenBank数据库进行比较, 其中8个克隆为未知功能基因, 其余46均为已知蛋白基因, 值得我们关注的是筛选到一些与肝损伤及肝纤维化有关的蛋白基因. 已有的研究显示, 铁代谢异常与肝损伤密切相关, 有报道铁过载可增加HBV所致的肝细胞损害. 铁是DNA、RNA和蛋白质合成的必须辅助因子, 病毒侵入肝细胞后, 就利用细胞的蛋白质和核酸的合成机制进行复制, 细胞内铁可能参与了这个过程, 从而有利于病毒的复制进一步造成肝损伤; 铁及其结合蛋白具有免疫调节功能, 铁过量或缺乏可破坏免疫调节的平衡, 导致严重的有害的生理效应[24]. 表明HBV感染的发病与铁代谢可能有一定的联系. 进一步的研究还发现, 体内铁含量与干扰素(IFN)疗效密切关系, 血清铁蛋白水平与IFN疗效明显负相关, 高血清铁蛋白水平的患者对IFN疗效较差[25]. 转铁蛋白受体(TfR)是一种跨膜二聚体糖蛋白, 其功能是与Fe-Tf(转铁蛋白)复合物结合后通过Tf循环将铁从细胞外转运到细胞内. 转铁蛋白是血液中一种主要的糖蛋白, 负责将肝组织(是铁贮藏的主要场所)的铁向其他组织的细胞运输. TfR是细胞摄入铁的关键, 他表达的数量直接影响细胞的摄铁量. 我们的研究发现前-前-S蛋白可与铁代谢有关的两个关键蛋白(铁蛋白及转铁蛋白受体)相互作用, 推测HBV感染致肝损伤可能与HBV感染致铁代谢障碍有关, 为HBV感染致肝损伤机制的研究开辟了新的思路.
另外值得我们关注的是人类金属蛋白酶组织抑制因子1(TIMP-1), 在肝纤维化过程中TIMP-1通过对基质金属蛋白酶(MMPs, 主要是间质胶原酶即MMP-1)活性的抑制, 抑制了Ⅰ、Ⅲ型胶原等细胞外基质(ECM)的降解, 从而导致ECM在肝脏内的过度沉积, 促进了肝纤维化的形成和发展. 研究者发现在病损肝脏中TIMP-1的表达明显增高, TIMP-1与肝纤维化的发生发展紧密相关[26-27]. 黄宇琦et al的动物实验表明, 肝纤维化发生发展过程中TIMP-1表达逐渐增强, 致二者的平衡被破坏, 大量TIMP-1的出现使间质胶原酶(人MMP-1, 大鼠MMP-13)MMP-13失去活性, 造成肝损伤后增生的ECM成分尤其是Ⅰ、Ⅲ型胶原降解减少、沉积增多, 促进了肝纤维化、肝硬化的形成[28]. 杨长青et al研究发现, 反义TIMP-1对肝纤维化有一定的逆转作用[29]. 我们的研究发现, 前-前-S蛋白能与人类金属蛋白酶组织抑制因子1结合, 这一结果将为HBV感染引起肝纤维化机制研究提供新的领域. 实验还筛选到补体8α及补体8β亚单位, 提示前-前-S蛋白可能通过补体途径影响免疫系统功能, 为研究HBV免疫损害方面的机制提出了新的思路.
除上述结果外, 我们还筛选到多种能与前-前-S蛋白结合的蛋白, 表明前-前-S蛋白可能具有广泛的作用, 通过多种机制参与HBV感染的致病过程, 其具体的作用机制尚需进一步研究.
编辑: N/A
| 8. | Wang XZ, Jiang XR, Chen XC, Chen ZX, Li D, Lin JY, Tao QM. Seek protein which can interact with hepatitis B virus X protein from human liver cDNA library by yeast two-hybrid system. World J Gastroenterol. 2002;8:95-98. [PubMed] [DOI] |
| 9. | Stuyver LJ, Locarnini SA, Lok A, Richman DD, Carman WF, Dienstag JL, Schinazi RF. Nomenclature for antiviral-resistant human hepatitis B virus mutations in the polymerase region. Hepatology. 2001;33:751-757. [PubMed] [DOI] |
| 10. | Walton CM, Wu CH, Wu GY. A ribonuclease H-oligo DNA conjugate that specifically cleaves hepatitis B viral messenger RNA. Bioconjug Chem. 2001;12:770-775. [PubMed] [DOI] |
| 11. | Wang X, Grammatikakis N, Hu J. Role of p50/CDC37 in hepadnavirus assembly and replication. J Biol Chem. 2002;277:24361-24367. [PubMed] [DOI] |
| 12. | Stuyver LJ, Locarnini SA, Lok A, Richman DD, Carman WF, Dienstag JL, Schinazi RF. Nomenclature for antiviral-resistant human hepatitis B virus mutations in the polymerase region. Hepatology. 2001;33:751-757. [PubMed] [DOI] |
| 14. | 杨 倩, 董 菁, 成 军, 刘 妍, 洪 源, 王 建军, 张 树林. 乙型肝炎病毒基因组中前-前-S编码基因启动子序列的确定及转录活性的鉴定. 解放军医学杂志. 2003;28:761-762. |
| 15. | Galibert F, Mandart E, Fitoussi F, Tiollais P, Charnay P. Nucleotide sequence of the hepatitis B virus genome (subtype ayw) cloned in E. coli. Nature. 1979;281:646-650. [PubMed] [DOI] |
| 16. | Charnay P, Mandart E, Hampe A, Fitoussi F, Tiollais P, Galibert F. Localization on the viral genome and nucleotide sequence of the gene coding for the two major polypeptides of the hepatitis B surface antigen (HBs Ag). Nucleic Acids Res. 1979;7:335-346. [PubMed] [DOI] |
| 18. | 董 菁, 成 军, 王 勤环, 皇甫 竞坤, 施 双双, 张 国庆, 洪 源, 李 莉, 斯 崇文. 慢性乙型肝炎患者体内乙型肝炎病毒DNA序列异质性及准种特点的研究. 中华医学杂志. 2002;82:81-85. |
| 21. | Mukaide M, Kumazawa T, Hoshi A, Kawaguchi R, Hikiji K. The complete nucleotide sequence of hepatitis B virus, subtype adr (SRADR) and phylogenetic analysis. Nucleic Acids Res. 1992;20:6105. [PubMed] [DOI] |
| 22. | Okamoto H, Imai M, Shimozaki M, Hoshi Y, Iizuka H, Gotanda T, Tsuda F, Miyakawa Y, Mayumi M. Nucleotide sequence of a cloned hepatitis B virus genome, subtype ayr: comparison with genomes of the other three subtypes. J Gen Virol. 1986;67:2305-2314. [PubMed] [DOI] |
| 24. | Walker EM Jr, Walker SM. Effects of iron overload on the immune system. Ann Clin Lab Sci. 2000;30:354-365. [PubMed] |
| 25. | Distante S, Bjøro K, Hellum KB, Myrvang B, Berg JP, Skaug K, Raknerud N, Bell H. Raised serum ferritin predicts non-response to interferon and ribavirin treatment in patients with chronic hepatitis C infection. Liver. 2002;22:269-275. [PubMed] [DOI] |
| 26. | Zhang BB, Cai WM, Weng HL, Hu ZR, Lu J, Zheng M, Liu RH. Diagnostic value of platelet derived growth factor-BB, transforming growth factor-beta1, matrix metalloproteinase-1, and tissue inhibitor of matrix metalloproteinase-1 in serum and peripheral blood mononuclear cells for hepatic fibrosis. World J Gastroenterol. 2003;9:2490-2496. [PubMed] [DOI] |
| 27. | Nie QH, Duan GR, Luo XD, Xie YM, Luo H, Zhou YX, Pan BR. Expression of TIMP-1 and TIMP-2 in rats with hepatic fibrosis. World J Gastroenterol. 2004;10:86-90. [PubMed] [DOI] |