修回日期: 2004-09-30
接受日期: 2004-10-11
在线出版日期: 2004-12-15
目的: 对全人源肝癌噬菌体单链抗体库进行鉴定, 筛选肝癌抗体, 同时对抗体的活性进行鉴定.
方法: PCR鉴定阳性重组菌TG1中人肝癌ScFv的插入率. 先以人成纤维细胞黏附后再以肝癌细胞SMMC-7721为抗原对所建抗体库进行3轮"黏附-洗脱-扩增"的亲和筛选. 将筛选后的ScFv进行PCR鉴定及双酶切鉴定; 通过ELISA法鉴定其与人肝癌细胞的结合活性.
结果: ScFv基因插入率为70%. 在亲和筛选过程中, 肝癌噬菌体单链抗体得到富集, 收获率逐轮得到提高, 第3轮为第1轮的214倍. 筛选后的ScFv进行PCR鉴定及双酶切鉴定后, 均可检测到目的基因. 得到3株特异性肝癌单链抗体.
结论: 利用噬菌体抗体库技术结合减数筛选得到了肝癌噬菌体单链抗体及其基因, 且筛选后的抗体片段与人肝癌细胞有特异性的结合活性.
引文著录: 薛国柱, 窦科峰, 赵爱志, 药立波. 全人源肝癌噬菌体单链抗体库的鉴定及筛选. 世界华人消化杂志 2004; 12(12): 2898-2901
Revised: September 30, 2004
Accepted: October 11, 2004
Published online: December 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2898-2901
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2898.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2898
有关抗肿瘤单链抗体(ScFv)的报道较多, 但大多是通过基因工程技术把鼠源杂交瘤抗体改造成小分子单链抗体, 仍属鼠源抗体[1-3]. 我们已利用噬菌体抗体库技术, 从200例原发性肝癌患者的B淋巴细胞中克隆出抗体重链和轻链可变区基因, 以具有氨苄青霉素抗性的pDAN5为载体, 参照Sblattero et al[4]的方法, 构建了全人源肝癌单链抗体噬菌体呈现库. 本文中我们利用该抗体库进行肝癌噬菌体单链抗体基因克隆并进行抗体的活性分析.
表达载体噬菌粒pDAN5、大肠杆菌TG1、肝癌细胞系SMMC-7721由本室保存; 人成纤维细胞系由西京医院烧伤科汤朝武技师惠赠; 辅助病毒M13K07由董红霖博士惠赠; rTaq酶及限制性核酸内切酶Nhe I、BssH II均为大连宝生物产品; 质粒提取试剂盒为杭州维特洁公司产品; PCR引物序列为5'-ACC TATT GCCT ACGG CAGC-3', 5'-ACTTTCAACAGTAGCGGCCGC-3', 由上海基康公司合成.
1.2.1 噬菌体抗体库滴度测定: 将1-10 μL经适当稀释的噬菌体抗体库菌铺于氨苄青霉素培养板, 37 ℃培养过夜, 计数集落, 计算集落形成单位(clone forming unit, cfu).
1.2.2 PCR法鉴定抗体基因插入率: 挑取单个细菌集落, 加入3 mL含氨苄100 mg/L的LB培养过夜, 按质粒提取试剂盒说明书提取质粒, 取2 μL为模板采用25 μL体系, 进行ScFv PCR扩增. 琼脂糖凝胶电泳检测相应的DNA扩增带.
1.2.3 人源肝癌噬菌体ScFv的筛选: 取冻存抗体库菌种1 mL, 进行噬菌体表面呈现, 调整滴度为1015 cfu/L. 先以人成纤维细胞黏附后再以人肝癌细胞系SMMC-7721对初级库进行筛选, 然后以人肝癌细胞SMMC-7721进行黏附筛选. 共进行3轮筛选.
1.2.4 阳性噬菌体单克隆PCR鉴定: 挑取第三轮筛选出的单克隆, 按前述方法提取单克隆质粒进行ScFv基因克隆. 随机挑取20个单克隆, 加入3 mL含100 mg/L氨苄青霉素的LB培养液过夜培养, 常规提取质粒. 以质粒为模板进行PCR反应, 然后以10 g/L琼脂糖凝胶电泳鉴定是否扩增出目的基因.
1.2.5 阳性噬菌体单克隆酶切鉴定: 随机挑取10个单克隆质粒以Nhe I及Bss H II双酶切, 以10 g/L琼脂糖凝胶电泳鉴定是否含有目的基因.
1.2.6 阳性单克隆ScFv活性分析: 挑取阳性单克隆, 以不含目的基因的载体为对照. 按前述方法进行噬菌体表面呈现, 收集上清即为噬菌体抗体. 将单克隆ScFv及对照上清加入接种有人成纤维细胞及肝癌细胞的96孔板过夜, 再加入HRP-羊抗M13 37 ℃温育1 h, 加入TMB显色10 min, 加入2 mol/L硫酸终止反应. 酶标仪读板, 以P/N>2.1为阳性.
经10倍系列稀释, 测定抗体库滴度为7.6×1012 cfu/L.
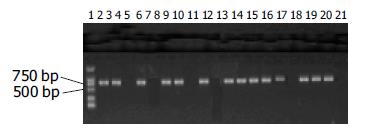
2.2 PCR法检测20个菌落, 14个克隆扩增出ScFv, 目的基因插入率为70%(图1).
以人成纤维细胞黏附后再以人肝癌细胞系SMMC-7721对噬菌体抗体库进行3轮富集筛选, 将每一轮洗脱下来的噬菌体再感染TG1细菌, 并取少量细菌铺盘, 测定噬菌体滴度, 计算每一轮筛选后噬菌体的收获率. 噬菌体收获率由第1轮的2.2×10-5 %增到第3轮的4.7×10-3 %, 共增加了214倍(表1).
| 富集轮次 | 噬菌体滴度(cfu/L) | 噬菌体收获率(%) | |
| 富集前 | 富集后 | ||
| 1 | 1.0×1015 | 2.2×108 | 2.2×10-5 |
| 2 | 1.5×1015 | 3.5×109 | 2.3×10-4 |
| 3 | 1.1×1015 | 5.2×1010 | 4.7×10-3 |
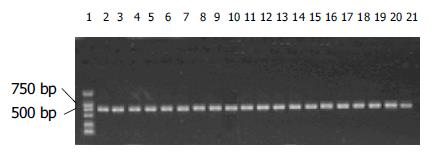
随机挑取10个单克隆质粒以Nhe I及BssH II双酶切, 均放出约750 bp片段(图3).
自从首次报道用小鼠B细胞杂交瘤技术制备mAb以来已有29年. FDA批准同意用mAb治疗也已18年(OKT3). 目前进行临床试验的mAb约有140种, 大部分仍是由鼠杂交瘤技术生产. 而噬菌体抗体为抗体的片段, 分子小、穿透力强、廓清快、异源性低, 而且能在原核系统中表达, 易于生产. 利用抗体库技术可简便地制备出针对不同肿瘤患者多种肿瘤的mAb片段, 这些mAb片段与细胞毒素、破坏细胞的酶和细胞因子等连接后, 可形成对肿瘤细胞有特异性杀伤作用的复合物, 称为免疫毒素或生物导弹. 对感染性疾病、器官移植排斥反应的防治及肿瘤的早期诊断、治疗, 以及手术及化疗后晚期肿瘤的辅助治疗均具有广阔的应用前景[5-7].
噬菌体展示库技术在一定程度上较好地模拟了体内抗体生成亲和力成熟过程, 可快速高效地从大量克隆中筛选展示特异性抗体的噬菌体, 为制备高亲和性的抗体提供了有力工具. 其特点是"他既可识别相应的抗原并与其结合, 又能够感染宿主菌进行再扩增". 该技术可绕过免疫制备全人源性抗体, 可有效避免鼠源性抗体在人体应用时诱发产生人抗鼠抗体(HAMA)等不良反应. 他将表型(与抗原特异结合)与年型(含V区基因)联系在一起, 把识别抗原的能力和进行再扩增的能力结合起来, 是一种高效的筛选体系, 在人源性特异抗体的筛选和制备上独具优势[8-11].
肿瘤抗原种类繁多, 免疫原性低, 难于纯化, 其抗体制备非常困难. 用常规方法制备的单抗往往种类单一, 亲和力较低, 且抗原性强, 限制了其在临床上的应用[9,12-16]. 抗体基因的多样性提供了构建可能靶分子的新方法, 单链抗体的多样性使人们可从人自身噬菌体文库筛选的任何靶抗原上得到. 利用噬菌体抗体库技术建立的抗肿瘤基因文库, 可以绕过杂交瘤, 甚至绕过免疫, 很方便地得到针对多种肿瘤的不同抗原、不同决定簇的功能抗体片段.
目前文献报道的特异性噬菌体抗体, 多数是由固相纯化抗原筛选得到的. 经典筛选技术的前提条件是, 目的抗体所针对抗原的性质明确且可获得到纯品. 对于无法提纯或抗原性质不确定的抗原(如癌细胞表面受体), 采用传统的筛选方法可使抗原失活, 如某些膜蛋白, 因此, 需建立新的筛选系统或对传统的筛选技术进行改进. 直接用细胞系从单链噬菌体抗体库中筛选细胞表面受体结合的抗体已有报道. Kupsch et al[14]用肿瘤细胞作为靶抗原, 已从噬菌体抗体库中筛选出与黑色素瘤细胞特异性结合的抗体.
我们以pDAN5为载体, 从200例原发性肝癌患者的B淋巴细胞中克隆出抗体重链和轻链可变区基因, 构建了全人源肝癌单链抗体库, 滴度达1012 /L. PCR法鉴定目的基因插入率为70%. 以SMMC-7721细胞对该抗体库进行3轮筛选. 在"黏附-洗脱-扩增"的筛选过程中, 回收的噬菌体比率却逐渐增加, 3轮共增加了214倍. 在洗脱下来的噬菌体中, 含ScFv基因的克隆比率也得到明显提高(由筛选前的70%增到筛选后的100%), 证实了特异性噬菌体抗体在筛选过程中得到富集. 因此用噬菌体抗体库技术制备肿瘤单抗不失为一种有效的方法. 首先利用正常人成纤维细胞对非特异性噬菌体抗体进行黏附, 使得筛选出的抗体的特异性更强. 对阳性单克隆ScFv活性分析表明, 90%的克隆与SMMC-7721呈阳性反应, 其中3株与人成纤维细胞呈阴性反应, 对肝癌细胞呈特异性结合. 我们将对这些克隆进一步分析, 以获得理想的全人源抗肝癌噬菌体抗体及其基因.
编辑: N/A
| 1. | Szardenings M. Phage display of random peptide libraries: applications, limits, and potential. J Recept Signal Transduct Res. 2003;23:307-349. [PubMed] [DOI] |
| 2. | Rojas G, Almagro JC, Acevedo B, Gavilondo JV. Phage antibody fragments library combining a single human light chain variable region with immune mouse heavy chain variable regions. J Biotechnol. 2002;94:287-298. [PubMed] [DOI] |
| 3. | 邢 金良, 杨 向民, 张 思河, 姚 西英, 梁 瑞安, 陈 志南. 人鼠嵌合Fab抗体通用表达载体的构建和抗人肝癌相关抗原HAb18G嵌合 Fab抗体的表达. 世界华人消化杂志. 2004;12:271-275. [DOI] |
| 4. | Sblattero D, Bradbury A. Exploiting recombination in single bacteria to make large phage antibody libraries. Nat Biotechnol. 2000;18:75-80. [PubMed] [DOI] |
| 5. | Osbourn J, Jermutus L, Duncan A. Current methods for the generation of human antibodies for the treatment of autoimmune diseases. Drug Discov Today. 2003;8:845-851. [DOI] |
| 6. | Stockwin LH, Holmes S. The role of therapeutic antibodies in drug discovery. Biochem Soc Trans. 2003;31:433-436. [PubMed] [DOI] |
| 7. | Winthrop MD, Denardo GL, Denardo SJ. Antibody phage display applications for nuclear medicine imaging and therapy. Q J Nucl Med. 2000;44:284-295. [PubMed] |
| 8. | Gao C, Mao S, Ronca F, Zhuang S, Quaranta V, Wirsching P, Janda KD. De novo identification of tumor-specific internalizing human antibody-receptor pairs by phage-display methods. J Immunol Methods. 2003;274:185-197. [DOI] |
| 9. | Huston JS, George AJ. Engineered antibodies take center stage. Hum Antibodies. 2001;10:127-142. [PubMed] |
| 10. | Zampieri S, Mahler M, Blüthner M, Qiu Z, Malmegrim K, Ghirardello A, Doria A, van Venrooij WJ, Raats JM. Recombinant anti-P protein autoantibodies isolated from a human autoimmune library: reactivity, specificity and epitope recognition. Cell Mol Life Sci. 2003;60:588-598. [PubMed] [DOI] |
| 11. | Azzazy HM, Highsmith WE Jr. Phage display technology: clinical applications and recent innovations. Clin Biochem. 2002;35:425-445. [DOI] |
| 12. | Popkov M, Rader C, Barbas CF 3rd. Isolation of human prostate cancer cell reactive antibodies using phage display technology. J Immunol Methods. 2004;291:137-151. [PubMed] [DOI] |
| 13. | Heitner T, Moor A, Garrison JL, Marks C, Hasan T, Marks JD. Selection of cell binding and internalizing epidermal growth factor receptor antibodies from a phage display library. J Immunol Methods. 2001;248:17-30. [DOI] |
| 14. | Kupsch JM, Tidman NH, Kang NV, Truman H, Hamilton S, Patel N, Newton Bishop JA, Leigh IM, Crowe JS. Isolation of human tumor-specific antibodies by selection of an antibody phage library on melanoma cells. Clin Cancer Res. 1999;5:925-931. [PubMed] |
| 15. | Ladner RC, Sato AK, Gorzelany J, de Souza M. Phage display-derived peptides as therapeutic alternatives to antibodies. Drug Discov Today. 2004;9:525-529. [PubMed] [DOI] |
| 16. | Korn T, Nettelbeck DM, Völkel T, Müller R, Kontermann RE. Recombinant bispecific antibodies for the targeting of adenoviruses to CEA-expressing tumour cells: a comparative analysis of bacterially expressed single-chain diabody and tandem scFv. J Gene Med. 2004;6:642-651. [PubMed] [DOI] |