修回日期: 2004-08-25
接受日期: 2004-09-04
在线出版日期: 2004-12-15
目的: 探索测定抗H pylori-IgY的方法.
方法: 用间接ELISA法测定幽门螺旋杆菌(H pylori)超声破碎物免疫鸡所产鸡蛋中抗H pylori-IgY的效价. 用间接ELISA法检测抗H pylori-IgY的酸碱及酶稳定性.
结果: 用幽门螺旋杆菌的超声破碎物免疫产蛋母鸡, 可得到高效价的抗幽门螺旋杆菌IgY. IgY的酸稳定性好, 耐胃蛋白酶.
结论: 间接ELISA法简单、准确, 可作为测定IgY的标准方法.
引文著录: 周力, 刘灏, 张永宏, 左丽, 陈阿英, 李永念. 酶联免疫吸附技术测定鸡蛋黄中抗幽门螺杆菌IgY活性. 世界华人消化杂志 2004; 12(12): 2874-2876
Revised: August 25, 2004
Accepted: September 4, 2004
Published online: December 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2874-2876
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2874.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2874
哺乳动物的蛋白刺激鸡产生抗体远比家兔容易[1-3]. 鸡免疫后产生的抗体经血清进入蛋黄, 从蛋黄中能获得大量高质量的特异性免疫球蛋白, 称为IgY[4]. IgY不仅分子质量和等电点不同于哺乳动物的IgG[5], 而且不与哺乳动物的血清补体和Fc端结合[6], 不受类风湿因子的干扰, 不被葡萄球菌A蛋白和G蛋白识别; 因而, 将IgY运用于生物化学和免疫学的基础研究及医学临床检测诊断中具有许多优越性[7-8]. 为了生产鸡的特异性IgY, 须用免疫学方法检测鸡蛋黄中特异性IgY的效价, 以确定免疫效果、设计免疫方法. 我们采用ELISA测定免疫鸡蛋黄中特异性抗体的效价. 以免疫鸡血清A490值(P A490值)和阴性对照鸡血清的A490值(N A490值)之比值, 作为一抗和二抗最适工作浓度的选择标准.
动物: 17周龄的罗曼免疫产蛋母鸡. H pylori菌株NCTC11637、NCTC11639、SS1由中国预防科学院流行病学研究所和贵阳医学院免疫教研室提供, 其余22株由贵阳医学院附属医院临床患者分离. 全部根据细菌学和PCR鉴定(PCR试剂盒由华美生物制品公司提供)为H pylori, 且所有菌株均为VacA基因阳性.
抗原的制备: 参照相关文献[9], 超声破碎H pylori. 健康罗曼免疫蛋鸡4只(17周龄大小, 每只重约1.5 kg), 随机分成两组, 一组免疫, 另一组作对照. 免疫组每只鸡初次注射500 μg抗原. 首次免疫后的7, 14, 21, 28 d各用250 μg抗原注射, 20 wk加强免疫. 免疫前2 d开始收集鸡蛋和采鸡血测抗体. 对照组用不含抗原的成分注射. 抗H pylori-IgY的分离提取: 用水稀释-硫酸铵沉淀法[10]提取抗H pylori-IgY, -80 ℃保存. 测定鸡蛋黄抗H pylori-IgY的ELISA方法.
1.2.1 间接ELISA法: 用包被液稀释抗原, 以2 μg/孔包被96孔板4 ℃, 18-24 h以上. PBS-Tween20(Tween-20, pH7.4, 0.01 mol/L PBS)洗涤3次, 每次3 min; 每孔加入200 μL 0.5 g/L封闭液(pH7.4PBS-Tween 20缓冲液, 含10 g/L小牛血清白蛋白), 37 ℃水浴1 h, 洗涤同前; 加入待测IgY稀释液100 μL/孔, 封盖后37 ℃温浴1 h, 洗涤同前; 加入辣根过氧化物酶标记的兔抗鸡IgY(浓度1:100)100 μL/孔, 封盖后37 ℃温浴1 h, 洗涤同前; 显色液显色20 min后, 滴0.1 mol/L的H2SO4终止反应后, 用酶标仪上在490 nm比色, 测定其吸光度值(A490). 一抗(鸡抗H pylori-IgY)和二抗(鼠抗鸡IgY)最适工作浓度的确定: 用幽门螺旋杆菌超声破碎物抗原以及免疫鸡蛋黄IgY和阴性对照鸡IgY来选择最适工作浓度. 将免疫鸡血清和阴性对照鸡血清分别以1:100倍比稀释至1:1 600, 二抗以1:100倍比稀释至1:400进行ELISA法测定. 以免疫鸡血清A490值(P A490值)和阴性对照鸡血清的A490值(N A490值)之比值, 作为一抗和二抗最适工作浓度的选择标准.
1.2.2 IgY对酶和酸的耐受性: (1)胃蛋白酶消化试验: 在不同pH的抗H pylori-IgY溶液中, 加入1%(E/S)胃蛋白酶(活性1:3 000), 37 ℃水浴0, 1, 2, 3, 4 h中和酸使酶失活. 测A490值; (2)胰蛋白酶消化试验: 在pH8.0的抗H pylori-IgY溶液中, 加入1%(E/S)胰蛋白酶(活性1:250), 37 ℃水浴数小时. 测A490值; (3)抗H pylori-IgY对酸的耐受性: 在不同pH值37 ℃下, 水浴抗H pylori-IgY 2 h, 中和酸, 测IgY的A490值.
统计学处理 P/N比值公式及判断: P/N值 = (待测孔A值-空白孔A值)÷(阴性对照孔A值-空白孔A值). P/N≥2.1为阳性, 1.5<P/N≤2.1为可疑, 1.5<P/N为阴性.
各空白孔A490值均为0. Anti-H pylori-IgY A490值的最小值为0.1 048, P/N=1 048÷0.0 413≈2.54>2.1, 为阳性; 因此, 实验所得的Anti-H pylori-IgY A490值均为阳性. t检验分析Anti-H pylori-IgY A490值, P<0.05, 免疫组和对照组差异有显著性, 有统计学意义.
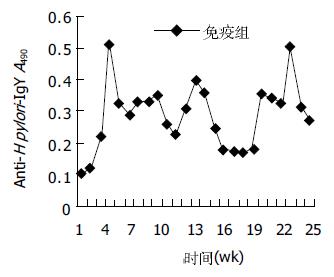
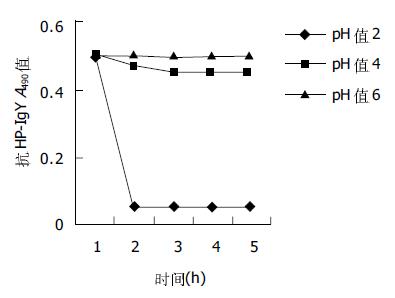
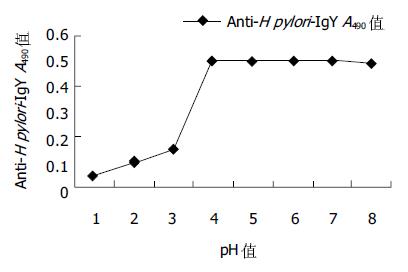
一抗稀释度1:100, 二抗稀释度1:400时, P/N = 12.4 914, 最大; 其次, 一抗稀释度1:200, 二抗抗稀释度1:400时, P/N = 12.1767; 再次, 一抗稀释度1:100, 二抗抗稀释度1:200时, P/N = 12.148. 这三者的P/N值都大于2.1且显著高于其他组. 当二抗稀释度固定、一抗稀释度变化时, 二抗稀释度为1:200的各组P/N值相差最大. 当抗原每孔包被1 μg, 一抗以1:100稀释, 二抗以1:200稀释时, 高免鸡蛋黄IgY的A490值(P A490值)为0.5017, 阴性对照鸡蛋黄IgY的A490值(P A490值)为0.0413, 二者差异显著, P/N = 12.148, 具有很高的灵敏度, 有利于抗体活性的测定. 因此, 一抗的最适工作浓度选择1:100稀释, 二抗选1:200稀释. 幽门螺杆菌超声破碎物抗原初免疫母鸡后第9 d, 蛋中抗H pylori-IgY开始测出, 并持续增高; 3-4 wk达高峰; 之后效价维持在较高水平; 在12-14 wk和20-24 wk左右又分别出现一次高峰, 抗体活性持续25 wk以上(图1). pH 2-6范围内, 随PH值增大, 胃蛋白酶对抗H pylori-IgY活性的影响逐渐减小. pH = 6时, 胃蛋白酶对抗H pylori-IgY的活性几乎无影响; pH = 2时, 胃蛋白酶对抗H pylori-IgY的活性影响最大(图2). 抗H pylori-IgY对胰蛋白酶极其敏感. 在胰蛋白酶作用的最初1 h内, 抗H pylori-IgY的抗原结合活性就几乎完全丧失. pH值在4-7之间时, 抗H pylori-IgY的活性几乎不受pH值影响. pH值在7-8之间时, 抗H pylori-IgY活性略微下降, 降低值不超过10%; pH<4时, 抗H pylori-IgY活性开始急剧下降, pH = 4时, 抗H pylori-IgY活性下降约70%; pH = 3时, 抗H pylori-IgY活性下降约80%; pH = 2时, 抗H pylori-IgY接近失活(图3).
目前检测鸡卵黄IgY的常用方法有免疫双向扩散法和血凝抑制法等, 其灵敏度都不够高, 且不易进行标准化测量. 本试验用幽门螺杆菌超声破碎物抗原包被板、鼠抗鸡IgY作二抗, 以间接ELISA法测定鸡卵黄中抗H pylori-IgY的效价, 并以此监测其变化规律. 鸡卵黄中, 抗H pylori-IgY抗体量高; 间接ELISA法检测发现, 抗H pylori-IgY能长时间地维持在较高水平, 这十分有利于工业化生产, 为研究和利用IgY提供了高灵敏度和简便易行的标准化方法, 为进一步的动物和临床研究奠定了基础.
抗H pylori-IgY的酸稳定性实验提示: 降低胃酸的药物(如H2-受体阻止剂和质子泵抑制剂)有利于维持抗H pylori-IgY的活性; 二者合用, 将提高H pylori的根除率. 抗H pylori-IgY的酶稳定性实验提示: (1)与抑制胃酸分泌药物合用, 可保护抗H pylori-IgY免受胃蛋白酶水解破坏; (2)抗H pylori-IgY不耐受胰蛋白酶. 在有胆汁反流的患者, 胰蛋白酶可随之反流入胃; 这类患者应注意加用黏附胆汁的药物, 以保护抗H pylori-IgY的活性.
近年来, 将IgY用于预防与治疗人和动物的某些疾病的报道较多见[11-13], 证实了IgY的被动免疫保护作用, 并提示特异性鸡卵黄抗体IgY对病原体感染的防御没有动物种属的差异, 这就为IgY防治人类疾病的应用奠定了基础. IgY可作为一种食品级抗体, 应用于婴幼儿肠道感染; 可作为一种食品添加剂, 应用于某些胃肠炎的口服被动性免疫预防. 口服卵黄或IgY可获得被动免疫保护, 可应用IgY预防婴幼儿和家畜(禽)的各种微生物感染肠道疾病. 对于患有免疫缺陷性疾病的人口服IgY预防肠道感染更有其独特的功能. 因此, IgY可作为食品公司的免疫型强化剂. 有人提出给小于5月龄的婴儿及先天性免疫缺陷症患儿口服含有高滴度抗病毒活性的IgY用于疾病的防治, 对那些不能以母乳喂养的儿童尤为有意义[14].
编辑: N/A
| 1. | Carroll SB, Stollar BD. Antibodies to calf thymus RNA polymerase II from egg yolks of immunized hens. J Biol Chem. 1983;258:24-26. [PubMed] |
| 2. | Song CS, Yu JH, Bai DH, Hester PY, Kim KH. Antibodies to the alpha-subunit of insulin receptor from eggs of immunized hens. J Immunol. 1985;135:3354-3359. [PubMed] |
| 3. | Rose ME, Orlans E, Buttress N. Immunoglobulin classes in the hen's egg: their segregation in yolk and white. Eur J Immunol. 1974;4:521-523. [PubMed] [DOI] |
| 4. | Jensenius JC, Andersen I, Hau J, Crone M, Koch C. Eggs:conveniently packaged antibodies. Met-hods for purification of yolk IgG. J Immunol Methods. 1981;46:63-67. [DOI] |
| 5. | Toivanen PA. Immunology: basis and practice. Boca Raton FL USA: CRC press 1987; 113-121. |
| 6. | BENSON HN, BRUMFIELD HP, POMEROY BS. Requirement of avian C'1 for fixation of guinea pig complement by avian antibody-antigen complexes. J Immunol. 1961;87:616-622. [PubMed] |
| 7. | Kronvall G, Seal US, Finstad J, Williams RC Jr. Phylogenetic insight into evolution of mammalian Fc fragment of gamma G globulin using staphylococcal protein A. J Immunol. 1970;104:140-147. [PubMed] |
| 8. | Kronvall G, Seal US, Svensson S, Williams RC Jr. Phylogenetic aspects of staphylococcal protein A-reactive serum globulins in birds and mammals. Acta Pathol Microbiol Scand B Microbiol Immunol. 1974;82:12-18. [PubMed] |
| 10. | Akita EM, Nakai S. Comparison of four purification methods for the production of immunoglobulins from eggs laid by hens immunized with an enterotoxigenic E. coli strain. J Immunol Methods. 1993;160:207-214. [PubMed] [DOI] |
| 11. | Ebina T, Tsckada K, Umezu K, Xose M, Tsuda K, Hatta H, Kim M, Yamamoto T. Gastroenteritis in sucking mice caused by human rotavirus can be prevented with egg yolk immunoglobulin(IgY) and treated with a protein bond polysaccharide Preparation(PSK). Microbiol Immunol. 1990;34:617-629. [DOI] |
| 12. | Hiraga C, Kodama Y, Sugiyama T, Ichikawa Y. Prevention of human rotavirus infection with chicken egg yolk immunoglobulins containing rotavirus antibody in cat. Kansenshogaku Zasshi. 1990;64:118-123. [PubMed] [DOI] |
| 13. | Yokoyama H, Peralta RC, Diaz R, Sendo S, Ikemori Y, Kodama Y. Passive protective effect of chicken egg yolk immunoglobulins against experimental enterotoxigenic Escherichia coli infection in neonatal piglets. Infect Immun. 1992;60:998-1007. [PubMed] |
| 14. | Schimizu M, Fitisimmons RC, Nakai S. Anti-E. coli immunoglobulin Y isolated from egg yolk of immunized chickens as a potential food ingredient. J Food Sci. 1988;53:1360. [DOI] |