修回日期: 2004-09-13
接受日期: 2004-09-25
在线出版日期: 2004-12-15
目的: 探讨在五羟色胺(5-HT)介导的胰腺外分泌中, 大鼠孤束核所起的作用, 并进一步阐明与这些作用相关的神经物质.
方法: 在十二指肠内恒流灌注0.86 mol/L NaCl、10-4 mol/L 5-HT, 然后对各处理组中不同的孤束核切面(孤束核嘴侧平面、中间平面、尾侧平面)进行c-Fos免疫组化、c-Fos-NK1-R双重免疫组化染色方法(免疫荧光-免疫酶学), 同时计数其中c-Fos阳性细胞数, 并行定量分析; 另外每15 min收集胆胰混合液一次, 测定胰液蛋白含量.
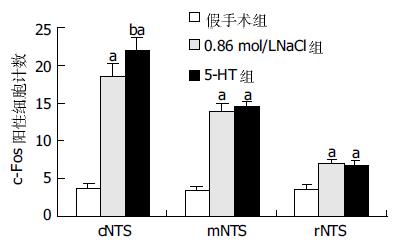
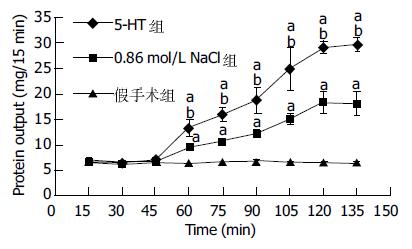
结果: 在孤束核各平面, 5-HT组、0.86 mol/L NaCl组内c-Fos阳性神经元数量均高于假手术组(P<0.01), 且在孤束核尾侧平面5-HT组(22.00±1.80)明显高于0.86 mol/L NaCl组(18.5±1.7, P<0.01), 另外两组在孤束核内的c-Fos阳性表达密集区域内均有NK1-R表达, 而假手术组则未见c-Fos与NK1-R很好的重叠. 胰蛋白测定方面: 与假手术组胰液蛋白相比, 5-HT组以及0.86 mol/L NaCl组在实验进行60 min(灌注后15 min)至135 min均有明显升高, 有统计学意义(P<0.01); 且5-HT组(29.6±1.4 mg/15 min)与0.86 mol/L NaCl组(18.1±2.4 mg/15 min)相比较, 胰蛋白含量增加更为明显(P<0.01).
结论: 在5-HT介导的胰液蛋白分泌中, 大鼠孤束核起着感知及整理信息的作用, 且这种作用的发挥与P物质受体有关.
引文著录: 夏青, 李兆申, 屠振兴, 龚燕芳, 满晓华. 大鼠孤束核在五羟色胺介导的胰腺外分泌中的作用. 世界华人消化杂志 2004; 12(12): 2805-2808
Revised: September 13, 2004
Accepted: September 25, 2004
Published online: December 15, 2004
AIM: To investigate the role of nucleus tractus solitarii (NTS) in pancreatic secretion induced by 5-hydroxytryptamine (5-HT) in rats and to further elucidate the related neural substance.
METHODS: Twenty-four rats were randomly divided into NaCl group, 5-HT group and sham operation group. Rats in NaCl and 5-HT groups were given NaCl (0.86 mol/L) and 5-HT (10-4 mol/L) via duodenum respectively and the mixture of bile and pancreatic juice was collected every 15 min. Protein content of the mixture was measured with BCA protein assay. EnVision Immunohistochemical method and double-label immunohistochemistry (immunoenzyme-fluorenscence) were used to detect the quantity of c-Fos and NK1-R positive cells in intermediate-medial NTS (mNTS), rostral (rNTS) and caudal regions (cNTS).
RESULTS: The number of c-Fos positive cells was significantly increased in NaCl and 5-HT group as compared to that in sham operation group in rNTS, mNTS and cNTS (P < 0.01), and in cNTS, the number was significantly larger in 5-HT group than that in NaCl group 22.00±1.80 vs 18.50 ± 1.71, P < 0.01). Moreover, NK1-R was expressed in the regions where c-Fos expression was enhanced by duodenal stimulation of NaCl and 5-HT, but this did not happen in sham operation group. After infusion of NaCl and 5-HT, pancreatic protein secretion was increased (P < 0.01). And the content of pancreatic protein was significantly higher than that in 5-HT and NaCl groups (29.6 ± 1.4 mg/15 min vs 18.1 ± 2.4 mg/15 min, P < 0.01).
CONCLUSION: NTS plays a role of sensing and processing information on pancreatic protein secretion induced by 5-hydroxytryptamine, in which the receptor of P substance may take a part.
- Citation: Xia Q, Li ZS, Tu ZX, Gong YF, Man XH. Role of nucleus tractus solitarii in pancreatic secretion induced by 5-hydroxytryptamine in rats. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2805-2808
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2805.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2805
随着对胰腺外分泌的深入研究, 胰腺外分泌的神经调节机制备受关注, 尤其在迷走神经方面的研究. 目前CCK因素、5-HT因素(如麦芽糖、高渗盐)都已报道可以经迷走神经, 最终引起胰液蛋白的变化, 且二者作用并无依赖性[1]. 另外在CCK因素方面, Glatzieet al[2]用免疫组化的方法证实: 正餐后, CCK的分泌可以引起孤束核(迷走神经在中枢的投射核团)内的c-Fos阳性神经元表达增加, 说明胆囊收缩素(cholecystokininoctapeptide, CCK)引起的胰腺外分泌增加可能由孤束核(nucleus of solitary tract, NTS)参与调节. 但NTS是否也参与了5-HT介导的胰腺外分泌改变, 以及他在其中所起作用至今尚无报道. 因此我们应用c-Fos蛋白(神经元激活的标志物)表达为指标, 观察十二指肠内给予高渗盐(即内源性5-HT)及外源性 5-HT刺激后, 延髓NTS中神经元激活状况, 及其与P物质受体的关系, 同时观察胰液蛋白变化, 以丰富胰腺外分泌在神经调节方面的研究.
兔抗大鼠c-Fos抗体为Santa-Cruz公司产品, 豚鼠抗大鼠NK1-R抗体为; Evension二抗购自Dako公司; 辣根过氧化物酶购自华美生物工程公司. Alexa Fluor 546标记的二抗为Moecular probes 公司. Zymed公司的SP通用型试剂和盒. Pierce公司的BCA蛋白质检测试剂盒.
健康♂SD大鼠24只, 体重200-250 g, 清洁级, 第二军医大学动物实验中心提供. 适应性饲养1 wk后开始实验. 实验前1 d禁食, 自由饮水. 实验前2 h禁水. 然后随机分为3组: 0.86 mol/LNaCl组、10-4 mol/L 5-HT组、假手术组, 每组8只. 用20 g/L氯胺酮(80 mg/kg)ip麻醉后, 于十二指肠上端(幽门口下5 cm)插入动静脉留置针. 在十二指肠下端(距上端20 cm)再插入一多聚乙烯管, 同时结扎幽门口, 以防反流, 自十二指肠乳头处循胰管插入静脉留置针, 收集胆胰混合液. 应用电热毯尽量将腹腔保持在37 ℃. 灌前分别收集15、30、45 min的胆胰混合液, 然后在十二指肠分别恒流灌注0.86 mol/L NaCl、10-4 mol/L 5-HT组, 流速3 mL/h, 收集60、75、90、105、120、135 min的胆胰混合液. 假手术组开腹插管, 并留置135 min, 同时在上述时间段收集胆胰混合液. 然后, 开胸经升主动脉插管, 先后用生理盐水100-150 mL、40 g/L多聚甲醛的磷酸盐缓冲液400 mL冲洗, 固定脑组织. 取脑于含200 g/L蔗糖的PB内(4 ℃), 直至组织块沉底. 切取自闩(obex)平面向吻尾侧各2 000 μm的延髓, 行冰冻冠状切片, 片厚10 μm. 分为3套: 第1套行c-Fos免疫组化, 第2套行c-Fos-NK1-R双重免疫组化, 第3套行尼氏(Nissl)染色, 检查、核准脑干内相关结构的范围和界限. 免疫组织化学(Evension)法反应: 切片经3 mL/L H2O2、含3 g/L TritonX-100的PBS、10 g/L BSA分别处理30 min后加入兔抗c-Fos抗体(1:400)置4 ℃下孵育24 h, Evension二抗孵育1 h, DAB/H2O2溶液镜控显色, 衬染、蓝化、脱水、透明、封片. PBS代替一抗、二抗作为阴性对照. 显微镜(Olympus Bx-50)下明视野观察、计数、摄影. 双重免疫组化反应(免疫酶学-免疫荧光): 切片经3 mL/L H2O2、含3 g/L TritonX-100的PBS、10 g/L BSA分别处理30 min后加入豚鼠抗NK1-R抗体(1:800)置4 ℃下孵育48 h, 通用性生物素化二抗孵育30 min, 滴加链霉卵白素-碱磷酶轭合物30 min, DAB/H2O2溶液镜控显色. 含3 g/L TritonX-100的PBS、10 g/L BSA分别处理30 min后, 然后滴加兔抗c-Fos抗体(1:200), 4 ℃孵育48 h, 荧光二抗(1:200)避光保存6 h, 甘油封片, 荧光显微镜下观察拍照, PBS洗去甘油, 衬染、蓝化、脱水、透明、中性树酯封片. PBS代替一抗、二抗作为阴性对照.光学显微镜(Olympus Bx-50)下明视野观察、计数、摄影. 将NTS依据形态和所在平面位置, 自尾侧向吻侧分为3个平面[3]: (1)NTS尾侧平面(cNTS), Obex+500; (2)NTS中间平面(mNTS), Obex-500包绕最后区; (3)NTS嘴侧平面(rNTS), Obex-1000, 以内侧边界被Ⅳ脑室分离为标志的NTS中间核区域. 定位参照包新民等编著的《大鼠脑立体定位图谱》. 细胞核内出现棕黄色颗粒即为阳性, 部分胞质内也可有棕黄色颗粒. 取每只动物各区对应的典型平面, 于孤束核内取随机视野数出100个细胞, 计数其中阳性细胞数, 作为该区FOS阳性细胞数. 免疫酶学-免疫荧光可见c-Fos阳性细胞即荧光显微镜下出现点状的红色荧光, NK1-R阳性细胞即光镜下细胞树突出现棕黄色颗粒.
统计学处理 所有数据以mean±SD表示. 通过SPSS10.0统计软件, 采用非参数统计方法对各组均数进行显著性检.
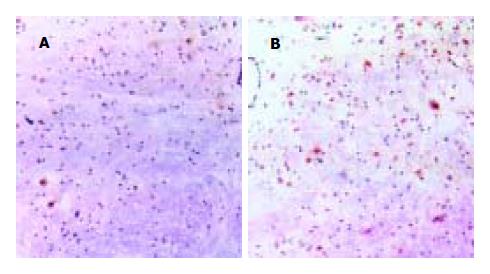
不同处理组大鼠各平面NTS均可见神经细胞的细胞核及部分胞质中含有棕黄色颗粒即c-Fos阳性神经元, 尤其在0.86 mol/L NaCl及5-HT组, 如图1A、1B所示. 但各处理组在不同平面的c-Fos阳性神经元数量有差异: 与假手术组相比, 0.86 mol/L NaCl组、10-4 mol/L 5-HT组c-Fos阳性神经元数量明显增加(P<0.01), 具体数值(图2). 假手术组: c-NTS区与r-NTS、m-NTS区比较, 均无统计学意义. 0.86 mol/L NaCl组: c-NTS区阳性神经元数量最多, 分别多于m-NTS以及r-NTS区, P<0.01, 而m-NTS多于r-NTS区; 5-HT组: c-NTS区阳性神经元数量最多, 分别多于m-NTS以及r-NTS区, P<0.01, 而m-NTS多于r-NTS区.
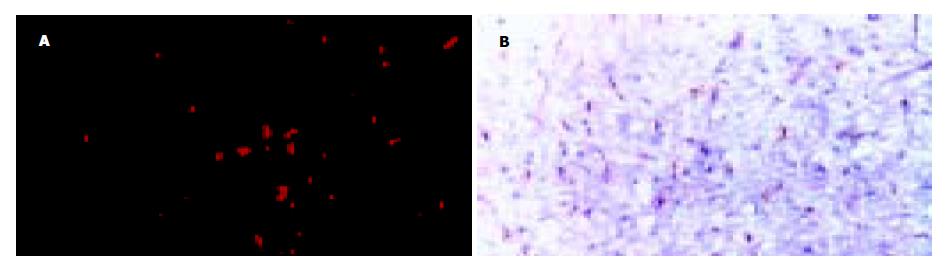
荧光显微镜下可见5-HT组、0.86 mol/L NaCl组NTS内有多量点状的红色荧光即c-Fos阳性, 而假手术组则仅见少量点状的红色荧光, 见图3A、4A. 光镜下观察: 5-HT组、0.86 mol/L NaCl组可见各组在NTS内c-Fos阳性的区域均有NK1-R表达在细胞的树突膜, 呈棕黄色颗粒状(图3B、4B). 假手术组未见c-Fos与NK1-R很好的重叠. PBS组在荧光显微镜和光镜下均未见阳性表达.
假手术组胰液蛋白含量的曲线呈水平线型, 无明显的增高减低, 各时间段的比较均提示无明显统计学意义(P>0.05). 而5-HT组、0.86 mol/L NaCl组在肠道灌注后15 min后即有明显升高, 灌注后各时间段与假手术组比较, 有统计学意义(P<0.05). 另外5-HT组与0.86 mol/L NaCl组比较, 灌注后升高更明显, 有统计学意义(P<0.05). 具体数值(图5).
c-fos属即刻早期基因的一种, 他对神经递质、激素、神经冲动等外界刺激的传入信息在数分钟内就可作出反应, 并进行表达. 由于c-fos的这一特性, c-fosmRNA及其表达产物c-Fos蛋白现常用作神经元功能活动标记物. 与假手术组相比, 十二指肠内给予0.86 mol/L组、10-4 mol/L 5-HT组诱导了NTS内各部位的c-Fos阳性神经元数量明显增加, 说明NTS内的部分神经元参与了5-HT介导的胰腺外分泌变化. 在0.86 mol/L NaCl组、10-4 mol/L 5-HT组中孤束核cNTS区域神经元表达增加最明显, 且5-HT组高于0.86 mol/L NaCl组. 说明与0.86 mol/L NaCl组相比, 十二指肠灌注10-4 mol/L 5-HT后上传的信息能更强激活NTS内的神经元.
P物质(substance P, SP)是一种含有11个氨基酸的多肽, 属速激肽家族, 广泛分布于神经系统各部, 是神经系统中重要的生物活性物质之一. 速激肽家族目前已发现3种受体: NK1-R, NK2-R和NK3-R, 均属于G蛋白相偶联的7次跨膜受体家族. 其中以NK1-R与SP的亲和力最强.研究已证实SP及其受体NK1-R均存在于大鼠的NTS内[4-5]. 在c-Fos阳性神经元密集的区域也可见NK1-R, 且这些SP受体在NTS内主要集中在树突膜上. 可能提示十二指肠内5-HT以及0.86 mol/L NaCl刺激, 经迷走神经传导至NTS, 然后激活了部分P物质受体阳性神经元, 使其参与了NTS内的内脏感知信息整理. Baude et al[6]的实验结果发现: (1)在大鼠和家猫的迷走神经背核复合体(DVC)上, NK1-R不分布在任何轴突膜、轴突末梢以及胶质细胞; (2)应用半定量实验, 提示NK1-R在某些树突膜上密度更高, 而这些树突的特点是和其他神经元轴突末梢没有突触或非突触的联系. 因而他们认为SP作用与NK1-R受体可能是通过对传入信息的整理来调节各种相关活动的. 其第一点否认了NK1-R阳性的神经元作为轴突与其他神经元联系的可能; 而第二点则否认了NK1-R阳性的神经元做为树突与其他神经元形成轴突-树突模式的这种联系方式. 因此从某种意义上也提示SP在CNS对胰腺的外分泌调节可能是通过对传入信息的整理来完成的, 而不是通过经典的神经传导方式.
就胰蛋白分泌来讲, 三个实验组在基础状态时胰液蛋白含量并没有差异, 而两个处理组在分别灌注0.86 mol/L NaCl、5-HT后, 均有明显的统计学意义(P<0.05), 且随灌注的时间增加, 胰蛋白含量也不断增加, 直到120 min左右增加渐慢, 这些结果与Li的实验结果趋势基本相仿. Li et al[7]认为十二指肠高渗盐、5-HT刺激均可引起的胰腺外分泌增加, 且并不依赖于CCK. 他们同时认为5-HT是作为一种旁分泌物质, 与胆碱能神经通路上突触后的5-HT3受体结合, 最终增加胰腺外分泌的. 另外Zhu et al[8]应用电生理方法也证实在54只大鼠的十二指肠内分别灌注高渗盐、自来水、高渗糖等, 然后记录了这些大鼠的364个神经元(均来自于迷走神经节)的放电, 有40个神经元被激活. 接着将10-4 mol/L 5-HT, 10-5 mol/L 5-HT灌注于上述筛选出来的大鼠十二指肠内, 上述40个神经元所发放的冲动分别为(38±5), (21±4)冲动/20 s, 而基础水平为(0±1)冲动/20 s. 后用10 g/L利多卡因对上述十二指肠黏膜行局部浸润, 可完全去除5-HT对神经元的反应. 表明迷走神经节内的感觉神经元和迷走神经传入纤维都参与了管腔因子对胰腺外分泌的促进过程. 另外5-HT组在灌注以后胰液蛋白含量明显高于0.86 mol/L NaCl组, 提示0.86 mol/L NaCl组所引起的内源性5-HT释放可能小于10-4 mol/L. 这一点与Li et al[1]的研究也比较符合, 他们认为十二指肠内灌注0.6 mol/L(4%)的NaCl可以使肠道内5-HT的水平增至5.2±0.2 μg/20 min, 而10-5 mol/L 5-HT按照3 mL/h的速度灌注, 可使肠道浓度稳定在5.7±1.7 g/20 min. 因此4%NaCl基本相当于10-5 mol/L5-HT水平.在各时间段进行比较中发现5-HT组105 min后各时间段、0.86 mol/L NaCl组120 min后各时间段比较均无统计学意义, 提示超过一定时间段后, 胰液蛋白含量可能处于平台期或者缓慢增长期.
从方法学而言, 本研究采用双重免疫组化方法, 即利用同一张片子探测2种蛋白的表达, 其目的是为得到更好的同一性.目前在中枢核团的研究中常常应用c-Fos与受体搭配的双重免疫组化方法, 这样不但能明确核团神经元的活动性, 也能搞清楚这些已激活神经元的性质, 如在大鼠呼吸调节的中枢核团研究中, Whitney et al同时应用谷氨酸受体与c-Fos结合, 了解舌下神经核对于呼吸活动的调节. 就大鼠胰液收集方面. 虽然国内在胰腺疾病方面已作了较多研究, 但在国内尚未见动物胰液收集的详尽报道. 另外本课题所收集的虽为胆胰混合液, 但根据文献报道, 非CCK刺激引起的蛋白分泌属胰源性, 并不引起胆汁中蛋白含量的增加[8]. 因此所测蛋白可以很好的反映胰液蛋白含量的变化. 同时由于未结扎胆管, 使大鼠更趋于生理状态, 结果更可靠.
总之, 5-HT, 0.86 mol/L NaCl灌注十二指肠后可以引起胰液中蛋白含量的即刻增加, NTS在这一过程中可能起着感知及整理信息的作用, P物质受体可能参与了这种整理过程. 但目前P物质受体在此过程中的具体调节机制以及发挥的作用尚未完全清楚, 有待一步研究.同时本研究仅是从形态学单方面进行了阐述, 并不全面, 尚缺乏神经电生理方面的证据, 有待进一步研究.
编辑: N/A
| 1. | Li Y, Wu XY, Zhu JX, Owyang C. Intestinal serotonin acts as paracrine substance to mediate pancreatic secretion stimulated by luminal factors. Am J Physiol Gastrointest Liver Physiol. 2001;281:G916-G923. [PubMed] |
| 2. | Glatzle J, Kreis ME, Kawano K, Raybould HE, Zittel TT. Postprandial neuronal activation in the nucleus of the solitary tract is partly mediated by CCK-A receptors. Am J Physiol Regul Integr Comp Physiol. 2001;281:R222-R229. [PubMed] |
| 3. | Kasparov S, Davies KA, Patel UA, Boscan P, Garret M, Paton JF. GABA(A) receptor epsilon-subunit may confer benzodiazepine insensitivity to the caudal aspect of the nucleus tractus solitarii of the rat. J Physiol. 2001;536:785-796. [PubMed] [DOI] |
| 4. | Nishi T, Hara H, Aoyama Y. Guanidinated casein hydrolysate stimulation of cholecystokinin release via pancreatic enzyme- and cholinergic-independent mechanisms in rats. Biosci Biotechnol Biochem. 1999;63:1070-1074. [PubMed] [DOI] |
| 5. | Yakabi K, Iwabuchi H, Nakamura T, Endo K, Fukunaga Y, Kumaki I, Takayama K. Neuronal expression of Fos protein in the brain after intravenous injection of gastrin in rats. Neurosci Lett. 2002;317:57-60. [DOI] |
| 6. | Baude A, Shigemoto R. Cellular and subcellular distribution of substance P receptor immunoreactivity in the dorsal vagal complex of the rat and cat: a light and electron microscope study. J Comp Neurol. 1998;402:181-196. [PubMed] [DOI] |
| 7. | Li Y, Hao Y, Zhu J, Owyang C. Serotonin released from intestinal enterochromaffin cells mediates luminal non-cholecystokinin- stimulated pancreatic secretion in rats. Gastroenterology. 2000;118:1197-1207. [DOI] |