修回日期: 2004-09-13
接受日期: 2004-09-25
在线出版日期: 2004-11-15
目的: 探讨温郁金对人胃癌细胞SGC-7901的抑制作用及其作用机制.
方法: 采用超临界二氧化碳萃取法提取温郁金挥发油成分. 以氟尿嘧淀(5-Fu)为阳性对照药物, 采用MTT法, 测定温郁金提取物对体外培养胃癌细胞SGC-7901增生的影响; 应用放射免疫测定法分析温郁金提取物对细胞培养液中IGF-Ⅰ、IGF-Ⅱ浓度水平的影响.
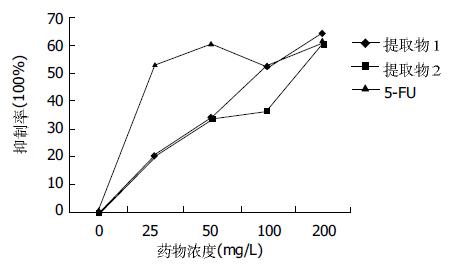
结果: 超临界二氧化碳萃取法提取温郁金获得温郁金提取物1和提取物2. 温郁金提取物1、提取物2对胃癌细胞的生长有显著的抑制作用(均P<0.01), 且抑制率随药物浓度的升高而增高, 存在明显的量效关系. 200 mg/L浓度的温郁金提取物1和提取物2对胃癌细胞生长的抑制率分别为64.44%、60.80%, 在这个浓度水平, 其抑制肿瘤细胞生长作用与阳性对照药物5-Fu效果相当. 温郁金提取物1、提取物2能降低胃癌细胞培养液中IGF-Ⅰ、IGF-Ⅱ的浓度水平(均P<0.05).
结论: 温郁金提取物对人胃癌细胞SGC-7901生长有抑制作用, 其抑癌作用的机制可能与抑制胃癌细胞分泌IGF-Ⅰ、IGF-Ⅱ有关.
引文著录: 何必立, 吕宾, 徐毅, 苗青, 范一宏. 温郁金对胃癌细胞的抑制作用及其对IGF-Ⅰ、IGF-Ⅱ表达的影响. 世界华人消化杂志 2004; 12(11): 2761-2763
Revised: September 13, 2004
Accepted: September 25, 2004
Published online: November 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2761-2763
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2761.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2761
胰岛素样生长因子(insulin-like growth factor, IGF)同肿瘤的关系近年来受到了广泛的关注[1]. 温郁金具有行气破血、消积止痛等作用, 是抗肿瘤复方中常见的药物, 前期在其抗肿瘤作用方面已有报道[2], 但有关其对胰岛素样生长因子的影响研究鲜见. 我们研究温郁金提取物对体外培养的胃癌细胞株SGC-7901的抑制作用, 并从其对胰岛素样生长因子Ⅰ(IGF-Ⅰ)、胰岛素样生长因子Ⅱ(IGF-Ⅱ)分泌的影响来分析其作用的机制.
胃腺癌细胞(SGC-7901)株(购自中科院上海细胞所), RPMI-1640培养基为Gibco公司产品, 胎牛血清购自杭州四季青生物工程公司, 噻唑蓝(MTT)、胰蛋白酶为上海生物工程公司产品, 氟尿嘧啶(5-Fu)为上海旭东海普药业有限公司产品, IGF-Ⅰ放免试剂盒购自天津九鼎医学生物工程有限公司, IGF-Ⅱ放免试剂盒购自解放军总医院科技开发中心放免所, 二甲基亚砜为浙江杭州双林化工试剂厂产品, 温郁金购自浙江省中医院中药房, HA121-50-01型超临界萃取装置为江苏南通华安超临界实业公司产品, CO2细胞培养箱为美国Thermo Forma公司产品, ELX800酶标仪为美国Bio-Tek公司生产, SN-682放射免疫γ计数器由中科院上海原子核研究所日环仪器厂生产.
1.2.1 细胞培养: SGC-7901细胞常规培养于含100 mL/L灭活胎牛血清的RPMI-1640培养液中, 置37 ℃、50 mL/L的CO2及饱和湿度的培养箱内培养.
1.2.2 温郁金提取物的制备: 采用超临界CO2流体萃取技术提取温郁金有效成分. 萃取温度40 ℃, 压力3×107 Pa, 时间为120 min/循环, CO2流量为50 kg/h, 分离1的反应条件为: 压力1.25×107 Pa, 温度50 ℃; 分离2的反应条件为压力5.5×106 Pa, 温度40 ℃. 获温郁金提取物1、温郁金提取物2后4 ℃避光冷藏保存. 药物在使用前新鲜配制, 先用适量DMSO溶解, 再以RPMI-1640培养液进行稀释, 使其浓度达到用药需求.
1.2.3 细胞增生抑制试验(MTT还原法): 对数生长期细胞用含100 mL/L胎牛血清的1640培养液调整细胞悬液浓度为1.0×107 /L接种细胞于96孔培养板, 每孔200 μL, 置37 ℃、50 mL/L CO2及饱和湿度的培养箱内培养; 24 h后, 更换不含胎牛血清的1 640培养液再培养24 h, 使细胞同步化; 换上含浓度依次为25、50、100、200 mg/L温郁金提取物1、提取物2的完全培养液, 阴性对照组为不含温郁金的培养液, 空白对照组不含细胞, 阳性对照组加入含浓度依次为25、50、100、200 mg/L的5-Fu的完全培养液, 每个药物浓度设6个复孔; 分别继续培养48 h; 每孔加入5 g/L MTT溶液20 μL, 37 ℃孵育4 h, 再加入150 μL DMSO, 上微量振荡器振荡10 min, 立即用酶标仪测定490 nm波长吸光度值(A).
抑制率(%)=[(阴性对照A-空白A)-(实验A-空白A)]/(阴性对照A-空白A)×100%.
1.2.4 条件培养液中IGF-Ⅰ、IGF-Ⅱ含量的测定: 对数生长期细胞用含100 mL/L胎牛血清的1640培养液调整细胞悬液浓度为5.0×107 /L, 接种细胞于24孔培养板中, 每孔1 000 μL, 37 ℃、50 mL/L CO2及饱和湿度的培养箱内培养; 24 h后, 更换不含胎牛血清的1640培养液再培养24 h, 使细胞同步化; 换上含浓度依次为25、50、100 mg/L温郁金提取物1、提取物2的完全培养基, 阴性对照组细胞更换为1 000 μL完全培养基, 分别继续培养48 h, 收集各处理组培养液. 按照IGF-Ⅰ、IGF-Ⅱ放免试剂盒的说明步骤测定培养液中IGF-Ⅰ和IGF-Ⅱ浓度, 由自动γ计数器预先编制的程序(以B-NSB/B0-NSB计算标准及待测样品结合百分率, 半对数绘制标准曲线)直接给出有关参数、标准曲线和样品浓度.
统计学处理 结果以均数±标准差(mean±SD)表示, 组间比较采用方差分析, 量效关系采用相关与回归分析, 以P<0.05为差异有显著性.
温郁金提取物1、提取物2随剂量的增加, 其对胃癌细胞的抑制率也增加(图1, 表1), 有显著相关性(P均<0.01). 200 mg/L的温郁金提取物1、提取物2和对照药物5-Fu对胃癌细胞株生长的抑制作用无显著差异(P>0.05), 其抑制作用相当.
| 处理组 | 药物浓度(mg/L) | n | A值 | 细胞抑制率(%) |
| 提取物1 | 200 | 6 | 0.2752±0.0242b | 64.44 |
| 提取物1 | 100 | 6 | 0.3547±0.0332b | 51.59 |
| 提取物1 | 50 | 6 | 0.4697±0.0270b | 33.00 |
| 提取物1 | 25 | 6 | 0.5492±0.0278b | 20.15 |
| 提取物2 | 200 | 6 | 0.2977±0.0075d | 60.80 |
| 提取物2 | 100 | 6 | 0.4493±0.0291d | 36.29 |
| 提取物2 | 50 | 6 | 0.4678±0.0111d | 33.30 |
| 提取物2 | 25 | 6 | 0.5582±0.0330d | 18.70 |
| 5-Fu对照组 | 200 | 6 | 0.2920±0.0146f | 61.72 |
| 5-Fu对照组 | 100 | 6 | 0.3492±0.0210f | 52.48 |
| 5-Fu对照组 | 50 | 6 | 0.2978±0.0270f | 60.78 |
| 5-Fu对照组 | 25 | 6 | 0.3448±0.0274f | 53.18 |
| 阴性对照组 | 0 | 6 | 0.6738±0.0559 | 0 |
超临界CO2萃取技术是近20年来在国际上取得迅速发展的化工分离技术, 在中药有效成分提取方面有诸多优势[3] . 我们运用超临界CO2萃取技术, 从温郁金中提取出其药用成分, 根据提取条件不同, 获得提取物1、提取物2, 所设定萃取条件大致相当于以乙醇和乙醚萃取所得, 提取物1主要含姜黄素, 而提取物2主要为挥发油成分. MTT结果显示, 和阴性对照组比较, 浓度范围为25-200 mg/L的温郁金提取物1、提取物2对SGC-7901均有显著的抑制作用(P均<0.05), 且有明显的量效关系.
以往温郁金中抗肿瘤成分研究较多的有两大类成分, 即姜黄素和挥发油. 研究者从直接细胞毒作用, 诱导细胞凋亡, 诱导肿瘤细胞分化等多个角度进行了其抗肿瘤作用机制的探讨[2,4], 但针对细胞生长因子的研究少见.
胰岛素样生长因子系统(IGFs)由胰岛素样生长因子Ⅰ(IGF-Ⅰ)、胰岛素样生长因子Ⅱ(IGF-Ⅱ)、他们相应的受体IGF-Ⅰ R、IGF-ⅡR及其6种胰岛素样生长因子相关蛋白(IGFBPs)组成. IGF-Ⅰ对各种细胞活动既有即刻作用又有远期影响, 而这些作用的发挥依赖于其和IGF-ⅠR的结合. IGF-Ⅰ通过刺激细胞糖原和蛋白合成以及增强细胞摄取氨基酸和葡萄糖的能力而直接促进细胞蛋白质和碳水化合物代谢[5]. IGF-Ⅰ也对细胞增生、分化、凋亡有间接的影响. 对很多细胞系而言, IGF-Ⅰ是强有力的有丝分裂促进剂, 他可通过增加DNA合成、上调细胞周期蛋白D1表达, 从而加速细胞从G1期向S期过渡[6-7]. 另外, IGF-Ⅰ又通过上调Bcl蛋白表达, 下调Bax蛋白表达而提高Bcl/Bax二聚体含量, 这一变化可封闭细胞凋亡程序的启动[8-9]. 同样, IGF-Ⅱ也具有促有丝分裂、抗细胞凋亡、促进细胞增生和分化作用.
鉴于IGFs在细胞增生、分化、凋亡、突变等过程中起着重要的作用, 最近数十年人们对IGFs在肿瘤细胞生长和发展中的作用进行了大量的研究, 结果表明: IGFs与多种肿瘤包括白血病细胞、肉瘤、前列腺癌、乳腺癌、肺癌、胃癌、食管癌、肠癌、肝癌、胰腺癌、肾癌等各种肿瘤的发生发展关系密切[10-11]. IGFs和胃癌的关系最初在体外细胞实验中被观察到, Thompson et al[12]在1990年报道在人胃癌细胞系LIM-1839中存在IGF-Ⅱ的自分泌. Chung and Antoniades[13]于1992年用原位杂交法在3个人胃癌标本中检测到IGF-Ⅰ mRNA的表达.
IGFs和IGF-ⅠR的结合激活酪氨酸激酶的活性, 从而促发一系列分子介导的信号转导级联反应. 目前已经清楚的信号转导途径有两个, 其一途径为激活Ras蛋白、Raf蛋白和有丝分裂活化的蛋白激酶. 另一途径为激活三磷酸腺苷激酶而发挥作用[5]. 除和IGFs结合而调节细胞有丝分裂和凋亡过程外, IGF-ⅠR还和细胞转化相关. 体外实验表明从细胞膜表明除去IGF-ⅠR基因后, 可抑制细胞的转化[14]. IGF-ⅡR可通过和IGF-Ⅱ结合而降低IGF-Ⅱ的生物学活性.
鉴于IGF在肿瘤发生发展中的作用意义, 有学者采用阻断IGF的方法对肿瘤进行治疗, 方法有两种: 第一, 阻断IGF的合成或分泌; 第二, 阻断IGF与受体的结合, 应用这些方法, 已取得了初步的效果[15].
为了探讨温郁金提取物是否抑制胃癌细胞分泌IGF, 我们采用放射免疫测定法检测不同浓度温郁金提取物1、提取物2对胃癌细胞培养液中IGF-Ⅰ、IGF-Ⅱ含量的影响. 结果提示, 25、50、100 mg/L温郁金两种提取物对胃癌细胞培养液中IGF-Ⅰ、IGF-Ⅱ含量均有显著的下调(P均<0.05), 提示温郁金可能通过影响胃癌细胞IGF的分泌起到抗肿瘤作用的.
温郁金对肿瘤细胞的调控机制复杂, 我们的研究仅提示温郁金提取物对体外培养的SGC-7901具有抑制其增生作用; 抑制胃癌细胞分泌IGF-Ⅰ和IGF-Ⅱ可能是其作用机制的一方面, 温郁金对胃癌细胞IGF-Ⅰ和IGF-Ⅱ基因表达及其受体的影响有待于进一步深入研究.
另外, 我们的研究中提取物化学成分不明确, 有待于进一步分离纯化, 但温郁金资源丰富, 在胃癌的化学防治中值得深入研究.
编辑: N/A
| 1. | Khandwala HM, McCutcheon IE, Flyvbjerg A, Friend KE. The effects of insulin-like growth factors on tumorigenesis and neoplastic growth. Endocr Rev. 2000;21:215-244. [PubMed] [DOI] |
| 5. | Jones JI, Clemmons DR. Insulin-like growth factors and their binding proteins: biological actions. Endocr Rev. 1995;16:3-34. [PubMed] |
| 6. | Furlanetto RW, Harwell SE, Frick KK. Insulin-like growth factor-I induces cyclin-D1 expression in MG63 human osteosarcoma cells in vitro. Mol Endocrinol. 1994;8:510-517. [PubMed] |
| 7. | Dufourny B, Alblas J, van Teeffelen HA, van Schaik FM, van der Burg B, Steenbergh PH, Sussenbach JS. Mitogenic signaling of insulin-like growth factor I in MCF-7 human breast cancer cells requires phosphatidylinositol 3-kinase and is independent of mitogen-activated protein kinase. J Biol Chem. 1997;272:31163-31171. [PubMed] [DOI] |
| 8. | Párrizas M, LeRoith D. Insulin-like growth factor-1 inhibition of apoptosis is associated with increased expression of the bcl-xL gene product. Endocrinology. 1997;138:1355-1358. [PubMed] [DOI] |
| 9. | Wang L, Ma W, Markovich R, Lee WL, Wang PH. Insulin-like growth factor I modulates induction of apoptotic signaling in H9C2 cardiac muscle cells. Endocrinology. 1998;139:1354-1360. [PubMed] [DOI] |
| 10. | LeRoith D, Baserga R, Helman L, Roberts CT Jr. Insulin-like growth factors and cancer. Ann Intern Med. 1995;122:54-59. [PubMed] [DOI] |
| 11. | Macaulay VM. Insulin-like growth factors and cancer. Br J Cancer. 1992;65:311-320. [PubMed] [DOI] |
| 12. | Thompson MA, Cox AJ, Whitehead RH, Jonas HA. Autocrine regulation of human tumor cell proliferation by insulin-like growth factor II: an in-vitro model. Endocrinology. 1990;126:3033-3042. [PubMed] [DOI] |
| 13. | Chung CK, Antoniades HN. Expression of c-sis/platelet-derived growth factor B, insulin-like growth factor I, and transforming growth factor alpha messenger RNAs and their respective receptor messenger RNAs in primary human gastric carcinomas: in vivo studies with in situ hybridization and immunocytochemistry. Cancer Res. 1992;52:3453-3459. [PubMed] |
| 14. | Oates AJ, Schumaker LM, Jenkins SB, Pearce AA, DaCosta SA, Arun B, Ellis MJ. The mannose 6-phosphate/insulin-like growth factor 2 receptor (M6P/IGF2R), a putative breast tumor suppressor gene. Breast Cancer Res Treat. 1998;47:269-281. [PubMed] [DOI] |
| 15. | Huynh HT, Tetenes E, Wallace L, Pollak M. In vivo inhibition of insulin-like growth factor I gene expression by tamoxifen. Cancer Res. 1993;53:1727-1730. [PubMed] |