修回日期: 2004-09-01
接受日期: 2004-09-04
在线出版日期: 2004-11-15
目的: 分离及克隆胰腺癌细胞基因组中K-ras基因片段, 构建含反义K-ras癌基因逆转录病毒载体并探讨其对胰腺癌细胞增生、凋亡的影响及可能的分子机制.
方法: 设计2对PCR引物, 分别在上下游引物中引进BamHI和EcoRI位点, 以胰腺癌细胞株BxPC-3、PC-3基因组DNA为模板扩增K-ras基因外显子1、4及侧翼序列, 将目的基因克隆入逆转录病毒载体pLXSN中, 构建重组质粒, 经PT-67细胞包装后获得重组逆转录病毒. 将该重组逆转录病毒转染上述细胞, 经G418筛选获得稳定细胞, 应用MTT、流式细胞仪和免疫组化法分别研究其增生、凋亡和对胰腺癌p21蛋白表达; 建立胰腺癌裸鼠移植瘤模型, 观察反义K-ras基因体内治疗效果.
结果: 成功构建含反义K-ras基因的重组逆转录病毒载体. 反义K-ras基因抑制胰腺癌细胞增生, 诱导细胞凋亡、下调K-rasmRNA和P21蛋白表达, 并抑制裸鼠胰腺癌移植瘤的生长.
结论: 反义K-ras基因可使胰腺癌细胞增生受到抑制, 并可诱导细胞凋亡和下调K-rasmRNA和P21蛋白表达.
引文著录: 蒋奎荣, 刘训良, 苗毅, 卢春, 戴存才, 徐泽宽, 钱祝银. 逆转录病毒载体介导反义K-ras基因治疗胰腺癌的实验研究. 世界华人消化杂志 2004; 12(11): 2627-2632
Revised: September 1, 2004
Accepted: September 4, 2004
Published online: November 15, 2004
AIM: To isolate and clone antisense K-ras gene fragments and to clarify its effect on proliferation and apoptosis of pancreatic cancer cells and expression of K-ras mRNA and p21 protein.
METHODS: Polymerase chain reaction (PCR) was used to amplify K-ras gene exon 1 and 4 as well as the flanking sequences, taking pancreatic carcinoma cell line BxPC-3 and PC-3 genomic DNA as the template. The target gene was cloned into retroviral vector pLXSN to construct the recombinant plasmid. After packaged in PT-67 cells the retrovirus was obtained. Then BxPC-3 and PC-3 cells were transfected with the recombinant retrovirus. Proliferation, apoptosis of pancreatic carcinoma cells and the expression of p21 protein were detected by MTT, flow cytometry and immunohistochemistry respectively. The therapeutic effect of retrovirus on hepatocellular carcinoma was observed in mice.
RESULTS: The antisense K-ras gene was successfully cloned into the vector pLXSN. Proliferation of PC-3 cells was significantly inhibited at day 1, 2, 3, 4, and 5 after transfected with pLXSN-AS-exon1/4B, compared with that of non-transfected cells and pLXSN-transfected group (F = 4.716, P < 0.05; F = 6.914, P < 0.05; F = 15.115, P < 0.05; F = 16.883, P < 0.05; F = 15.134, P < 0.05; repectively). BxPC-3 showed no significant difference among different groups. Expression of K-ras mRNA and p21 protein in PC-3 cells obviously decreased while those in BxPC-3 cells not so obviously. Apoptotic rates of PC-3 cells transfected with pLXSN-AS-exon1 and pLXSN-AS-exon4B were significantly higher than those with pLXSN and non-transfection (10.28%, 6.7% vs 2.86%, 3.24%; P < 0.01). Apoptosis of BxPC-3 cells were not significant among different groups. The size of hepatocellular carcinoma significantly decreased after treated with pLXSN-AS-exon1 and pLXSN-AS-exon4B, compared with that treated with pLXSN (0.32 ± 0.09 g, 0.352 ± 0.05 g vs 0.60 ± 0.09 g; P < 0.01).
CONCLUSION: The retrovius-mediated antisense K-ras gene can inhibit proliferation and induce apoptosis of pancreatic carcinoma cells. The mechanism may relate to down-regulating expression of K-ras mRNA and p21 protein.
- Citation: Jiang KR, Liu XL, Miao Y, Lu C, Dai CC, Xu ZK, Qian ZY. Therapeutic effects of recombinant retrovirus mediated antisense K-ras gene on pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2627-2632
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2627.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2627
肿瘤是多基因改变的结果. 包括癌基因激活, 抑癌基因失活等. Ras癌基因在细胞分化和信号转导过程中等中扮演着重要的角色[1-2]. 由点突变导致ras激活后改变GAP与GTP的结合和GTP酶的活性从而影响合成GDP过程, 使传递到细胞内的效应器的信号刺激延长, 从而刺激细胞生长, 抑制上皮细胞分化而致癌[3-4]. K-ras基因在多种恶性肿瘤中均有突变, 但突变率不及50%[2-6], 而以胰腺癌为最高, 可达75-100%以上[7-13], 是胰腺癌基因治疗非常理想的靶点之一. 我们通过含反义K-ras癌基因重组逆转录病毒转染胰腺癌细胞BxPC-3和PC-3, 并进行动物实验, 探讨其对胰腺癌p21蛋白表达、细胞增生和凋亡的影响.
BxPC-3和PC-3胰腺癌细胞株分别购于中国科学院上海生化细胞所和北京协和医院病理科; PMI1640, DMEM为Gibco公司产品; 胎牛血清(FBS)由浦东开发区农场生产. Wizard Genomic DNA Purification Kit为Promega公司产品; 长链Taq酶及DL2000Marker购自大连Takara公司, λDNA EcoRI+HindⅢ Marker购自MBI公司. 琼脂糖凝胶片段回收试剂盒购自上海华舜生物工程有限公司; NIH3T3, PT67细胞、逆转录病毒载体pLXSN、大肠杆菌DH5α由南京医科大学微生物学与免疫学系保存; T4连接酶及限制性内切酶EcoRI, BamHI和核糖核酸酶(RNase)均购自南京生兴生物有限公司; Superfect Transfection Reagent转染试剂盒由美国Qiagen公司提供; 聚凝胺(polybrene), MTT由Amerasco公司生产; Tripue为罗氏公司产品; K-rasmAb源于Merck公司; SABC试剂盒由武汉博士德生物有限公司生产; Balb/c裸鼠来源上海中科院动物中心, 为4-6周龄, 体量18-22 g; 所有引物均由上海生工生物工程有限公司合成(表1).
| 名称 | 引物序列 | 产物长度 |
| 反义序列1(exon1及侧翼序列) | 上游: 5'-CTC GAA TTC ACT GGT GGA GTA GAT AG-3' | 294 bp |
| 下游: 5'-CTC GGA TCC GGT CAG AGA AAC CTT TAT CTG-3' | ||
| 反义序列2(exon4B及侧翼序列) | 上游: 5'-CTC GAA TTC CAG TTG CCT GAA GAG CAT A-3' | 558 bp |
| 下游: 5'-CTC GGA TCC CAA CAT TCA CAC TTG GTA AGA-3' | ||
| RT-PCR | 上游: 5'-CTC GGA TCC GTC CTA ATA TAT GTA ATA TAT-3' | 579 bp |
| 下游: 5'-CTC GAA TTC CAT TAA GTT TCA CAC CAA CAT-3' | ||
| β-actin | 上游: 5'-TGA CGG GGT CAC CCA CAC TGT GCC CAT CTA-3' | 661 bp |
| 下游: 5'-CTA GAA GCA GCG GTG GAC GAT GGA-3' |
胰腺癌细胞株BxPC-3和PC-3培养在37 ℃, 50 mL/L CO2孵箱中. 培养液为含100 mL/L FBS的RPMI1640, PT-67和NIH3T3细胞培养液为含100 mL/L FBS的DMEM, 每2-3 d换液, 细胞长满80%时, 2.5 g/L胰酶消化传代. 取生长良好胰腺癌细胞约5×106个, 应用Wizard Genomic DNA Purification Kit并按厂家推荐使用说明书进行DNA的抽提. DNA以TE液溶解后置4 ℃备用. 反义序列1和2 PCR扩增反应体系: ddH2O 10.5 μL, 引物各1.5 μL(5 pmol/L), dNTPs 1.5 μL (2 mmol/L), MgCl2 1.5 μL(25 mmol/L), 10×Buffer 2.0 μL, 基因组DNA 1.0 μL, Taq酶0.1 μL, 最后加石蜡油50 uL. PCR反应条件: 94 ℃ 8 min×1 cycle; 94℃1 min, 50 ℃ 1 min, 72 ℃ 1 min×30 cycles; 72 ℃ 8 min×1 cycle. 所用仪器为Perkin Elmer DNA Thermal Cycler 480型PCR仪. BamHI和EcoRI双酶切pLXSN和PCR扩增目的基因, 将纯化的双酶切PCR产物和pLXSN线性载体以2:1摩尔比例混合, 加入T4DNA连接酶, 于16 ℃反应10 h. 连接产物转化感受态大肠杆菌DH5α(氯化钙法), 铺于含氨苄青霉素LB平板后在37 ℃温箱中过夜. 次日, 挑取单克隆菌加入LB液3 mL, 震荡培养(200 r/min)10 h, 抽提质粒作双酶切和序列分析鉴定. 接种PT67于6孔板中, 待细胞生长约80%满时, 吸去培养液, PBS洗涤, 将DNA 10 μL, 无血清DMEM 90 μL混匀并离心后, 加入Superfect Transfection Reagent 10 μL, 加入含血清DMEM600 μL, 轻柔混匀, 立即均匀加入PT67细胞中, 37 ℃ 50 mL/L CO2孵育3 h, PBS洗4次, 加入新鲜的完全培养基, 24 h后换液, 48 h后细胞按1:5传代, 72 h后加入G418 200 g/L筛选培养14 d, 将抗性细胞接种于6孔培养板, 扩大培养. 待细胞生长至70-80%满时更换半量新鲜培养液, 32 ℃ 50mL/L CO2孵育48 h后收集上清, 以0.45 μm滤膜过滤后-70 ℃保存. 病毒上清分别命名为pLXSN-AS-exon1和pLXSN-AS-exon4B. 将对数生长期的NIH3T3细胞接种于6孔培养板, 每孔1×105细胞. 培养12 h, 将收集的病毒上清10倍系列稀释, 每孔加入1 mL系列稀释病毒上清和终浓度为8 mg/L的polybrene进行感染, 6 h后补加1 mL完全培养基, 48 h后加G418(200 g/L), 维持浓度, 14 d后根据稀释倍数和出现的抗性细胞克隆数计算病毒滴度.
将重组pLXSN-AS-exon1/exon4B 病毒和pLXSN病毒分别感染 BxPC-3和PC-3, 同时加入终浓度为8 mg/L的polybrene, 32 ℃ 1 000 r/min离心30 min促进病毒感染. 6 h后更换新鲜培养液, 24 h重复1次, 48 h加入G418筛选14 d, 扩大培养抗性克隆.
1.2.1 MTT检测细胞增生: 将1×104细胞接种于96孔板中, 分别于培养24, 48, 72, 96, 120 h后加入MTT(5 g/L)20 μL/孔, 孵育4 h, 弃去培养基, 加DMSO 180 μL, 振荡10 min使其完全溶解, 在酶联免疫检测仪490nm波长测定吸光度A值.
1.2.2 K-rasmRNA和P21蛋白表达分析: 按Tripue说明书进行转染反义K-ras基因前后胰腺癌细胞总RNA抽提. 简要步骤如下: Tripue 1 mL反复吹吸细胞, 加入氯仿振荡, 转移上清后加入异丙醇沉淀RNA, 750 mL/L乙醇洗涤RNA, 再以三蒸水20 μL溶解RNA沉淀. 各取RNA 4 μL, 70 ℃水浴10 min, 迅速置于冰上, 补足反应体系, 42 ℃水浴90 min进行反转录, 95 ℃水浴5 min, 冰浴5 min, 冻存于-70 ℃. 以cDNA为模板进行PCR并以β-actin为内参同时进行扩增. β-actinPCR扩增条件退火温度为56 ℃, 其余同前. 所用试剂和实验用品均经DEPC处理. 常规消化BxPC-3和PC-3细胞, 完全培养基悬浮细胞后滴于玻片上, 培养2 h, 加入完全培养基, 12 h后细胞贴壁, 取出玻片按照博士德SABC免疫组化试剂盒说明书进行IHC操作.
1.2.3 细胞凋亡检测: 取BxPC-3和PC-3细胞及转染反义K-ras基因后筛选出的抗性细胞约1×106, 常规消化、离心, 重悬于4 ℃ 700 mL/L乙醇中, 进行溴化丙锭染色, 流式细胞仪检测细胞周期和细胞凋亡情况.
1.2.4 裸鼠皮下移植瘤模型体内实验: 取4-6周龄Balb/c裸鼠, 体重18-22 g, 共24只, 随机分成6组, 各分为转染pLXSN-AS- exon1组、pLXSN-AS-exon4B组和pLXSN组, 每组4只. 取对数生长期BxPC-3和PC-3细胞1×107个, 接种与于裸鼠颈背部. 治疗组于接种后3 d后于肿瘤接种皮下部位注射重组逆转录病毒200 μL, 对照组以pLXSN作为对照. 6 wk后处死后分离肿瘤组织称重. 用游标卡尺测量肿瘤长宽高(l, b, h ). 用公式V = lbh π/6计算肿瘤体积.
统计学处理 采用Student-Newman-Keuls检验和χ2检验, 数据以SPSS12.0软件包处理.
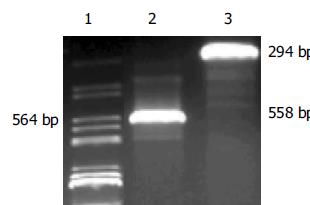
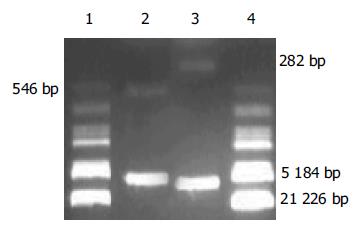
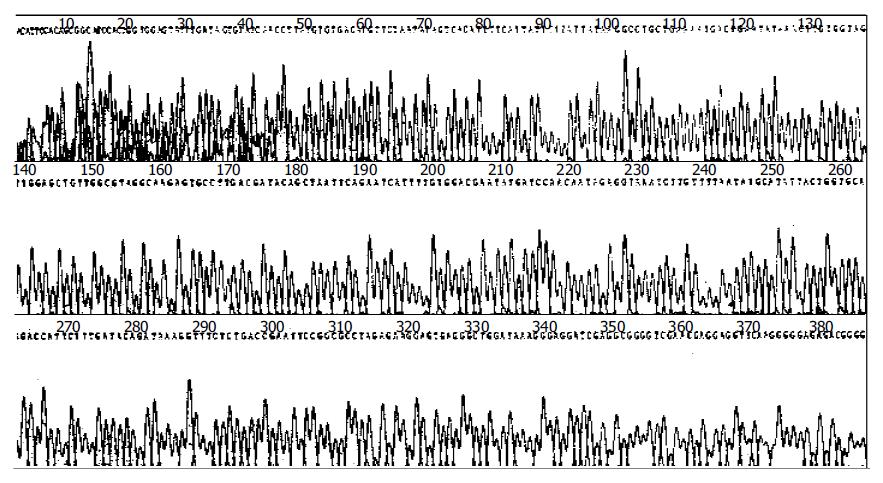
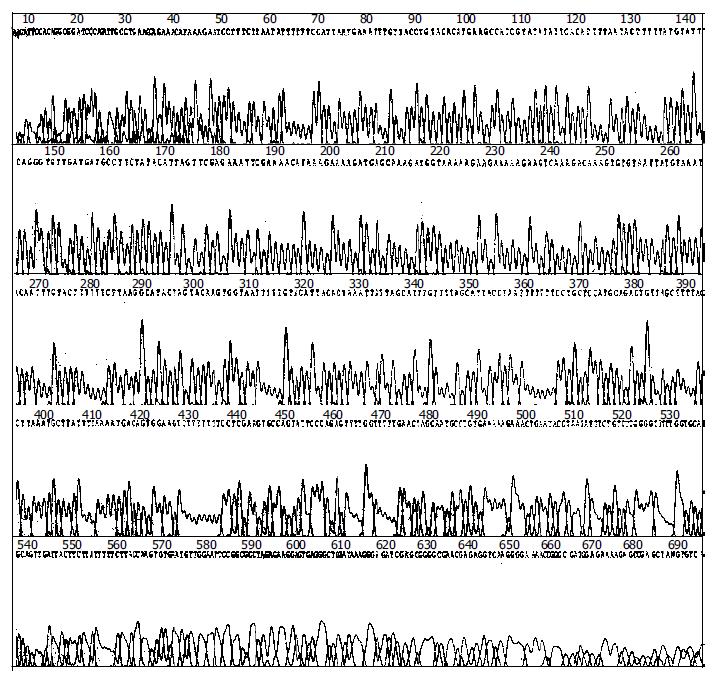
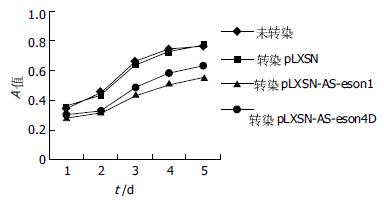
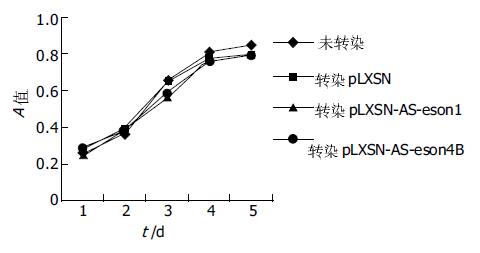
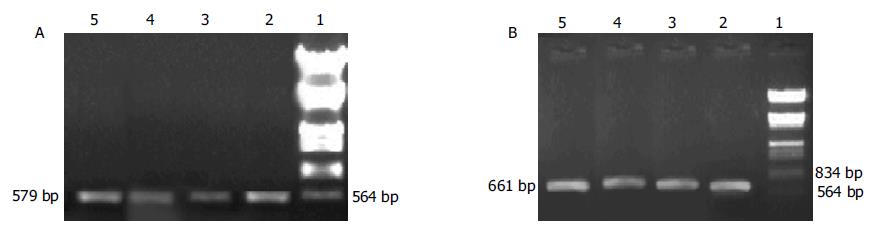
重组反义K-ras癌基因逆转录病毒载体 目的片段PCR扩增结果(图1). 挑取单个克隆菌落, 加入含氨苄青霉素的L B培养液3 mL中, 于37 ℃振荡培养10 h, 提取质粒DNA, 经BamHI和EcoRI双酶切电泳后, 可见两个清晰的条带, 大小与预期一致(图2). 应用通用引物对重组质粒进行测序. 鉴定结果显示目的基因的DNA序列与预期的相同. 结果经BLAST比对后完全一致(图3, 4). 其中PC-3细胞有第12密码子突变(GGT->GTT). 重组质粒pLXSN-AS-exon1/exon4B和pLXSN以Superfect Transfection Reagent转染PT67细胞, 同时设立无质粒的空白对照转化组, 48 h后细胞1:5传代, 72 h后加G418 200 mg/L筛选培养14 d, 扩大培养抗性克隆. 将抗性细胞接种于6孔培养板, 待细胞生长至70-80%满时更换半量新鲜培养液, 32 ℃ 5% CO2孵育48 h后收集上清, 以0.45 μm滤膜过滤后冻于-70 ℃保存. 收集的病毒上清10倍系列稀释感染对数生长期的NIH3T3细胞, G418筛选14 d后根据稀释倍数和出现的抗性细胞克隆数计算病毒滴度. 结果含pLXSN的重组逆转录病毒滴度为3×109 CFU/L, 含pLXSN-AS-exon1/exon4B重组逆转录病毒滴度分别为2, 3×108 CFU/L.
每组数据采用8个复孔, 连续观察5 d. PC-3细胞MTT结果见生长曲线(图5). BxPC-3细胞MTT结果见生长曲线(图6). PC-3细胞转染pLXSN-AS-exon1/4B组与未转染组和转染pLXSN组在第1 d(F = 4.716, P<0.05), 第2 d(F = 6.914, P<0.05), 第3 d(F = 15.118, P<0.05), 第4 d(F = 16.883, P<0.05), 第5 d(F = 15.134, P<0.05)相比, 其差异均有显著性意义; 未转染组和转染pLXSN组相比、pLXSN-AS-exon1与pLXSN-AS-exon4B组相比无显著性差异; 而BxPC-3细胞各组间均无显著性差异.
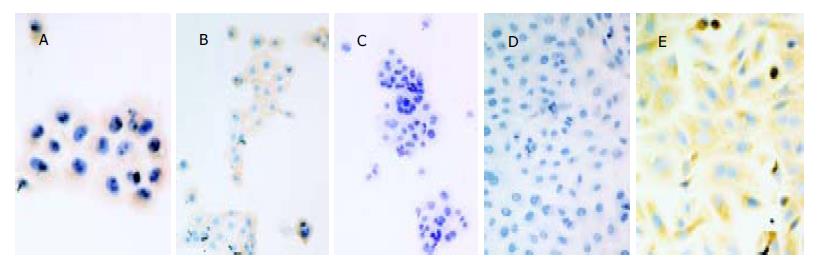
RT-PCR显示PC-3细胞K-rasmRNA表达明显下降, 而BxPC-3不如PC-3明显(图7). SABC法研究BxPC-3和PC-3细胞在转染反义K-ras基因前后的P21蛋白表达, 结果显示PC-3细胞P21蛋白表达明显下降而BxPC-3细胞无明显改变(图8).
重组逆转录病毒转染PC-3细胞后, PC-3细胞凋亡较转染前及转染pLXSN增加; 而BxPC-3无统计学差异(表2).
建立胰腺癌PC-3和BxPC-3裸鼠移植瘤模型后, 将重组逆转录病毒各1 mL注入移植瘤局部, 连续3 d, 2 mo后观察肿瘤大小和质量. 具体数据(表3).
胰腺癌是危害人类健康的常见恶性肿瘤之一. 由于缺乏有效的早期诊断和有效的治疗手段, 诊治无突破性进展, 5年生存率总体<5%[14]. 随着分子生物学的进展, 基因治疗将为胰腺癌患者带来希望. 反义基因治疗以其使用方便、易于大量生产及具有高度特异性等优点, 使其成为基因治疗中的热点. 但并非所有反义K-ras基因片段都可以阻断其蛋白表达, 从而发挥其抑瘤效果. 只有反义核酸与K-ras基因特定位置结合, 才能抑制K-ras基因表达. 这些要求有K-ras基因非翻译区或翻译起始区或剪切区或针对第12密码子的反义序列, 如果是寡核苷酸其长度要≥17个碱基[15-19]. Aoki et al[19-20]采用的是K-ras外显子1-3(不含内含子), 长346 bp. 李和伟et al[21]采用的序列为外显子4及侧翼序列, 长2.4 kb. 还有人应用外显子2-3及侧翼序列, 长2.2 kb, 结果发现有K-ras基因突变者肿瘤细胞p21, rasmRNA表达和肿瘤致瘤能力均下降, 而未突变者不受影响[22]. 然而上述文献中采用的反义序列较长, 技术上难以操作, 其反义序列往往来源于已构建好的单一重组质粒, 在用于不同肿瘤细胞株治疗时, 由于K-ras基因可能有突变, 因而并不能保证能完全封闭K-ras基因. 鉴于此, 我们采用的策略有几点不同于上述学者. 首先是反义序列直接从所要研究的胰腺癌细胞PC-3和BxPC-3中获得, 在用于实验时能够保证能与K-ras基因完全匹配, 起到最大抑瘤效果, 且长度仅数百个碱基, 易于操作; 其次是选用的序列1同时覆盖了非翻译区、翻译起始区、剪切区和第12密码子四个有效区域, 理论上可能最大程度阻断K-ras基因的表达.
实验结果表明, 质粒构建简便易行, 经重组逆转录病毒转染胰腺癌PC-3后, 细胞增生受到明显抑制(与对照组相比P<0.05); K-rasmRNA和p21蛋白表达下降. 同样在体内实验上, 反复接种部位重组逆转录病毒注射能阻止PC-3细胞肿瘤形成并抑制其生长.相反, 对BxPC-3细胞却无明显效果. 表明BxPC-3等无K-ras基因突变肿瘤形成的机制上不同于PC-3等有K-ras基因有突变者, 其发生发展可能与K-ras基因无关, 而主要由其他因素参与调控, 其内在的分子机制有待于进一步深入研究.
另外, 我们还发现转染反义K-ras基因后, 体外实验中细胞生长受到抑制, 细胞凋亡明显增加(P<0.05), 其分子机制尚待进一步研究. Kijima et al利用核酶阻断K-ras得到了相似的结果. Su et al认为是通过改变Bax/Bcl-2比例实现. 体内实验中, 局部注射重组逆转录病毒后移植瘤生长延缓, 作者分析细胞增生减缓除与下调K-rasmRNA和p21表达外, 还诱导了细胞凋亡有关. 实验中观察到, 反义序列1治疗效果要优于反义序列2, 但统计学上却没有显著性差异说明胰腺癌发生发展是多基因参与调控, K-ras基因只是其中较主要的因素之一.
编辑: N/A
| 1. | Crowe DL. Overlapping functions of Ras and Rac GTPases in regulating cancer cell proliferation and invasion. Anticancer Res. 2004;24:593-597. [PubMed] |
| 2. | Monstein HJ, Fransén K, Dimberg J, Söderkvist P. K-ras and B-raf gene mutations are not associated with gastrin- and CCK2-receptor mRNA expression in human colorectal tumour tissues. Eur J Clin Invest. 2004;34:100-106. [PubMed] [DOI] |
| 3. | Garcia-Rostan G, Zhao H, Camp RL, Pollan M, Herrero A, Pardo J, Wu R, Carcangiu ML, Costa J, Tallini G. ras mutations are associated with aggressive tumor phenotypes and poor prognosis in thyroid cancer. J Clin Oncol. 2003;21:3226-3235. [PubMed] [DOI] |
| 4. | Gemignani ML, Schlaerth AC, Bogomolniy F, Barakat RR, Lin O, Soslow R, Venkatraman E, Boyd J. Role of KRAS and BRAF gene mutations in mucinous ovarian carcinoma. Gynecol Oncol. 2003;90:378-381. [PubMed] [DOI] |
| 5. | Perentesis JP, Bhatia S, Boyle E, Shao Y, Shu XO, Steinbuch M, Sather HN, Gaynon P, Kiffmeyer W, Envall-Fox J. RAS oncogene mutations and outcome of therapy for childhood acute lymphoblastic leukemia. Leukemia. 2004;18:685-692. [PubMed] [DOI] |
| 6. | Okudela K, Hayashi H, Ito T, Yazawa T, Suzuki T, Nakane Y, Sato H, Ishi H, KeQin X, Masuda A. K-ras gene mutation enhances motility of immortalized airway cells and lung adenocarcinoma cells via Akt activation: possible contribution to non-invasive expansion of lung adenocarcinoma. Am J Pathol. 2004;164:91-100. [PubMed] [DOI] |
| 7. | Sawabu N, Watanabe H, Yamaguchi Y, Ohtsubo K, Motoo Y. Serum tumor markers and molecular biological diagnosis in pancreatic cancer. Pancreas. 2004;28:263-267. [PubMed] [DOI] |
| 8. | Ren YX, Xu GM, Li ZS, Song YG. Detection of point mutation in K-ras oncogene at codon 12 in pancreatic diseases. World J Gastroenterol. 2004;10:881-884. [PubMed] |
| 9. | Uemura T, Hibi K, Kaneko T, Takeda S, Inoue S, Okochi O, Nagasaka T, Nakao A. Detection of K-ras mutations in the plasma DNA of pancreatic cancer patients. J Gastroenterol. 2004;39:56-60. [PubMed] [DOI] |
| 10. | Ren YX, Xu GM, Li ZS, Song YG. Detection of point mutation in K-ras oncogene at codon 12 in pancreatic diseases. World J Gastroenterol. 2004;10:881-884. [PubMed] |
| 11. | Mu DQ, Peng YS, Xu QJ. Values of mutations of K-ras oncogene at codon 12 in detection of pancreatic cancer: 15-year experience. World J Gastroenterol. 2004;10:471-475. [PubMed] [DOI] |
| 14. | Jemal A, Murray T, Samuels A, Ghafoor A, Ward E, Thun MJ. Cancer statistics, 2003. CA Cancer J Clin. 2003;53:5-26. [PubMed] [DOI] |
| 15. | Bacon TA, Wickstrom E. Walking along human c-myc mRNA with antisense oligodeoxynucleotides: maximum efficacy at the 5' cap region. Oncogene Res. 1991;6:13-19. [PubMed] |
| 17. | Kita K, Saito S, Morioka CY, Watanabe A. Growth inhibition of human pancreatic cancer cell lines by anti-sense oligonucleotides specific to mutated K-ras genes. Int J Cancer. 1999;80:553-558. [DOI] |
| 18. | Aoki K, Yoshida T, Sugimura T, Terada M. Liposome-mediated in vivo gene transfer of antisense K-ras construct inhibits pancreatic tumor dissemination in the murine peritoneal cavity. Cancer Res. 1995;55:3810-3816. [PubMed] |
| 19. | Aoki K, Yoshida T, Matsumoto N, Ide H, Sugimura T, Terada M. Suppression of Ki-ras p21 levels leading to growth inhibition of pancreatic cancer cell lines with Ki-ras mutation but not those without Ki-ras mutation. Mol Carcinog. 1997;20:251-258. [DOI] |
| 20. | Nakano M, Aoki K, Matsumoto N, Ohnami S, Hatanaka K, Hibi T, Terada M, Yoshida T. Suppression of colorectal cancer growth using an adenovirus vector expressing an antisense K-ras RNA. Mol Ther. 2001;3:491-499. [PubMed] [DOI] |
| 22. | Mukhopadhyay T, Tainsky M, Cavender AC, Roth JA. Specific inhibition of K-ras expression and tumorigenicity of lung cancer cells by antisense RNA. Cancer Res. 1991;51:1744-1748. [PubMed] |