修回日期: 2004-05-30
接受日期: 2004-06-07
在线出版日期: 2004-11-15
目的: 观察幽门螺杆菌(H pylori )和非甾体消炎药(NSAID)对胃上皮细胞增生凋亡的影响.
方法: 胃癌细胞株AGS与H pylori和/或消炎痛, 阿司匹林体外共培养, 通过MTT比色法, 增生细胞核抗原(PCNA)的Western Blotting检测技术, 观察细胞增生情况, FITC-Annexin-V/PI双染色流式细胞仪检测, DNA凝胶电泳, 透射电镜方法等检测细胞凋亡.
结果: MTT比色法和蛋白质印迹检测细胞PCNA表达结果表明细胞毒素相关基因A(CagA)阳性的H pylori菌株NCTC11637能够促进细胞增生, 此外, 低密度(3.2 ×107-4×109 CFU/L)NCTC11637能促进细胞的增生, 而高浓度(>2×1010 CFU/L)则抑制细胞的增生. 消炎痛和阿司匹林能抑制细胞的活力. 当AGS细胞与H pylori和NSAID共同孵育时, 细胞的生长亦明显受到抑制. FITC-Annexin-V/PI双染色流式细胞仪检测表明消炎痛和阿司匹林可诱导细胞凋亡明显增强, 而H pylori组则未见凋亡的增强, 当二者共同作用于AGS细胞时, 细胞凋亡率明显升高, 但与非甾体消炎药单独作用组相比, 则有所下降. 透射电镜和DNA琼脂糖凝胶电泳进一步证实了FITC-Annexin-V/PI双染色流式细胞仪检测的结果.
结论: CagA阳性的H pylori更加容易促进胃上皮细胞的增生. H pylori对细胞生长的影响与H pylori的密度有关. H pylori和NSAID间的作用是相互拮抗的.
引文著录: 骆智琴, 吴叔明, 萧树东, 童菊芳, 罗鸿予, 沈冠凤. 幽门螺杆菌和非甾体消炎药对胃上皮细胞动力学的影响. 世界华人消化杂志 2004; 12(11): 2594-2598
Revised: May 30, 2004
Accepted: June 7, 2004
Published online: November 15, 2004
AIM: To investigate the effects of Helicobacter pylori (H pylori ) and (NSAID) indomethacin and aspirin on the proliferation and apoptosis of gastric epithelial cells
METHODS: Gastric cancer cell line AGS cells were co-cultured with H pylori and/or NSAID, and then proliferation of AGS was examined by MTT assay, Western blotting and detection of proliferating cell nuclear antigen (PCNA). At the same time, cell apoptosis was detected with the FITC-Annexin-V/PI double staining, DNA gel eletrophoresis and transmission electron microscopy were used to confirm the results.
RESULTS: The CagA-positive H pylori strain NCTC11637 could enhance cell proliferation. Besides, low concentrations (range from 3.2×107 CFU/L to 4×109 CFU/L) of H pylori could promote proliferation (P <0.05) of AGS cell line while high concentrations (>2 ×1010 CFU/L) could inhibit the growth of AGS cells (P <0.05). When incubated with H pylori and NSAID together, proliferation of AGS cells was inhibited. Indomethacin and aspirin increased apoptosis of AGS cells significantly (P <0.05). No obvious apoptosis was observed in the H pylori-infected cells. When cells were co-cultured with H pylori and NSAID, the percentage of apoptosis also increased significantly (P <0.05), but the percentage was lower than that of cells incubated with NSAID alone. These results were confirmed by transmission electron microscopy and DNA gel electrophoresis.
CONCLUSION: CagA(+)H pylori strains are more prone to enhance the proliferation of gastric epithelial cells than cagA(-) H pylori strains. The effects of H pylori on the cell growth are associated with the concentrations of H pylori. NSAID can inhibit the gastric epithelial cell proliferation.
- Citation: Luo ZQ, Wu SM, Xiao SD, Tong JF, Luo HY, Shen GF. Effects of Helicobacter pylori and NSAIDs on cytokinetics of gastric epithelium. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2594-2598
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2594.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2594
幽门螺杆菌(H pylori)和非甾体消炎药(NSAID)是人类胃十二指肠疾病的两个比较主要的原因. 二者单独对胃黏膜细胞生长的影响的报道很多, 但具体机制仍不甚明确. 关于二者共存时对胃黏膜细胞的影响的相互作用, 临床研究结果存在争议和矛盾, 相关的体外研究未见报道. 我们从体外研究的角度观察二者单独及共存时对胃黏膜上皮细胞动力学的影响, 明确二者之间的相互作用, 并为二者共存时的相关治疗问题提供依据.
人胃癌细胞株AGS细胞购自中科院上海细胞生物学研究所, H pylori国际标准菌株NCTC11637和NCTC12908由上海市消化疾病研究所细菌室提供, 消炎痛和阿司匹林购自SIGMA公司. 鼠抗人PCNA抗体购自丹麦DAKO公司, 过氧化物酶标记羊抗鼠二抗为CALBIOCHEM公司产品, FITC-Annexin-V/PI检测凋亡试剂盒为北京宝赛生物技术有限公司, DNA抽提试剂盒为QIAGEN公司产品. 流式细胞仪为COULTER EPICS-XL. 人胃癌细胞系AGS的培养基为含100 mL/L胎牛血清的RPMI-1640完全培养液, 置于含50 mL/L CO2的37 ℃ CO2培养箱中培养, 每3 d传代1次. H pylori活菌接种于含70 mL/L马血的Skirrow平板上, 置于37 ℃微需氧环境中(50 mL/L O2, 100 mL/L CO2, 850 mL/L N2)培养, 2 d后收集细菌, 用PBS制成细菌悬液, 在分光光度计上确定H pylori的浓度(1A660=1×1011 CFU/L, 然后将H pylori菌液作连续5倍稀释, 最终菌液浓度为3.2×107-2×1010 CFU/L).
1.2.1 MTT比色实验: 细胞以5×107 /L密度, 100 μL/孔接种于96孔培养板中. 48 h后加入干预, 每组设5个复孔, 置于37 ℃微需氧环境中(50 mL/L O2, 100 mL/L CO2, 850 mL/L N2)培养. 干预48 h后终止培养, 每孔加入5 g/L的MTT溶液20 μL, 置于37 ℃继续培养4 h后, 弃去培养上清液, 加入DMSO, 100 μL /孔, 充分振荡20 min. 选择570 nm和630 nm两个波长, 在酶标仪上测定各孔吸光度值(A)并记录结果.
1.2.2 增生细胞核抗原(PCNA)的蛋白质印迹(Western Blot)检测: 加入干预48 h后, 终止培养, 按照《分子生物学实验技术》中所述提取细胞蛋白后进行SDS-PAGE电泳, 电泳结束后, 取出凝胶, 其中一块用于考马斯亮蓝染色, 另一块用于转膜. 转膜结束后, 在封闭液中4 ℃过夜封闭. 与鼠抗人PCNA(1:1 000)室温下孵育2 h. TTBS震荡洗膜3次, 与过氧化物酶标记的羊抗鼠二抗(1:5 000)室温孵育1 h. TTBS震荡洗膜3次, 室温下DAB显色, 显色后用蒸馏水洗涤. 观察并照相.
1.2.3 FITC-Annexin-v/PI双染色流式细胞仪检测凋亡: 干预48 h后, 终止培养, 收集细胞(连同悬浮细胞), 用PBS漂洗一遍后, 加入试剂盒中的binding buffer 200 μL, FITC-Annexin 10 μL , PI 5 μL, 避光室温下孵育15-30 min, 加入binding buffer 300 μL, 上流式细胞仪检测凋亡细胞率.
1.2.4 透射电子显微镜观察: 于4 ℃离心收集各组细胞, PBS洗两次. 将细胞悬浮于250 g/L的戊二醛中, 固定30 min后, PBS洗两次. 细胞悬浮于10 g/L锇酸中, 固定1 h. 以丙酮梯度脱水. 将细胞置于丙酮: 包埋剂(1:1)中置换30 min. 用包埋剂纯浸2 h. 按常规将细胞包埋, 切片. 在透射电子显微镜上观察, 照相并记录实验结果.
1.2.5 DNA琼脂糖凝胶电泳: 用胰蛋白酶消化收集细胞, PBS漂洗一遍, 按照QIAGEN公司Blood and cell culture DNA mini kit中抽提DNA的方法, 得到DNA样品, 用紫外分光光度计测定DNA含量, 15 g/L琼脂糖80 V电泳1 h, 溴乙锭染色, DNA条带在紫外灯下观察摄片.
统计学处理 数据以mean±SD表示, 采用SAS软件统计, 组间比较采用方差分析.
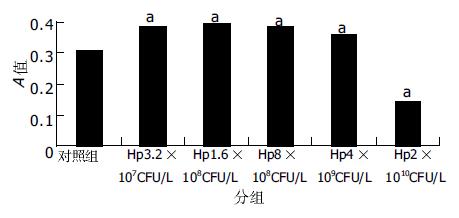
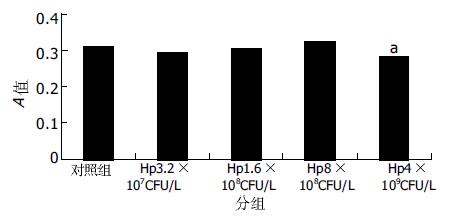
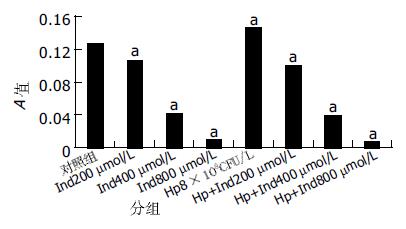
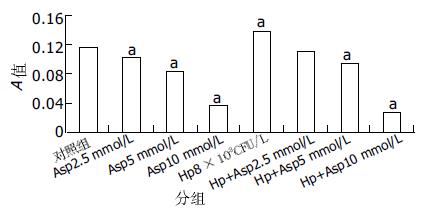
CagA阳性的NCTC11637对AGS细胞生长活力的影响: 在3.2×107-4×109 CFU/L菌液密度之间, A值明显升高(P<0.05), 当密度达到2×1010 CFU/L以上时, A值明显降低(P<0.05)(图1). CagA阴性的NCTC12908对AGS细胞生长活力的影响: 在3.2×107-8×108 CFU/L菌液密度之间, NCTC12908 H pylori株对AGS细胞活力无明显影响(P>0.05), 当浓度达到4×109 CFU/L以上时, A值明显降低(P<0.05, 图2). NSAIDs对AGS细胞生长活力的影响. 消炎痛(indimethacin, Ind200-800 μmol/L)和阿司匹林(aspirin, Asp2.5-10 mmol/L)均抑制细胞的生长, A值明显低于正常对照组(P<0.05)并呈浓度依赖性(图3, 4). H pylori和NSAIDs对AGS细胞生长活力的联合作用: 我们选择对AGS细胞增生起促进作用的8×108 CFU/L密度的CagA阳性菌液作为本实验的增生对照组, 而未加干预组则为正常对照组. 与正常对照组相比, 细菌密度为8×108 CFU/L的NCTC11637菌株与不同浓度的Ind(200, 400, 800 μmol/L)或Asp(2.5, 5, 10 mmol/L)联合作用于AGS细胞时, 呈现抑制细胞生长活力的作用, A值明显下降, P<0.05(图3, 4). 与H pylori单独作用组相比, 联合作用组的A也明显下降, P<0.05.
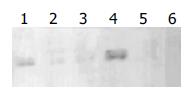
(8×108 CFU/L)NCTC11637 H pylori阳性对照组细胞的PCNA蛋白表达水平明显高于正常对照组, 而在NSAIDs作用下, 细胞的PCNA蛋白表达明显减弱, 在H pylori+NSAIDs联合作用组, 细胞PCNA的表达亦明显下降(图5).
正常对照(2.2±0.6%; 1.1±0.4%)和H pylori单独作用组(2.0±0.6%; 1.6±1.2%)的凋亡率都很低, 而消炎痛和阿司匹林诱导细胞凋亡明显增强(36.5±9.0%, 14.0±0.8%), 当NSAID和H pylori共同作用于AGS细胞时, 也可见凋亡率的增高(28.6±5.7%, 6.6±0.6%), 但与NSAID单独作用组相比则有所下降.
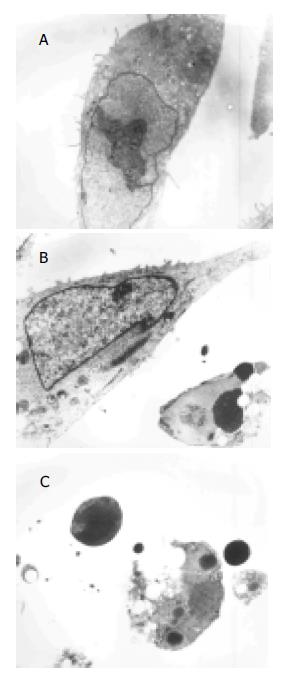
在正常对照组和H pylori干预组的细胞染色质分布均匀, 核仁易见(图7A), 在NSAID干预组和H pylori+NSAID联合作用组, 可见较多凋亡细胞, 表现为早期凋亡的细胞核染色体呈颗粒状边集于核膜下, 以及后期的核固缩, 核碎裂, 膜发泡, 凋亡小体的形成等(图7B, C).
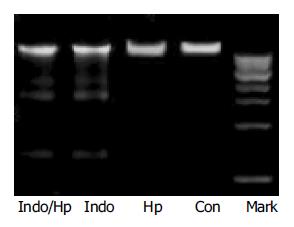
在消炎痛400 μmol/L以及H pylori+消炎痛400 μmol/L的联合作用组, DNA琼脂糖凝胶电泳带显示出"梯形"条带, 而在正常对照组, H pylori组, 阿司匹林10 mmol/L组, H pylori+阿司匹林10 mmol/L联合作用组, 未发现有"梯形"条带(图6).
胃上皮细胞的更新非常迅速, 细胞增生和细胞凋亡是维持胃肠道黏膜完整性的重要因素. 关于H pylori感染与胃上皮细胞增生的关系, 过去的研究以不同的方法显示增生率有所升高或不变[1-3]. 本研究发现, H pylori对胃上皮细胞活力的影响与其作用浓度有关, 在低浓度(3.2×107-4×109 /CFU/L)时, CagA阳性的NCTC11637菌株可促进胃上皮细胞的生长活力, 而CagA阴性的NCTC12908却未表现出明显的促生长作用, 当浓度达到2×1010 CFU/L时, 则均表现为明显的抑制生长的效应. 这有助于解释诸多报道中H pylori对胃上皮细胞生长的影响的不一致性可能与采用的浓度和菌株不同有关, 并且提示感染CagA阳性的H pylori菌株的患者发展为胃癌的危险性更高.
多项流行病学研究及动物实验已经证实了NSAID能够减少胃肠道肿瘤的发生率及死亡率. 关于NSAID的抗肿瘤作用机制目前还不甚明确, 已经提出的观点主要有以下四点: (1)NSAID可通过抑制肿瘤细胞的增生从而抑制肿瘤的生长[4]; (2)NSAID可通过诱导细胞凋亡抑制肿瘤的生长[5-8]; (3)有人认为是COX具有活化黄曲霉素等致癌原的作用, 而NSAID可抑制COX的活动从而干预癌症的发生[9]; (4)COX的产物前列腺素E2降低HLA Ⅱ类分子的基因转录水平的表达, 而HLA Ⅱ类分子参与抗原提呈给T淋巴细胞的过程, 所以前列腺素E2抑制了识别肿瘤抗原的过程, 从而使肿瘤细胞逃脱了宿主的免疫杀伤作用, 而NSAID可提高HLA Ⅱ类分子的基因转录水平的表达, 从而加强免疫系统消除肿瘤细胞的能力[10-11]. 本研究结果显示NSAID可抑制胃上皮细胞的增生, 并诱导细胞凋亡增强, 这证明了NSAID至少可通过这两条途径达到抗肿瘤的作用. 虽然DNA琼脂糖凝胶电泳法未发现Asp组和H pylori+Asp联合作用组有梯形条带的形成, 分析原因可能是DNA琼脂糖凝胶电泳主要检测凋亡晚期, 且凋亡率须大于8%以上的细胞才能出现典型的梯形条带, 而通过电子显微镜, FITC-Annexin-v/PI双染色流式细胞仪检测凋亡等技术均发现Asp干预组和H pylori +Asp联合作用组凋亡细胞增加, 这提示不能单靠一种方法确定凋亡的有无.
关于H pylori和NSAID的相互作用目前还存在争议. 临床研究的结果均存在差异[12]. 我们的研究结果发现CagA阳性的NCTC11637菌株能促进胃癌细胞系AGS的增生, 而与消炎痛, 阿司匹林等NSAID共同作用于AGS时, 则表现为抑制生长的作用, 并且诱导细胞凋亡的增强, 但较NSAID单独作用组降低, 即NSAID能够抵消H pylori的促增生作用, 而H pylori也能拮抗NSAID的促凋亡作用.
关于二者对胃上皮细胞影响的相互拮抗作用机制目前还不清楚. Konturek et al[13]通过体内研究发现H pylori感染可使黏膜胃泌素和COX-2的表达增强, 陆红et al[14]也曾报道H pylori感染的胃黏膜组织及胃癌组织中COX-2的表达增强, 胃泌素是一个有效的促细胞分裂剂, 而COX-2是一个有力的肿瘤生长促进因子及血管生长因子, 可促进前列腺素的合成从而促进细胞的增生, 并可增加上皮细胞对凋亡的抵抗性[15]. H pylori感染可能通过以上途径刺激胃上皮细胞增生, 而NSAID可抑制COX-2从而抑制胃黏膜PG的合成, 抑制胃上皮细胞黏液和碳酸氢盐的分泌, 降低胃黏膜血流量和胃上皮的更新速度[16], 并通过抑制COX-2而诱导胃肠道黏膜细胞的凋亡. Kim et al[21]也报道幽门螺杆菌感染的胃上皮细胞的COX-2表达增强, 而COX-2可增加上皮细胞对凋亡的抵抗性, 当加入选择性COX-2抑制剂NS-398后, H pylori感染的胃上皮细胞的凋亡明显增加, 并伴随Caspase-3的活化, 而且这种效应可被前列腺素E2所逆转. 这提示NSAID可通过下调COX-2的表达, 抑制前列腺素的生成这一途径促进细胞凋亡, 从而拮抗H pylori的促增生作用. p53是进化过程中高度保守的蛋白, 其主要生物学功能为引起细胞周期停滞, 诱导凋亡和促进分化. Zhu et al[17]报道消炎痛诱导胃上皮细胞凋亡与野生型p53以及c-myc表达的上调有关. 而H pylori感染能够诱导p53的点突变或过度表达, 促进基因的不稳定性从而导致不典型增生或肿瘤, 而根除H pylori后能逆转胃上皮过度增生状态并减少p53的积累[18-20]. 这些研究与本研究结果都一致证明了NSAID与幽门螺杆菌之间的相互拮抗关系, 如能进一步检测各种干预下COX-2和p53, c-myc, bak, bax等肿瘤相关基因的表达, 将有助于从分子角度明确H pylori导致胃癌的发生机制, NSAID对胃黏膜损伤的机制及NSAID的抗肿瘤机制, 为将来胃癌的防治提供新的思路.
编辑: N/A
| 1. | Fan XG, Kelleher D, Fan XJ, Xia HX, Keeling PW. Helicobacter pylori increases proliferation of gastric epithelial cells. Gut. 1996;38:19-22. [PubMed] [DOI] |
| 2. | Krug A, Rothenfusser S, Hornung V, Jahrsdörfer B, Blackwell S, Ballas ZK, Endres S, Krieg AM, Hartmann G. Identification of CpG oligonucleotide sequences with high induction of IFN-alpha/beta in plasmacytoid dendritic cells. Eur J Immunol. 2001;31:2154-2163. [PubMed] [DOI] |
| 3. | Rokkas T, Ladas S, Liatsos C, Petridou E, Papatheodorou G, Theocharis S, Karameris A, Raptis S. Relationship of Helicobacter pylori CagA status to gastric cell proliferation and apoptosis. Dig Dis Sci. 1999;44:487-493. [PubMed] [DOI] |
| 4. | Shiff SJ, Koutsos MI, Qiao L, Rigas B. Nonsteroidal antiinflammatory drugs inhibit the proliferation of colon adenocarcinoma cells: effects on cell cycle and apoptosis. Exp Cell Res. 1996;222:179-188. [PubMed] [DOI] |
| 5. | Shiff SJ, Qiao L, Tsai LL, Rigas B. Sulindac sulfide, an aspirin-like compound, inhibits proliferation, causes cell cycle quiescence, and induces apoptosis in HT-29 colon adenocarcinoma cells. J Clin Invest. 1995;96:491-503. [PubMed] [DOI] |
| 6. | Zhu GH, Wong BC, Ching CK, Lai KC, Lam SK. Differential apoptosis by indomethacin in gastric epithelial cells through the constitutive expression of wild-type p53 and/or up-regulation of c-myc. Biochem Pharmacol. 1999;58:193-200. [PubMed] [DOI] |
| 7. | Castaño E, Dalmau M, Barragán M, Pueyo G, Bartrons R, Gil J. Aspirin induces cell death and caspase-dependent phosphatidylserine externalization in HT-29 human colon adenocarcinoma cells. Br J Cancer. 1999;81:294-299. [PubMed] [DOI] |
| 8. | Zhu GH, Wong BC, Slosberg ED, Eggo MC, Ching CK, Yuen ST, Lai KC, Soh JW, Weinstein IB, Lam SK. Overexpression of protein kinase C-betal isoenzyme suppresses indomethacin-induced apoptosis in gastric epithelial cells. Gastroenterology. 2000;118:507-514. [DOI] |
| 9. | Shiff SJ, Rigas B. Nonsteroidal antiinflammatary drugs and colorectal cancers: Evolving Concepts of their chemopreventive actions. Gastroenterology. 1997;113:1992-1998. [DOI] |
| 10. | Arvind P, Papavassiliou ED, Tsioulias GJ, Qiao L, Lovelace CI, Duceman B, Rigas B. Prostaglandin E2 down-regulates the expression of HLA-DR antigen in human colon adenocarcinoma cell lines. Biochemistry. 1995;34:5604-5609. [PubMed] [DOI] |
| 11. | Rigas B, Tsioulias GJ, Allan C, Wali RK, Brasitus TA. The effect of bile acids and piroxicam on MHC antigen expression in rat colonocytes during colon cancer development. Immunology. 1994;83:319-323. [PubMed] |
| 12. | Zhu GH, Yang XL, Lai KC, Ching CK, Wong BC, Yuen ST, Ho J, Lam SK. Nonsteroidal antiinflammatory drugs could reverse Helicobacter pylori-induced apoptosis and proliferation in gastric epithelial cells. Dig Dis Sci. 1998;43:1957-1963. [DOI] |
| 13. | Konturek PC, Hartwich A, Zuchowicz M, Labza H, Pierzchalski P, Karczewska E, Bielanski W, Hahn EG, Konturek SJ. Helicobacter pylori, gastrin and cyclooxygenases in gastric cancer. J Physiol Pharmacol. 2000;51:737-749. [PubMed] |
| 15. | Kim JM, Kim JS, Jung HC, Song IS, Kim CY. Upregulated cyclooxygenase-2 inhibits apoptosis of human gastric epithelial cells infected with Helicobacter pylori. Dig Dis Sci. 2000;45:2436-2443. [PubMed] [DOI] |
| 16. | Franco L, Talamini G, Carra G, Doria D. Expression of COX-1, COX-2, and inducible nitric oxide synthase protein in human gastric antrum with Helicobacter pylori infection. Prostaglandins Other Lipid Mediat. 1999;58:9-17. [DOI] |
| 17. | Zhu GH, Wong BC, Ching CK, Lai KC, Lam SK. Differential apoptosis by indomethacin in gastric epithelial cells through the constitutive expression of wild-type p53 and/or up-regulation of c-myc. Biochem Pharmacol. 1999;58:193-200. [PubMed] [DOI] |
| 18. | Murakami K, Fujioka T, Okimoto T, Mitsuishi Y, Oda T, Nishizono A, Nasu M. Analysis of p53 gene mutations in Helicobacter pylori-associated gastritis mucosa in endoscopic biopsy specimens. Scand J Gastroenterol. 1999;34:474-477. [PubMed] [DOI] |
| 19. | Hibi K, Mitomi H, Koizumi W, Tanabe S, Saigenji K, Okayasu I. Enhanced cellular proliferation and p53 accumulation in gastric mucosa chronically infected with Helicobacter pylori. Am J Clin Pathol. 1997;108:26-34. [PubMed] |
| 20. | Hsu PI, Lai KH, Chien EJ, Lin CK, Lo GH, Jou HS, Cheng JS, Chan HH, Hsu JH, Ger LP. Impact of bacterial eradication on the cell proliferation and p53 protein accumulation in Helicobacter pylori-associated gastritis. Anticancer Res. 2000;20:1221-1228. [PubMed] |
| 21. | Kim TI, Lee YC, Lee KH, Han JH, Chon CY, Moon YM, Kang JK, Park IS. Effects of nonsteroidal anti-inflammatory drugs on Helicobacter pylori-infected gastric mucosae of mice: apoptosis, cell proliferation, and inflammatory activity. Infect Immun. 2001;69:5056-5063. [PubMed] [DOI] |