修回日期: 2004-09-13
接受日期: 2004-10-18
在线出版日期: 2004-11-15
目的: 筛选与克隆HBcAg反式调节基因, 了解其在体内的调节功能线索及机制.
方法: 以分子生物学技术构建HBcAg的真核表达载体pcDNA3.1(-)-HBcAg, 以表达质粒pcDNA3.1(-)-HBcAg转染HepG2细胞, 以空载体pcDNA3.1(-)为平行对照, 制备转染后的细胞裂解液, 提取mRNA并逆转录为cDNA, 经Rsa I酶切后, 将实验组cDNA分成两组, 分别与两种不同的接头衔接, 再与对照组cDNA进行两次消减杂交及两次抑制性聚合酶链反应(PCR), 将产物与T/A载体连接, 构建cDNA消减文库, 并转染大肠杆菌进行文库扩增, 随机挑选克隆PCR扩增后进行测序及同源性分析.
结果: 成功构建人HBcAg激活基因差异表达的cDNA消减文库. 文库扩增后得到33个阳性克隆, 进行菌落PCR分析, 均得到200-800 bp插入片段. 对插入片段测序, 并通过生物信息学分析获得其全长基因序列, 结果共获得17种编码基因.
结论: 筛选到的cDNA全长序列, 包括一些与细胞生长调节、物质代谢及肿瘤发生密切相关的蛋白编码基因, 推测了HBcAg在体内可能存在的调控机制的线索, 尚需进一步的实验证明.
引文著录: 徐志强, 张鸿飞, 成军, 王建军, 刘妍, 纪冬. 应用抑制性消减杂交技术筛选乙型肝炎病毒核心抗原反式调节基因. 世界华人消化杂志 2004; 12(11): 2576-2580
Revised: September 13, 2004
Accepted: October 18, 2004
Published online: November 15, 2004
AIM: To clone and identify human genes transactivated by hepatitis B virus core antigen (HBcAg) using suppression subtractive hybridization (SSH) technique.
METHODS: SSH and bioinformatic techniques were used for screening and cloning of the target genes transactivated by HBcAg protein. The mRNA was isolated from HepG2 cells transfected with pcDNA3.1(-)-HBcAg and pcDNA3.1(-) empty vector, respectively, and SSH method was employed to analyze the differentially expressed DNA sequence between the two groups. After restriction enzyme Rsa I digestion, small fragments of cDNAs were obtained. Then tester cDNA was divided into two groups and ligated to the specific adaptor 1 and adaptor 2, respectively. After tester cDNA was hybridized with driver cDNA and underwent nested PCR twice, the product was subcloned into T/A plasmid vectors to set up the subtractive library. Amplification of the library was carried out with E.coli strain JM109. The cDNA was sequenced and analyzed in GenBank with Blast search after PCR.
RESULTS: The subtractive library of genes transactivated by HBcAg was constructed successfully. The amplified library contains 33 positive clones. Colony PCR shows that these clones contain 200-800 bp inserts. The full-length sequences were obtained with bioinformatics method. Altogether 17 coding sequences were identified.
CONCLUSION: The obtained sequences may be the target genes transactivated by HBcAg, among which some genes are involved in cell cycle regulation, metabolism, and tumor immunity and development.
- Citation: Xu ZQ, Zhang HF, Cheng J, Wang JJ, Liu Y, Ji D. Screening and identification of the target genes transactivated by hepatitis B virus core antigen. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2576-2580
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2576.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2576
乙型肝炎病毒(HBV)是一种嗜肝性部分双链DNA病毒, 他严重危害人类的健康, 不仅引起急、慢性病毒性肝炎, 而且与肝纤维化(LF)、肝细胞癌(HCC)的发生发展密切相关[1]. HBcAg是由HBV DNA C基因区编码的一种结构性蛋白, 有保守的三维结构, 可因血清型不同而有183-185个氨基酸残基(aa), 在乙型肝炎病毒(HBV)的生活周期中, 病毒核心抗原(HBcAg)、病毒mRNA和DNA聚合酶共同构成核心颗粒, 在核心颗粒中完成病毒DNA的合成[2-3]. 抑制性消减杂交技术(suppression subtractive hybridization, SSH)是1990年代后期建立的一种基因克隆的新技术, 可以快速有效地检测到差异表达的基因[4]. 我们应用SSH技术, 构建HBcAg激活相关基因差异表达的cDNA消减文库, 筛选相关的靶基因片段, 并应用生物信息学(bioinformatics)技术获得其基因全长序列, 为研究HBcAg在HBV感染后病毒致病过程中的作用提供一定的线索.
HepG2细胞及感受态大肠杆菌JM109(本室保存), pcDNA3.1(-)真核表达载体(Invitrogen); FuGENE6 转染试剂(Roche), mRNA Purification试剂盒(Amersham Pharmacia Biotech), PCR-Select cDNA Subtraction试剂盒, 50×PCR Enzyme Mix、Advantage PCR Cloning试剂盒(Clontech), High Pure PCR Product Purification试剂盒(Boehringer Mannheim), T7、SP6通用引物及pGEM-Teasy载体(Promega).
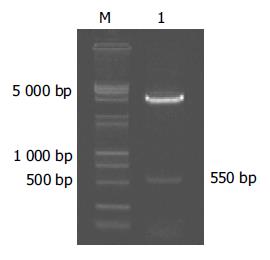
1.2.1 目的基因的扩增与纯化: 以质粒pCP10中所含的HBV ayw亚型的DNA序列为模板, 用PCR方法扩增HBcAg基因片段. 上游引物为: 5'-GCT AGC CAT GGA CAT CGA CCC TTA TA-3', 下游引物为: 5'-GGT ACC CTA ACA TTG AGG TTC CCG AG-3'. PCR产物经1%琼脂糖凝胶电泳, 切胶, 以Geneclean Ⅱ kit(Bio 101公司)回收纯化550 bp DNA条带.
1.2.2 真核表达载体的构建、纯化和DNA测序: 以T-A克隆法, 用T4 DNA连接酶(Invitrogen公司)将目的基因片段插入载体pGEM-Teasy, 电泳鉴定插入基因片段的方向性. 将获得的质粒T-HBcAg和真核表达载体pcDNA3.1(-)分别用Kpn I和Nhe I双酶切, 用T4 DNA连接酶进行定向连接, 产物转化DH5α细菌, 筛选抗氨苄青霉素阳性菌落; 提取质粒, 酶切及PCR鉴定含有HBcAg基因的阳性克隆, 命名为pcDNA3.1(-)-HBcAg. DNA测序由上海博亚公司完成
1.2.3 细胞转染及细胞mRNA提取: 用FuGENE6 转染试剂将2 μg pcDNA3.1(-)-HBcAg及pcDNA3.1(-)空载体分别转染35 mm平皿HepG2 细胞, 48 h后收获细胞. 使用mRNA Purification试剂盒, 直接提取转染了核心表达质粒及空载体的HepG2细胞mRNA, 经琼脂糖凝胶电泳及分光光度计进行定性定量分析.
1.2.4 双链cDNA(dscDNA)合成: 用Clontech公司的PCR-SelectTM cDNA Subtraction Kit中的试剂, 以获得的mRNA为模板逆转录合成cDNA.
1.2.5 消减杂交文库的建立: 采用Clontech公司的PCR-SelectTM cDNA Subtraction Kit, 常规SSH方法按说明书进行: 转染了HBcAg表达质粒及空载体的HepG2 细胞cDNA分别标记为Tester和Driver, 经RsaⅠ(一种识别4碱基序列的内切酶)消化, 产生相对较短的平端片段, 纯化酶切产物. 将Tester的cDNA分为两份, 分别连接试剂盒提供的特殊设计的寡核苷酸接头Adapter 1和Adapter 2, 然后与过量的Driver cDNA进行杂交; 合并两种杂交产物后再与Driver cDNA作第2次杂交; 然后将杂交产物做选择性PCR扩增, 使Tester cDNA中特异性表达或高表达的片段得到特异性扩增.
1.2.6 克隆鉴定分析: 扩增产物与pGEM-Teasy载体连接, 转化JM109感受态细菌, 在含氨苄青霉素的LB/X-gal/IPTG培养板上, 37 ℃培养18 h. 挑取白色菌落, 增菌, 以pGEM-Teasy载体多克隆位点两端T7/SP6引物进行菌落PCR扩增, 证明含有插入片段后(100-1 000 bp), 测序(上海博亚公司). 应用生物信息学将测得序列GenBank数据库进行同源性分析.
pcDNA3.1(-)-HBcAg载体经Kpn I/Nhe I双酶切鉴定可见550 bp的HBcAg基因DNA条带, 证明载体构建正确(图1).
使用高质量的mRNA是保证cDNA高产量的前提. 紫外分光检测显示, 转染了pcDNA3.1(-)-HBcAg质粒及空载体的HepG2细胞mRNA分别为4.53 μg和4.12 μg, A260/A280 = 1.82. 10 g/L琼脂糖凝胶电泳见mRNA为大于0.5 kb清晰慧尾片状条带.
dscDNA与接头连接效率的高低是决定抑制性消减杂交成败的最关键步骤. 将连接有adaptor 1和Adaptor 2的两组dscDNA分别用不同的特异性引物(看家基因甘油三磷酸脱氢酶G3PDH引物)进行28个循环扩增, 产物用20 g/L琼脂糖凝胶电泳鉴定.结果显示两组dscDNA扩增产物浓度相当, 说明dscDNA已与接头高效率连接.
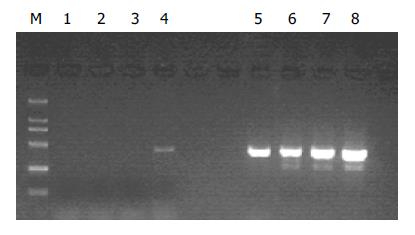
分别取l μL抑制性及非抑制性PCR产物为模板, 用看家基因G3PDH引物进行PCR扩增, 分别在18, 23, 28, 33次循环结束时从体系中吸取5 μL进行电泳鉴定. 结果显示: 与非抑制性PCR产物相比, 抑制性PCR产物中G3PDH基因产物大大减少, 说明所构建的消减文库具有很高的消减效率(图2).
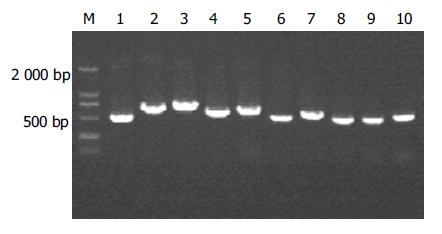
杂交产物经两轮PCR扩增后, 扩增产物与pGEM-Teasy载体连接, 转化JM109感受态细菌后有较多菌落生长, 以pGEM-Teasy载体多克隆位点两端T7/SP6引物进行菌落PCR扩增, 结果显示为200-1 000 bp大小不等的插入片段, 所获得的克隆中几乎均含有插入片段, 这些条带可能代表差异表达的基因片段(图3).
随机选择33个克隆测序, 与GenBank数据库进行初步比较, 与已知基因的部分序列高度同源(96-100%), 详细结果(表1).
| 同源蛋白基因 | 同源菌株 | 同源性 |
| 核糖体蛋白 | 10 | 98-100 |
| 线粒体单倍型 | 4 | 96-98 |
| 真核翻译延长因子1 | 3 | 99-100 |
| 铁蛋白 | 1 | 98 |
| 脂肪酸辅酶A连接酶长链4 | 1 | 97 |
| 载脂蛋白B | 1 | 98 |
| 磷酸甘油酸激酶1 | 1 | 99 |
| 原癌受体 | 1 | 96 |
| 父系表达基因10 | 2 | 96-98 |
| 推定蛋白 | 1 | 99 |
| 肌动蛋白 | 1 | 99 |
| 肿瘤相关抗原L6 | 2 | 99-100 |
| 转酮醇酶 | 1 | 100 |
| DNA反式激活多聚酶蛋白3 | 1 | 100 |
| 肿瘤排斥抗原(gp96) | 1 | 96 |
| 公认的翻译启动因子 | 1 | 100 |
| 人染色体克隆 | 1 | 98 |
HBcAg有鱼精蛋白样亲胞核性的羧基末端, 可介导细胞核内转运信号, 使大量HBcAg进入细胞核内, 而其他嗜肝DNA病毒的核壳蛋白都不向核内转运, 人肝细胞核内HBcAg的功能不明. 在病毒成熟过程中, 核壳和外膜相互作用, 形成病毒颗粒分泌的信号[5-6]. HBcAg具有保护病毒mRNA, 防止其被RNA酶降解的作用, 对于乙肝病毒前基因组RNA的装配、基因组DNA的合成具有重要的作用. HBcAg有高免疫原性, HBcAg与HBeAg一同为细胞毒性T细胞(CTL)识别的主要靶抗原, 对于HBcAg的免疫应答在病毒清除中可能有重要作用.HBcAg既可作为T细胞依赖性抗原, 也可作为非T细胞依赖性抗原, 诱导强烈CTL应答[7], B细胞刺突尖部有HBcAg的抗原决定簇, 可产生相应的体液免疫反应[8], 几乎所有HBV感染者均产生抗-HBc, 对HBcAg的免疫应答在病毒清除中可能有重要作用[9-10]. HBcAg在HBV的装配和致病机制中是必不可少的, 通过寻找肝细胞中HBcAg的相互作用蛋白, 并进一步探明其机制, 对与弄清HBcAg在HBV感染损伤中所起的具体作用, 寻找有效控制和阻断HBV感染蔓延的方法有着重要意义[11].
抑制性消减杂交方法是近年发展起来的一项新的基因克隆技术, 与传统的方法比较, 具有实验周期短、易操作、可靠性高、假阳性率低等特点, 能有效地分离扩增低丰度特异表达的基因, 可以在较短的时间内获得较理想的实验结果[12]. 我们将真核表达载体pcDNA3.1(-)-HBcAg转染肝母细胞瘤细胞系HepG2, 并以转染pcDNA3.1(-)空白载体的相同细胞系作为对照, 以2种转染的细胞系中提取的mRNA为起始材料, 应用SSH方法成功地构建了HBcAg激活相关基因差异表达的cDNA消减文库, 随机挑选33个克隆测序分析均为已知基因的序列且与GenBank中数据高度同源(96-100%).
在已知功能基因序列中, 主要包括以下几种类型: (1)细胞内结构与细胞生长相关蛋白, 如核糖体蛋白、线粒体蛋白、肌动蛋白、真核翻译延长因子等, 在细胞生长、分化、黏附中起重要作用. 真核翻译启动因子、DNA反式激活多聚酶蛋白3与细胞的转录、翻译功能密切相关; (2)参与细胞内物质代谢的蛋白基因. 如脂肪酸辅酶A连接酶长链4[13]、磷酸甘油酸激酶1(PGK1)、载脂蛋白B(ApoB)、转酮醇酶在糖、脂肪、氨基酸的代谢方面具有各种作用. 载脂蛋白是位于脂蛋白表面的蛋白质, ApoB[14-15]所载的主要脂蛋白为低密度脂蛋白和极低密度脂蛋白. 参与VLDL的合成、装配和分泌与血脂水平和冠心病有关. ApoB可促进脂蛋白与细胞膜表面受体间的结合, 帮助低密度脂蛋白-胆固醇进入动脉壁细胞形成动脉粥样硬化. 因此与致动脉粥样硬化作用有着密切的关系, 如果ApoB的含量增高, 则表明可能存在动脉粥样硬化. ApoB分子数量的增加, 使分泌入胆汁的胆固醇增多, 增加了胆汁致石性, 与胆固醇结石形成有关. 铁蛋白是体内主要储存铁的蛋白质, 与体内铁的代谢密切相关. 有研究发现肝脏中其水平的升高为抵抗氧化应激损伤的机制之一[16], 近来还有研究认为铁蛋白重链基因有抗凋亡作用, 可以使肝脏免受缺血性损伤[17], 所以推测在本实验中其表达水平的升高可能与机体对抗病毒蛋白的刺激有关; (3)肿瘤发生. 父系表达基因10(PEG10)[18-20]虽然在正常肝细胞内不表达, 但在大多数肝细胞癌样本中表达升高, PEG10在肝细胞再生和肝细胞癌发生中具有重要作用, 认识PEG10的分子基础为肝病的发展提供了新的线索, 开发抑制PEG10活性的药物可能是治疗肝细胞癌的新的方法. PGK1除参与糖的分解代谢外, 对抗肿瘤治疗也有影响[21], PGK1的过量表达可导致对多种抗肿瘤药物的抵抗, 对紫杉醇的抵抗增加30倍, 对长春新碱、阿霉素、米托蒽醌亦有交叉抵抗, 但对氨甲蝶呤、顺铂无抵抗, PGK1的这种作用成为抗癌药物治疗的重要障碍. 转酮醇酶[22-24]的刺激剂能够促进肿瘤的生长、增生和对化学药物治疗的抗药性, 而转酮醇酶的抑制药对肿瘤细胞的作用相反. 肿瘤相关抗原L6(TAL6)[25-26]表达于大多数上皮细胞癌, 并作为抗体介导治疗的靶抗原, 特异的抗TAL6的单克隆抗体能够有效地减少肺癌细胞的浸润和转移, 而肺鳞状细胞癌患者TAL6表达升高预示着手术后复发和生存率降低. 抗原癌受体的单克隆抗体介导Jurkat细胞内肿瘤样细胞的死亡[27-28]. 肿瘤排斥抗原[29-30]与体内的抗肿瘤免疫相关.
通过对上述HBcAg基因差异表达基因文库部分基因的分析, 我们发现HBcAg在细胞内表达后, 部分涉及细胞生长、分化、物质和能量代谢、信号传导、肿瘤发生等方面的基因表达增加, 提示HBcAg对体内的多个系统可能有影响. 本实验只是对HBcAg对人细胞激活相关基因进行了初步的筛选分析, 为研究HBV在体内的致病机制提供了新的线索. 有关激活基因的具体作用方式, 仍需要进一步的实验来证实.
编辑: N/A
| 2. | Pumpens P, Grens E. Hepatitis B core particles as a universal display model: a structure-function basis for development. FEBS Lett. 1999;442:1-6. [DOI] |
| 3. | Le Pogam S, Shih C. Influence of a putative intermolecular interaction between core and the pre-S1 domain of the large envelope protein on hepatitis B virus secretion. J Virol. 2002;76:6510-6517. [PubMed] [DOI] |
| 4. | Diatchenko L, Lau YF, Campbell AP, Chenchik A, Moqadam F, Huang B, Lukyanov S, Lukyanov K, Gurskaya N, Sverdlov ED. Suppression subtractive hybridization: a method for generating differentially regulated or tissue-specific cDNA probes and libraries. Proc Natl Acad Sci USA. 1996;93:6025-6030. [DOI] |
| 5. | Watts NR, Conway JF, Cheng N, Stahl SJ, Belnap DM, Steven AC, Wingfield PT. The morphogenic linker peptide of HBV capsid protein forms a mobile array on the interior surface. EMBO J. 2002;21:876-884. [PubMed] [DOI] |
| 6. | Karpenko LI, Ivanisenko VA, Pika IA, Chikaev NA, Eroshkin AM, Veremeiko TA, Ilyichev AA. Insertion of foreign epitopes in HBcAg: how to make the chimeric particle assemble. Amino Acids. 2000;18:329-337. [DOI] |
| 7. | Livingston BD, Crimi C, Fikes J, Chesnut RW, Sidney J, Sette A. Immunization with the HBV core 18-27 epitope elicits CTL responses in humans expressing different HLA-A2 supertype molecules. Hum Immunol. 1999;60:1013-1017. [PubMed] [DOI] |
| 8. | Lazdina U, Cao T, Steinbergs J, Alheim M, Pumpens P, Peterson DL, Milich DR, Leroux-Roels G, Sällberg M. Molecular basis for the interaction of the hepatitis B virus core antigen with the surface immunoglobulin receptor on naive B cells. J Virol. 2001;75:6367-6374. [PubMed] [DOI] |
| 9. | Marinos G, Torre F, Chokshi S, Hussain M, Clarke BE, Rowlands DJ, Eddleston AL, Naoumov NV, Williams R. Induction of T-helper cell response to hepatitis B core antigen in chronic hepatitis B: a major factor in activation of the host immune response to the hepatitis B virus. Hepatology. 1995;22:1040-1049. [PubMed] [DOI] |
| 10. | Shimada N, Yamamoto K, Kuroda MJ, Terada R, Hakoda T, Shimomura H, Hata H, Nakayama E, Shiratori Y. HBcAg-specific CD8 T cells play an important role in virus suppression, and acute flare-up is associated with the expansion of activated memory T cells. J Clin Immunol. 2003;23:223-232. [PubMed] [DOI] |
| 11. | Cheng J, Wang L, Li K, Lu YY, Liu Y, Duan HJ, Hong Y, Wang G, Li L, Zhang LX. Cloning and expression of the gene of augmenter of liver regeneration in yeast cells. Hepatobiliary Pancreat Dis Int. 2002;1:87-91. [PubMed] |
| 12. | Kuang WW, Thompson DA, Hoch RV, Weigel RJ. Differential screening and suppression subtractive hybridization identified genes differentially expressed in an estrogen receptor-positive breast carcinoma cell line. Nucleic Acids Res. 1998;26:1116-1123. [PubMed] [DOI] |
| 13. | Cao Y, Traer E, Zimmerman GA, McIntyre TM, Prescott SM. Cloning, expression, and chromosomal localization of human long-chain fatty acid-CoA ligase 4 (FACL4). Genomics. 1998;49:327-330. [PubMed] [DOI] |
| 14. | Chiodini BD, Barlera S, Franzosi MG, Beceiro VL, Introna M, Tognoni G. APO B gene polymorphisms and coronary artery disease: a meta-analysis. Atherosclerosis. 2003;167:355-366. [PubMed] [DOI] |
| 15. | Qureshi AI, Giles WH, Croft JB, Guterman LR, Hopkins LN. Apolipoproteins A-1 and B and the likelihood of non-fatal stroke and myocardial infarction -- data from The Third National Health and Nutrition Examination Survey. Med Sci Monit. 2002;8:CR311-CR316. [PubMed] |
| 16. | Erario MA, Gonzales S, Noriega GO, Tomaro ML. Bilirubin and ferritin as protectors against hemin-induced oxidative stress in rat liver. Cell Mol Biol (Noisy-le-grand). 2002;48:877-884. [PubMed] |
| 17. | Berberat PO, Katori M, Kaczmarek E, Anselmo D, Lassman C, Ke B, Shen X, Busuttil RW, Yamashita K, Csizmadia E. Heavy chain ferritin acts as an antiapoptotic gene that protects livers from ischemia reperfusion injury. FASEB J. 2003;17:1724-1726. [PubMed] |
| 18. | Tsou AP, Chuang YC, Su JY, Yang CW, Liao YL, Liu WK, Chiu JH, Chou CK. Overexpression of a novel imprinted gene, PEG10, in human hepatocellular carcinoma and in regenerating mouse livers. J Biomed Sci. 2003;10:625-635. [PubMed] |
| 19. | Okabe H, Satoh S, Furukawa Y, Kato T, Hasegawa S, Nakajima Y, Yamaoka Y, Nakamura Y. Involvement of PEG10 in human hepatocellular carcinogenesis through interaction with SIAH1. Cancer Res. 2003;63:3043-3048. [PubMed] |
| 20. | Ono R, Kobayashi S, Wagatsuma H, Aisaka K, Kohda T, Kaneko-Ishino T, Ishino F. A retrotransposon-derived gene, PEG10, is a novel imprinted gene located on human chromosome 7q21. Genomics. 2001;73:232-237. [PubMed] [DOI] |
| 21. | Duan Z, Lamendola DE, Yusuf RZ, Penson RT, Preffer FI, Seiden MV. Overexpression of human phosphoglycerate kinase 1 (PGK1) induces a multidrug resistance phenotype. Anticancer Res. 2002;22:1933-1941. [PubMed] |
| 22. | Cascante M, Centelles JJ, Veech RL, Lee WN, Boros LG. Role of thiamin (vitamin B-1) and transketolase in tumor cell proliferation. Nutr Cancer. 2000;36:150-154. [PubMed] [DOI] |
| 23. | Schenk G, Duggleby RG, Nixon PF. Properties and functions of the thiamin diphosphate dependent enzyme transketolase. Int J Biochem Cell Biol. 1998;30:1297-1318. [DOI] |
| 24. | Kochetov GA. Functional flexibility of the transketolase molecule. Biochemistry (Mosc). 2001;66:1077-1085. [PubMed] [DOI] |
| 25. | Kao YR, Shih JY, Wen WC, Ko YP, Chen BM, Chan YL, Chu YW, Yang PC, Wu CW, Roffler SR. Tumor-associated antigen L6 and the invasion of human lung cancer cells. Clin Cancer Res. 2003;9:2807-2816. [PubMed] |
| 26. | Kaneko R, Tsuji N, Kamagata C, Endoh T, Nakamura M, Kobayashi D, Yagihashi A, Watanabe N. Amount of expression of the tumor-associated antigen L6 gene and transmembrane 4 superfamily member 5 gene in gastric cancers and gastric mucosa. Am J Gastroenterol. 2001;96:3457-3458. [PubMed] [DOI] |
| 27. | Ma F, Zhang C, Prasad KV, Freeman GJ, Schlossman SF. Molecular cloning of Porimin, a novel cell surface receptor mediating oncotic cell death. Proc Natl Acad Sci USA. 2001;98:9778-9783. [PubMed] [DOI] |
| 28. | Zhang C, Xu Y, Gu J, Schlossman SF. A cell surface receptor defined by a mAb mediates a unique type of cell death similar to oncosis. Proc Natl Acad Sci USA. 1998;95:6290-6295. [PubMed] [DOI] |
| 29. | Harada K, Yamada A, Yang D, Itoh K, Shichijo S. Binding of a SART3 tumor-rejection antigen to a pre-mRNA splicing factor RNPS1: a possible regulation of splicing by a complex formation. Int J Cancer. 2001;93:623-628. [PubMed] [DOI] |