修回日期: 2004-09-30
接受日期: 2004-10-11
在线出版日期: 2004-11-15
目的: 提高人源化抗肝癌单链抗体hscFv25的亲和力.
方法: 设计并合成人源化抗肝癌单链抗体hscFv25重链及轻链CDR3的半随机突变引物, 构建突变体抗体库, 竞争筛选亲和力更高的突变体抗体, 对所得到的高亲和力的候选抗体, 在大肠杆菌中进行可溶性表达, 并采用细胞ELISA、细胞涂片免疫组织化学染色的方法, 对该抗体进行初步的活性鉴定.
结果: 得到了3株候选高亲和力突变体抗体, 其中的一株在大肠杆菌中获得了可溶性表达后, 进一步的活性检测结果表明, 该抗体的相对亲和力比亲本单链抗体提高了60倍左右, 同时该抗体对肝癌细胞(SMMC-7721)的免疫组织化学染色呈强阳性, 着色情况与亲本抗体相一致, 而对正常肝细胞(HL-02)染色呈阴性.
结论: 成功地构建了人源化抗肝癌单链抗体hscFv25的突变体抗体库, 并筛选到了一株亲和力更高的突变体抗体.
引文著录: 孙志伟, 王双, 杜威世, 俞炜源. 抗肝癌人源化单链抗体hscFv25的体外亲和力成熟. 世界华人消化杂志 2004; 12(11): 2568-2571
Revised: September 30, 2004
Accepted: October 11, 2004
Published online: November 15, 2004
AIM: To improve the affinity of humanized single-chain Fv (hscFv25) against hepatocellular carcinoma (HCC).
METHODS: HscFv25 mutant antibody library was constructed, from which mutant antibodies with higher affinity were competitively selected. Then the selected antibodies were expressed in E coli under the induction of isopropylthio-β-D- galactoside (IPTG), and Cell ELISA and immunohistochemical staining methods were used to detect the activities of the mutant antibodies.
RESULTS: Three strains of mutant antibodies were obtained, and all of them could be solubly and effectively expressed in E coli. One strain of the three mutant antibodies possessed the activity of its parental antibody and the affinity was about 60 times higher than its parental antibody.
CONCLUSION: The affinity of HscFv25 mutant antibody against HCC can be successfully improved after screening.
- Citation: Sun ZW, Wang S, Du WS, Yu WY. In vitro maturation of humanized single-chain Fv25 against hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2568-2571
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2568.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2568
抗体亲和力的高低是决定其临床体内应用价值的最重要因素之一. 对鼠源性基因工程小分子抗体进行人源化改造后或通过对抗体库筛选等所获得的抗体经常会存在抗体亲和力降低或较低的情况, 为提高这些抗体的实用价值, 就需要提高抗体的亲和力. 抗体的体外亲和力成熟是模拟体内抗体亲和力成熟过程, 通常采用错配PCR法等手段将抗体基因进行突变, 利用噬菌体或细菌表面呈现技术, 构建突变体抗体库, 然后进行筛选, 以获得亲和力更高的抗体. mscFv25是我们制备的一株鼠源性抗肝癌单链抗体, 在此基础上, 对其进行了人源化改造, 获得了人源化抗肝癌单链抗体(hscFv25), 但hscFv25与mscFv25相比亲和力有所下降[1], 因此我们对该抗体进行体外亲和力成熟, 以获得高亲和力的更具临床应用价值的抗肝癌人源化抗体.
E.coli TG1、BL21(DE3)菌株为本室保存. 噬菌粒载体pHB1为本室保存, 表达载体pTIG为军事医学科学院生物工程研究所赵志虎副研究员惠赠, 该载体在pET22b基础上改造而来, 含促进可溶性表达的伴侣分子硫氧还蛋白基因(Trx), Trx与下游抗体基因之间引入了翻译终止启始序列TAAATG. IPTG、琼脂糖、SDS-PAGE所用材料及限制性内切酶等, 购自Sigma公司. Taq DNA聚合酶和T4 DNA连接酶为Promega公司产品. 羊抗M13 mAb为Pharmacia Biotech公司产品. PCR引物由上海生物工程公司合成, 构建突变体抗体库所用引物, PL: 5'-TTGCGGCCGCTTTGATCTCGACCTTGGTCCCTCCCAA(CX)(GX)(TX)(GX)(TX)(AX)(CX)(GX)(GX)(AX)(AX)(CX)(AX)(TX)(GX)(TX)(GX)(TX)(AX)(CX)(TX)(TX)(TX)(GX)(AX)(GX)(AX)GCAGAAATAAACTCCCAGATCCTC-3'(VL 3'端引物, 含轻链CDR3半随机突变, 3'端引入NotI酶切位点), PH: 5'-GACCAGGGTGCCACAGCCCCA(GX)(TX)(AX)(AX)(GX)(AX)(GX)(AX)(AX)(GX)(GX)(GX)(TX)(CX)(CX)(CX)(AX)(CX)(CX)(AX)(AX)TCTTGCACAAGAATAGACCAC-3'(VH 3'端引物, 含重链CDR3半随机突变), P3: 5'-TGGGGCTGTGGCACCCTGGTCACC-3'(5'端引物, 与PL为一对引物, 扩增VH 3'端-Linker- VL, 该引物与PL引物互补以便于通过重叠延伸PCR完成轻重链的拼接); P4: 5'-ACTCATGGCCCAG CCGGCCATGGAGGTACAGCTGGTTGAATC-3'(VH 5'端引物, 5'端引入SfiI酶切位点); 可溶性表达所用引物: P1: 5'-CGGAATTCTAA ATGGAGGTACAGCTGGTTGAATC-3'(VH 5'端引物, 引入EcoR I酶切位点和终止启始序列TAAATG)引物: P2: 5'-ATAGTTTAGCGGCCGCCGGTTCCAG CGGATCCGGATACGGCACCGGCGCACCTTTGATCTCGACCTTGGTCCC-3(VL3'端引物, 含检测标签E-tag序列和No t I酶切位点) .
1.2.1 突变体抗体库的构建、筛选和鉴定: 以pTIG-hscFv25为模板, PH和P4为引物, PCR扩增VH突变体基因片段; 以PL和P3为引物, PCR扩增VL突变体基因片段. 上述两个PCR扩增片段进行重叠延伸PCR, 扩增全长单链抗体突变体基因片段, 该片段用Sfi I和Not I双酶切后与相同酶切的噬菌粒载体pHB1大片段连接, 连接产物电转化入TG1, 37 ℃培养1 h后涂氯霉素抗性平板, 其中取少许按一定稀释度涂扳计算库容量, 次日克隆长出后LB培养液刮洗下来, 调整菌液浓度, 使菌液A600为1.0左右, 加150/L甘油后分装, 与-70 ℃冻存. 取菌液1 mL接种于氯霉素抗性的2×YT培养液100 mL中, 37 ℃培养至A600值0.5左右, 加辅助噬菌体M13KO7超感染, 37 ℃培养1 h后加卡那霉素(终浓度0.07 mg/L), 30 ℃ 培养过夜, 次日收集上清, 常规PEG沉淀, 获得突变体噬菌体抗体库. 测定滴度, 挑取10个克隆提质粒, Sfi I和Not I双酶切鉴定重组率. 收集107肝癌细胞(SMMC-7721), PBS洗涤3次后, PBS重悬细胞, 加亲本抗体的双价抗体(hscFv25)2 4 ℃封闭靶抗原2 h, PBS洗涤3次, 加突变体抗体库(约1012 CFU), 37 ℃作用30min, 取细胞沉淀, 用含0.5 mL/L土温20 ℃的PBS洗涤细胞10次, 破碎细胞, 取上清收集内化入细胞的噬菌体并测定滴度(亲本抗体为内化内化抗体)[2]. 上述噬菌体同107正常肝细胞(HL-02)37 ℃作用1 h以扣除非肝癌特异性抗体, 收集上清并测定滴度, 噬菌体感染大肠杆菌TG1, 并经M13KO7超感染, PEG沉淀噬菌体, 完成第一轮筛选. 同上述过程进行第2轮和第3轮筛选, 挑取单克隆进行鉴定. 第3轮筛选后的数十个克隆分别经扩增培养、超感染、PEG沉淀后得到噬菌体抗体克隆, 测定每个克隆的滴度.细胞ELISA挑选阳性克隆. 细胞ELISA方法如下: 抗原细胞SMMC-7721及阴性对照细胞HL-02均按1×108 /L细胞200 μL铺96孔板, 待细胞长满后, 弃去培养液, PBS洗涤3次后冷丙酮固定5 min, 弃去固定液并吹干, PBS洗涤3次. 800 mL/L甲醇(含3 mL/L H2O2)室温封闭内源性过氧化物酶20 min, PBS洗涤后50 g/L脱脂奶粉37 ℃封闭1 h, 弃去封闭液加噬菌体抗体(约1011 CFU), 37 ℃作用1 h, PBS洗涤10次, 加HRP标记的羊抗M13 mAb(1:5 000), 37 ℃作用30 min, PBS洗涤10次后OPD显色, 酶标仪测定A492/630值. 用亲本单链抗体hscFv25的噬菌体抗体作为阳性对照, 挑选与SMMC-7721细胞作用A492/630值高于阳性对照而与HL-02作用A492/630值低的克隆为阳性克隆, 获得高亲和力候选突变体抗体(mhscFv25)并进行序列测定.
1.2.2 候选抗体在大肠杆菌中的可溶性表达及活性鉴定: 以上述候选抗体基因为模板, 以P1和P2为引物, PCR扩增候选抗体基因, PCR产物经胶回收后分别用Eco R I、HindⅢ酶切并与相同酶切的表达载体pTIG大片段进行连接, 构建重组表达载体pTIG mhscFv25, 转化E.coli BL21(DE3)感受态细菌, 提取质粒并用EcoR I和HindⅢ双酶切鉴定. 对酶切鉴定阳性克隆进行序列测定. 活化含重组表达载体pTIG mhscFv25的宿主菌BL21(DE3), IPTG(终浓度为0.2 mmol/L)于28 ℃诱导表达6 h, 离心收集菌体, 超声碎菌. 进行12% SDS-PAGE电泳鉴定, 含表达产物的碎菌上清用Ni-NTA Agarose进行亲和层析纯化(载体内含6×His), 纯化产物的纯度采用SDS-PAGE鉴定, Lowry法定量. SMMC-7721肝癌细胞及正常肝细胞HL-02铺96孔板, 经固定和封闭后, 以上述纯化的mhscFv25为一抗(做倍比稀释, 最高终浓度为10 mg/L), 以鼠抗E-tag抗体为二抗, 以HRP标记的羊抗鼠抗体为三抗, 进行细胞ELISA, 酶标仪测定A492/630值, 达到饱和后的A492/630值降低到50%时的抗体浓度表示mhscFv25的相对亲和力. 以亲本单链抗体hscFv25-E-tag为平行对照. 同时设立正常肝细胞HL-02为阴性对照. 常规制备SMMC-7721肝癌细胞涂片, 以上述纯化产物为一抗, 以鼠抗E-tag抗体为二抗, 进行免疫组织化学染色. 对照设置: 以hscFv25-E-tag为阳性对照, SGC-7901胃癌细胞及HL-02细胞涂片作为无关抗原对照.
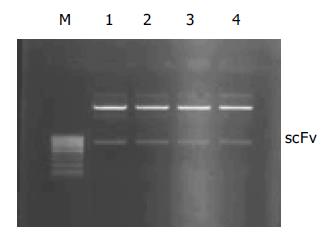
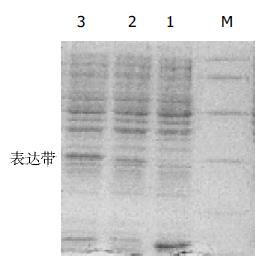
为保证突变体抗体库的多样性, 我们在轻重链突变体基因进行重叠延伸PCR后没有进一步扩增, 直接克隆入噬菌粒载体, 电转化TG1细菌, 计算库容量为5×106. 随机挑取的10个克隆经Sfi I和Not I双酶切鉴定, 均切出730 bp左右的片段(图1), 与突变体抗体基因大小一致. 转化菌经扩增、超感染和PEG沉淀后获得了噬菌体突变体抗体库, 滴度为8×1015 CFU/L. 用来源于亲本单链抗体的Diabody竞争和正常肝细胞扣除, 经三轮筛选获得104左右可隆, 随机对其中的96个可隆进行了细胞ELISA鉴定, 其中, 在相同滴度的情况下, 有48个可隆的A492/630值的比亲本单链抗体的噬菌体抗体高, 而与正常肝细胞HL-02作用A492/630值低. 选择其中3个高A492/630值的可隆作为高亲和力突变体抗体候选可隆, 提取质粒并进行的序列测定表明, 3株候选突变体抗体与亲本抗体比较, 基因序列在CDR3发生了突变(表1), 而框架区、CDR1及CDR2无变化, 与突变体抗体库设计一致. 这3个克隆分别被命名为m1hscFv25、m2hscFv25和 m3hscFv25. 以上述三株候选抗体基因为模板, 分别以P1和P2为引物, PCR扩增候选抗体基因并分别克隆入表达载体pTIG, 构建重组表达载体pTIG m1hscFv25、pTIG m2 hscFv25 和pTIG m3hscFv25, 经EcoR I和HindⅢ双酶切鉴定证实, 抗体基因正确插入. 对酶切鉴定阳性克隆进行序列测定证实序列正确, 说明重组表达载体构建成功. 将三个重组表达载体分别转化的宿主菌BL21(DE3), 经IPTG诱导表达(以未诱导的同一菌株为对照), 碎菌上清进行的120 g/L SDS-PAGE显示, 约在Mr 30 000处均出现1条新生蛋白带(图2), 与目的蛋白的大小相一致, 表达量均约占细菌裂解上清总蛋白量的10%左右, 说明3株突变体抗体均获得可溶性表达. 用可溶性表达上清进行的细胞ELISA结果显示, m1hscFv25的亲和力稍高, 因此对m1hscFv25的可溶性表达产物进行Nie柱(His亲和层析柱)纯化, 纯度基本达到电泳纯.
| VH CDR3 | VL CDR3 | |
| m1hscFv25 | GKPWFTY | QLWNYPLYT |
| hscFv25 | LVGPFSY | SQSTHVPYT |
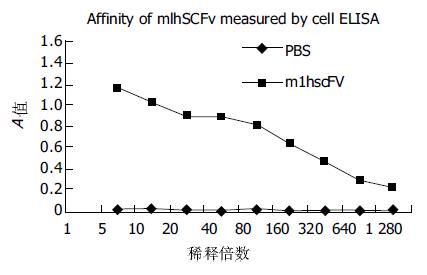
m1hscFv25与SMMC-7721肝癌细胞结合而与正常肝细胞HL-02不结合, A492/630值降低50%时的m1hscFv25的浓度为0.04 mg/L, hscFv25的浓度为2.50 mg/L, m1hscFv25的相对亲和力比亲本抗体高约60倍(图3). m1hscFv25对SMMC-7721肝癌细胞涂片染色结果显示, 抗原定位于细胞膜上, 而且偏向一极, 这与用亲本抗体的染色实验结果一致(图4). HL-02细胞对照及胃癌细胞涂片对照均呈阴性. 说明我们获得的m1hscFv25为功能性表达产物, 保持了亲本抗体的特异性和亲和性.
在人体内, 初次免疫反应产生的抗体亲和力一般都比较低, 在抗原的不断刺激下, 抗体可变区基因发生了体细胞突变, 这些突变使得某些残基, 特别是那些位于抗原结合位点的残基成为新的抗原接触残基, 某些低亲和力接触残基被置换成高亲和力接触残基, 某些接触抗原残基侧链位置可发生变化从而大大增加抗体亲和性. 这种体细胞突变加上体内存在着优先选择高亲和力抗体机制, 使得人体内随着抗原免疫过程的不断进行, 出现了大量可分泌高亲和力抗体的B细胞克隆, 这个过程称为体内亲和力成熟. 抗体具有较高的亲和力和特异性是抗体在临床应用的前提条件, 但目前从抗体库所获得的抗体或抗体经过人源化改造后, 往往存在亲和力不高或亲和力下降的情况, 因此必须提高其亲和力以提高其临床实用价值. 针对这一问题, 人们模拟抗体的体内亲和力成熟过程, 结合抗体库技术, 通过能够对外源基因产生高突变菌株的增生、错配PCR(error-prone PCR)、DNA交换(链替换, DNA shuffling or chain shuffling)或限定性突变(parsimonious mutagenesis)等方法[3-5], 构建突变体抗体库, 优化筛选条件, 筛选亲和力更高的突变体抗体, 该过程就是抗体的体外亲和力成熟过程. 该技术也可用来改善抗体的特异性. 抗体的体外亲和力成熟突破了抗体体内亲和力成熟的界限, 能够使抗体的亲和力达到超自然的强度. 通过体外亲和力成熟, 可以将抗体的亲和力提高几倍甚至上千倍[6-8].
抗体结合抗原的位点存在于抗体可变区(尤其在重链的可变区), CDR是抗体可变区中高突变部位, 也是与抗原直接接触的部位, 但在抗原、抗体结合时, 抗体中的6个CDRs通常不是全部参与与抗原结合, 而且6个CDRs与抗原结合的程度和重要性也各不相同. 由于CDR3不仅具有序列和长度的最大多样性, 而且CDR3残基还处于抗原结合位点中心, 因而通常CDR3残基是决定抗体亲和力的主要因素. 因此抗体突变库的构建目前主要集中在CDR区尤其在重链CDR3. 常采用人工合成寡核苷酸引入突变的方法, 引入的突变可完全随机也可有控制的限定性突变. 我们对CDR3采用了限定性突变的策略, 筛选到相对亲和力提高60倍左右的突变体抗体, 实现了该抗体的体外亲和力成熟, 为该抗体的进一步应用研究奠定了基础.
编辑: N/A
| 3. | Schaaper RM. Mechanisms of mutagenesis in the Escherichia coli mutator mutD5: role of DNA mismatch repair. Proc Natl Acad Sci USA. 1988;85:8126-8130. [PubMed] [DOI] |
| 4. | Fromant M, Blanquet S, Plateau P. Direct random mutagenesis of gene-sized DNA fragments using polymerase chain reaction. Anal Biochem. 1995;224:347-353. [PubMed] [DOI] |
| 5. | Arnold FH, Wintrode PL, Miyazaki K, Gershenson A. How enzymes adapt: lessons from directed evolution. Trends Biochem Sci. 2001;26:100-106. [DOI] |
| 6. | Low NM, Holliger PH, Winter G. Mimicking somatic hypermutation: affinity maturation of antibodies displayed on bacteriophage using a bacterial mutator strain. J Mol Biol. 1996;260:359-368. [PubMed] [DOI] |
| 7. | Jermutus L, Honegger A, Schwesinger F, Hanes J, Plückthun A. Tailoring in vitro evolution for protein affinity or stability. Proc Natl Acad Sci USA. 2001;98:75-80. [PubMed] [DOI] |
| 8. | Boder ET, Midelfort KS, Wittrup KD. Directed evolution of antibody fragments with monovalent femtomolar antigen-binding affinity. Proc Natl Acad Sci USA. 2000;97:10701-10705. [PubMed] [DOI] |