修回日期: 2004-08-19
接受日期: 2004-09-30
在线出版日期: 2004-10-15
目的: 构建HBV核心启动子及NPIP的重组载体, 研究NPIP 对核心启动子表达的调节作用.
方法: 根据HBV核心启动子及NPIP的序列设计引物, 用聚合酶链反应(PCR)的方法分别扩增HBV核心启动子和NPIP基因, 分别构建HBV核心启动子的报告载体及NPIP的真核表达载体, 脂质体法瞬时转染HepG2细胞.
结果: 成功构建HBV核心启动子的报告载体及NPIP的真核表达载体. 脂质体法瞬时转染HepG2细胞48 h后, 用ELISA法检测b-gal的表达, 显示核心启动子在NPIP的影响下, 其活性有降低3-4倍. 通过体内实验证明NPIP可以下调HBV核心启动子的表达.
结论: NPIP明显降低HBV核心启动子的表达, 为进一步研究HBV复制的分子生物学机制提供了新的线索.
引文著录: 高学松, 成军, 甄真, 黄燕萍, 郭江, 刘妍, 戴久增. 核孔复合体相互作用蛋白(NPIP)对乙型肝炎病毒核心启动子转录活性的调节作用. 世界华人消化杂志 2004; 12(10): 2488-2491
Revised: August 19, 2004
Accepted: September 30, 2004
Published online: October 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2488-2491
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2488.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2488
乙型肝炎病毒(HBV)的感染不仅引起急、慢性病毒性肝炎, 而且与肝纤维化、肝细胞癌的发生密切相关. 但HBV DNA复制的分子生物学机制仍不十分清楚[1-7]. HBV的基因表达与哺乳动物细胞一样, 主要以转录水平调节为主的多层调节机制. 其中启动子DNA与转录因子蛋白之间的结合和相互作用是其关键环节, 因此研究基因启动子DNA结合蛋白十分重要. 筛选启动子DNA结合蛋白的技术途径多种多样, 我们曾经利用噬菌体表面展示技术, 以HBV核心基因启动子的DNA为固相支持分子, 筛选人肝细胞cDNA文库, 获得了和HBV核心启动子结合的肝细胞蛋白-核孔复合体相互作用蛋白(NPIP), 为深入研究其和HBV核心启动子结合的机制及功能, 我们分别构建报告载体和真核表达载体, 共转染细胞, 阐明二者之间的关系, 为进一步研究HBV复制的分子生物学机制提供了新的线索.
质粒pGEM-Teasy和pcDNA3.1(-)(Promega公司), Taq酶、琼脂糖、dNTP、T4 DNA连接酶、RNA酶、玻璃奶DNA回收试剂盒(博大科技), EcoR V、BamH I、Mlu I、Nhe I(TaKaRa公司), 热循环仪、凝胶成像仪、酶联黏附读数仪、大肠杆菌DH5a、pCP10质粒为本实验室保存.
1.2.1 HBV核心启动子的扩增和克隆: 根据HBV ayw的基因序列设计引物, 在编码区的上游和下游分别设计合成一对寡核苷酸引物, P1: 5'-ACG CGT CCA AGG TCT TAC ATA AG-3', P2: 5'-GCT AGC ATG ATT AGG CAG AGG TG-3', 在引物5'端分别引入Mlu I和Nhe I位点, 由上海生工公司合成.
1.2.2 NPIP的扩增和克隆: 根据NPIP基因序列设计引物. P1: 5'-GAATTC TTGTCCATCAAATGAATATGTG-3', P2: 5'-GGATCCTTAGTTTCTTGAGATTATCATC-3'在5'-端分别引入EcoR I、BamH I酶切位点. 引物由上海生工公司合成.
1.2.3 重组报告载体pCAT-CP 的构建与鉴定: 将HBV核心启动子PCR纯化产物与pGEM-Teasy载体混合在16 ℃条件下用T4 DNA连接酶连接过夜, 随后转化用氯化钙法制备的大肠杆菌DH5a感受态, 在铺有IPTG/X-gal 的氨苄西林(LB/Amp)平板上进行蓝白斑菌落筛选, 挑取白色菌落采用碱裂解法提取质粒进行酶切鉴定. 此质粒及pCAT Basic 均用Mlu 和Nhe 双酶切回收相应的酶切片段, 在16 ℃条件下用T4 DNA 连接酶连接过夜,随后转化用氯化钙法制备的大肠杆菌DH5 感受态细胞, 随机挑选在LB/Amp平板上生长的菌落, 采用碱裂解法提取质粒, 进行Mlu I和Nhe I 双酶切鉴定.
1.2.4 重组表达载体pcDNA3.1(-)-NPIP 的构建与鉴定: 将噬斑的PCR 纯化产物pGEM-Teasy 载体混合在16 ℃条件下用T4 DNA连接酶连接过夜, 随后转化大肠杆菌DH5感受态, 在铺有IPTG/X-gal 的氨苄西林平板上进行蓝白斑菌落筛选, 挑取白色菌落用碱裂解法提取质粒, 进行酶切鉴定. 此质粒及载体pcDNA3.1(-)均用EcoR I 和BamH 双酶切回收相应的酶切片段在16 条件下用T4 DNA连接酶连接过夜随后转化用氯化钙法制备的大肠杆菌DH5 感受态细胞, 随机挑选在LB/Amp平板上生长的菌落碱裂解法提取质粒, 进行EcoR I和BamH I 双酶切鉴定.
1.2.5 转染细胞: 分别用磁珠法提取质粒将pCAT basic、pCAT promoter、pCAT-CP 和pCAT-CP+ pcDNA3.1(-)-NPIP 通过脂质体瞬时共转染HepG2 细胞用ELISA 法检测氯霉素乙酰转移酶(CAT)的表达研究pcDNA3.1(-)-NPIP 对 pCAT-CP 的功能影响.
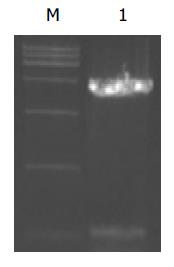
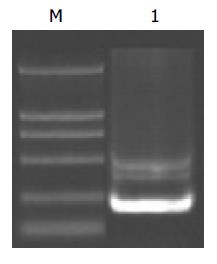
利用自行设计的引物P1/P2 成功扩增出HBV 核心启动子基因片段, PCR产物经1 g/L 琼脂糖凝胶电泳分析扩增片段约为206 bp, 与预期大小符合且无非特异扩增现象(图2). 用双酶切所得片段连接到用相同的Mlu I和Nhe I所切的pCAT 中经酶切鉴定结果正确. 表明pCAT-CP质粒构建成功(图1).
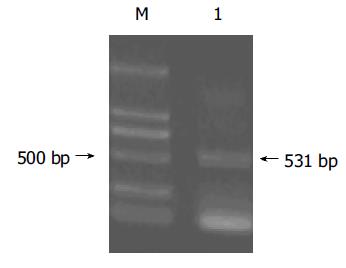
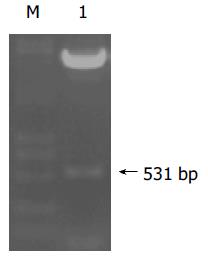
利用自行设计的引物P3/P4 成功扩增出NPIP基因片段, PCR产物经1 g/L琼脂糖凝胶电泳分析扩增片段约为531 bp, 与预期大小符合且无非特异扩增现象(图3). 用双酶切所得片段连接到用相同的EcoR I和BamH I所切的pcDNA3.1(-)中经酶切鉴定结果正确. 表明pcDNA3.1(-)-NPIP 质粒构建成功(图4).
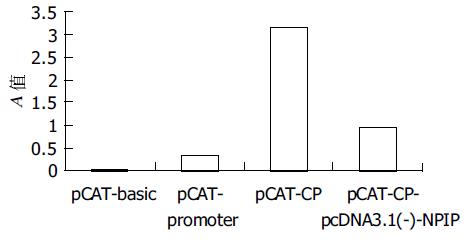
用脂质体法瞬时转染HepG2 细胞质粒用量1 mg, 脂质体用量3 mL. 培养48 h后进行ELISA 检测. 氯霉素乙酰转移酶(CAT)的表达(表1, 图5), pCAT-CP实验组酶的表达是pCAT 的3 倍, 而pcDNA3.1(-)-NPIP +pCAT-CP表达与pCAT-CP相比下降3-4倍, 证明NPIP对HBV核心启动子有下调作用.
| 质粒 | A值 |
| pCAT-basic | 0.021 |
| pCAT-promoter | 0.343 |
| pCAT-CP | 3.151 |
| pCAT-CP- pcDNA3.1(-)-NPIP | 0.969 |
乙型肝炎病毒(HBV)是一种严重危害人类健康的致病因子. HBV属嗜肝DNA病毒, 其基因组为3.2 kb部分双链的环状DNA. 目前已确定有四个主要的开放阅读框架, 分别负责编码核心抗原(pre-C/C)、核酸聚合酶(P)、表面抗原(preS/S)和X蛋白(X). 这些基因的表达受到顺式元件-启动子和增强子的调控. 目前在HBV基因组已发现并鉴定的顺式元件有四个启动子(C、X、SPⅠ、SPⅡ)、两个增强子(EnhⅠ和EnhⅡ)和糖皮质激素应答元件. 核心启动子产生两个3.5 kb RNA: 前- 核心和前基因组RNA. 前- 核心RNA编码前核心蛋白和e 抗原前基因组RNA不仅作为mRNA编码核心和聚合酶蛋白而且与病毒蛋白一起包埋入核衣壳作为模板逆转录. 前基因组RNA 的表达调控在病毒复制周期中起着关键作用. 核心启动子分为两部分: 基本核心启动子和核心上游调节元件(CURS)其上游为负性调节元件(NER 1 616-1 621 nt) CURS 能激活邻近下游的BCP[8-14].
我们利用噬菌体展示技术以DNA为固相分子筛选肝细胞文库研究启动子结合蛋白. 获得了与HBV 核心启动子结合的蛋白[15-25]. 经同源性比较确定该蛋白与NPIP同源, 同源性为99%.
人核孔复合体相互作用蛋白(NPIP), 是一种巨大的蛋白复合物, 他插在核外膜的双层膜中, 他作为一种装配的可溶性渠道起作用, 他是已知的真核细胞的细胞核与细胞质进行分子交换的惟一通道. 通过NPC的大分子运输是由细胞核浆穿梭受体Kaps介导的, Kaps通过核孔复合体的物质运输是与包含苯丙氨酸-甘氨酸(FG)肽重复序列在内的核孔蛋白相互作用完成的. 不同可溶性转运受体可以识别许多转入或转出细胞核的转运物质, 并携带载物到达各自的目标物[26]. 核质转运通过NPC转移定位, 具有高度选择性并非常迅速. 输入蛋白或输出蛋白介导的转运所需要的能量来源只能由RanGTP周期提供, 他可通过调节底物接合和释放反应来进行定向转移. 由于核糖体亚基的复杂生物合成性, 对核糖体从核中转出的分析一直很难. 通过系列研究表明40 s转出要求RanGTP酶周期及核孔蛋白; 几种核孔蛋白的突变及Ran周期的成员突变禁止60 s转运; 60 s成熟化与核释放以及转运到细胞质有紧密联系. NPIP由免疫荧光显微术证实定位于核膜, 与核孔P62共区域化[27-30]. Matsubayashi et al[31]构建绿色荧光蛋白(GFP)-融合有丝分裂原激活蛋白激酶(MAPK)蛋白研究MAPK信号传导过程, 无论是否磷酸化, GFP-MAPK都可在细胞核内聚集. 同时体外研究表明, MAPK可与核蛋白CAN/Nup214苯丙氨酸-甘氨酸肽重复序列直接结合. 说明MAPK被激活后, 从细胞质向细胞核移位, 除经典的两条传导通路外, 第三条通路是通过与核孔复合体的直接作用而通过细胞核孔的.
我们的研究在本研究组既往研究结果的基础上, 利用HBV核心基因启动子DNA表达载体的构建, NPIP真核表达载体的构建, 报告基因表达载体和真核基因表达载体的细胞共转染技术, 直接证实了NPIP与HBV核心基因启动子DNA之间的结合, 具有重要的生物学意义, 即NPIP可以通过与HBV核心基因启动子DNA之间的结合, 实现对HBV核心基因启动子的下调作用. HBV核心基因启动子指导着核心蛋白、聚合酶蛋白的mRNA的转录, 同时指导着HBV前基因组RNA的转录. 但是NPIP对于HBV核心基因启动子的这种调节作用, 究竟是对HBV蛋白编码基因的mRNA的转录产生下调作用, 还是下调前基因组RNA的转录, 或者兼而有之, 目前还不十分清楚, 需要进一步的研究加以证实.
总之, 通过噬菌体展示技术筛选到的核心启动子的结合蛋白NPIP, 提示在HBV感染后, HBV的复制及与相关蛋白的结合影响肝细胞核孔复合体功能, 影响核糖体的成熟, 物质的转运以及细胞信号的传导, 从而影响肝细胞的功能, 但其详细的分子生物学机制有待进一步研究.
| 4. | 陆 荫英, 王 琳, 刘 妍, 于 敏, 李 克, 王 业东, 张 玲霞, 成 军. 乙肝病毒核心抗原单链抗体细胞内免疫抗乙肝病毒基因治疗研究. 世界华人消化杂志. 2002;10:765-769. [DOI] |
| 5. | Cheng J. Molecular pathogenesis of viral hepatitis. J Gastroenterol Hepatol. 2002;16:A185. |
| 6. | 钟 彦伟, 成 军, 蔡 炯, 王 刚, 洪 源, 王 琳, 李 莉, 张 玲霞, 陈 菊梅. 丙型肝炎病毒包膜蛋白E2抗独特型人源单链可变区抗体的筛选与鉴定. 世界华人消化杂志. 2002;10:897-901. [DOI] |
| 7. | Wölcke J, Weinhold E. A DNA-binding peptide from a phage display library. Nucleosides Nucleotides Nucleic Acids. 2001;20:1239-1241. [PubMed] [DOI] |
| 8. | Cicchini C, Ansuini H, Amicone L, Alonzi T, Nicosia A, Cortese R, Tripodi M, Luzzago A. Searching for DNA-protein interactions by lambda phage display. J Mol Biol. 2002;322:697-706. [PubMed] [DOI] |
| 11. | 钟 彦伟, 成 军, 陈 新华, 王 刚, 洪 源, 王 琳, 李 莉, 张 玲霞, 陈 菊梅. 应用噬菌体表面展示技术筛选丙型肝炎病毒NS5A抗原模拟表位. 世界华人消化杂志. 2002;10:133-136. [DOI] |
| 13. | Johnson JL, Raney AK, McLachlan A. Characterization of a functional hepatocyte nuclear factor 3 binding site in the hepatitis B virus nucleocapsid promoter. Virology. 1995;208:147-158. [PubMed] [DOI] |
| 15. | Burritt JB, Bond CW, Doss KW, Jesaitis AJ. Filamentous phage display of oligopeptide libraries. Anal Biochem. 1996;238:1-13. [PubMed] [DOI] |
| 16. | Dunn IS. In vitro alpha-complementation of beta-galactosidase on a bacteriophage surface. Eur J Biochem. 1996;242:720-726. [PubMed] [DOI] |
| 17. | Pasqualini R, Ruoslahti E. Organ targeting in vivo using phage display peptide libraries. Nature. 1996;380:364-366. [PubMed] [DOI] |
| 18. | 陆 荫英, 王 琳, 刘 妍, 于 敏, 李 克, 王 业东, 张 玲霞, 成 军. 乙肝病毒核心抗原单链抗体细胞内免疫抗乙肝病毒基因治疗研究. 军医进修学院学报. 2003;24:49-51. |
| 20. | Lee WM. Hepatitis B virus infection. N Engl J Med. 1997;337:1733-1745. [PubMed] [DOI] |
| 21. | 钟 彦伟, 成 军, 王 刚, 田 小军, 陈 新华, 李 莉, 陈 菊梅, 张 玲霞. 乙型肝炎病毒核心抗原人源单链可变区抗体的筛选与鉴定. 中国公共卫生. 2002;18:153-154. |
| 22. | Smith GP. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science. 1985;228:1315-1317. [PubMed] [DOI] |
| 23. | 张 忠东, 成 军, 钟 彦伟, 杨 倩, 王 业东, 董 菁, 杨 艳杰, 张 树林. 羧肽酶N调节乙型肝炎病毒核心启动子表达活性的研究. 世界华人消化杂志. 2003;11:1131-1134. [DOI] |
| 26. | Bodoor K, Shaikh S, Enarson P, Chowdhury S, Salina D, Raharjo WH, Burke B. Function and assembly of nuclear pore complex proteins. Biochem Cell Biol. 1999;77:321-329. [PubMed] [DOI] |
| 27. | Kuersten S, Arts GJ, Walther TC, Englmeier L, Mattaj IW. Steady-state nuclear localization of exportin-t involves RanGTP binding and two distinct nuclear pore complex interaction domains. Mol Cell Biol. 2002;22:5708-5720. [PubMed] [DOI] |
| 28. | Becskei A, Mattaj IW. The strategy for coupling the RanGTP gradient to nuclear protein export. Proc Natl Acad Sci USA. 2003;100:1717-1722. [PubMed] [DOI] |
| 29. | Pyhtila B, Rexach M. A gradient of affinity for the karyopherin Kap95p along the yeast nuclear pore complex. J Biol Chem. 2003;278:42699-42709. [PubMed] [DOI] |
| 30. | Allen NP, Patel SS, Huang L, Chalkley RJ, Burlingame A, Lutzmann M, Hurt EC, Rexach M. Deciphering networks of protein interactions at the nuclear pore complex. Mol Cell Proteomics. 2002;1:930-946. [PubMed] [DOI] |
| 31. | Matsubayashi Y, Fukuda M, Nishida E. Evidence for existence of a nuclear pore complex-mediated, cytosol-independent pathway of nuclear translocation of ERK MAP kinase in permeabilized cells. J Biol Chem. 2001;276:41755-41760. [PubMed] [DOI] |