修回日期: 2004-09-09
接受日期: 2004-09-19
在线出版日期: 2004-10-15
目的: 观察5-FU联合L-Arg对裸鼠人肝癌移植瘤的作用并探讨其作用机制.
方法: 采用BEL-7402细胞株建立裸鼠人肝癌移植瘤模型, 分别给裸鼠ip生理盐水, 5-FU, 5-FU+L-Arg, 观察各组药物对肿瘤的抑制作用, 病理学观察移植瘤的坏死程度和范围. 免疫组化测定移植瘤组织内iNOS的表达. 统计分析采用SPSS10.0软件进行one-way ANOVA, Kruskal-Wallis H检验.
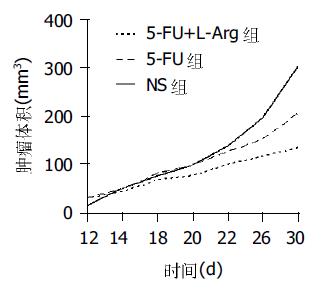
结果: 5-FU联合L-Arg能明显增加对肿瘤生长的抑制作用, 对照组, 5-FU组、5-FU+L-Arg组的肿瘤体积增长分别为257.978±59.0、172.232±66.0、91.523±26.7 mm3, 方差分析F值为30.241, aP <0.05; bP <0.05, vs A,C; cP <0.05, vs B,C.肿瘤的坏死范围与用药有明显关系, 5-FU+L-Arg组的坏死范围最大(χ2 = 15.963, P <0.05), 5-FU组、5-FU+L-Arg组的iNOS表达均明显增加, 且5-FU+L-Arg组增加更加明显, 与对照组比较P <0.05.
结论: 5-FU联合L-Arg能够抑制裸鼠人肝癌移植瘤的生长, 其机制可能与诱导一氧化氮合酶合成, NO生成增加有关.
引文著录: 尹晓燕, 姜军梅, 朱菊人. 5-氟尿嘧啶联合L-精氨酸治疗裸鼠人肝癌移植瘤及其机制. 世界华人消化杂志 2004; 12(10): 2475-2478
Revised: September 9, 2004
Accepted: September 19, 2004
Published online: October 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2475-2478
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2475.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2475
L-精氨酸是一氧化氮合酶的底物, 可以生成一氧化氮(NO), 所产生的NO作为自由基气体小分子具有两种不同的生物学效能. NO通过激活可溶性鸟苷酸环化酶合成cGMP发挥其生理调节作用, 又具有细胞毒作用, 许多研究认为NO可通过调节信号传导抑制肿瘤的生长繁殖[1-3]. 我们在体外实验中证实, NO在5-FU诱导BEL-7402细胞凋亡中发挥作用, 联合L-Arg能增加肝癌细胞的凋亡[4].但关于NO在体内抗肿瘤作用研究较少. 对裸鼠人肝癌模型用5-FU进行化疗的同时补充L-精氨酸, 探讨L-Arg/NO的体内抗肿瘤作用.
兔抗人iNOS多克隆抗体, SABC试剂盒, DAB显色试剂, 武汉博士德生物工程公司产品; DMEM高糖培养基Gibco公司产品; 新生小牛血清, 杭州四季青公司产品. 5-FU注射液, 上海旭东海普药业有限公司; L-Arg注射液, 上海信谊金朱药业有限公司.BEL7402肝癌细胞株购于山东省医学科学院基础研究所. Balb/c裸鼠由山东大学动物研究中心提供.
BEL7402细胞培养于37 ℃, 50 mL/LCO2的孵箱内, 培养基为含有100 mL/L新生小牛血清, 青霉素100 KU/L, 链霉素100 mg/L的高糖DMEM.以2.5 g/L胰酶消化传代数次. 使其满足实验所需的癌细胞数量. Balb/c裸鼠饲养于层流环境, 笼具, 垫料, 饮水及食物均采用高压蒸汽灭菌. Balb/c裸鼠30只, ♂, 4-5周龄, 采用随机数字法分为3组, 无菌条件下, 裸鼠颈背部或腹股沟内侧接种5×109/L细胞悬液0.2 mL, 接种后, 裸鼠在无菌, 恒温, 恒湿条件下饲养, 每日观察确定肿瘤出现时间, 测量肿瘤直径, 在肿瘤直径长成约5 mm大小时采用ip的方法给药, 分别注射0.2 mL生理盐水、20 mg/kg5-FU, 20 mg/kg5-FU+100 mg/kg L-Arg, 隔日给药, 共3次. 观察裸鼠的一般情况, 质量, 测量移植瘤体积, 描绘肿瘤生长曲线(用SPSS10.0的图表功能绘制), 并计算肿瘤的生长抑制率=对照组(V1-V0)-治疗组(V1-V0)/对照组(V1-V0)(V0为给药前瘤体体积, V1为给药后瘤体体积, 单位均为mm3, V=1/2AB2, A, B分别为肿瘤的长径和短径). 常规HE染色观察, 评价移植瘤坏死的程度和范围. 按切片内肿瘤组织坏死面积占切片内癌组织面积的百分比分成四个等级, ≤25%为(+), 25-50%为(++), 50-75%(++++), 百分比>75%为(++++). 免疫组织化学法检测iNOS蛋白的表达用石蜡切片, 载玻片预先经APES处理, 按SABC试剂盒说明操作. iNOS阳性反应为黄色到棕褐色, 定位于胞质, 亦可见于胞膜. 染色结果综合染色强度及阳性细胞数量两个方面, 进行半定量分析.分别评为0-3分. 染色强度:阴性(0分); 染色弱但明显高于阴性对照(1分); 染色清晰(2分); 染色强(3分). 阳性细胞数≤10%(0分); 11-25%(1分); 26-50%(2分); ≥50%(3分). 根据两项指标相加分数划分为四级: 0-1分为"-"; 2分为"+"; 3-4分为"++"; 5-6分为"+++".
统计学处理 肿瘤体积的变化采用单因素方差分析, 坏死程度及免疫组化结果采用等级资料的秩和检验(Kruskal-Wallis H), 所有数据均采用SPSS10.0统计软件进行处理.
治疗过程中裸鼠进食量减少, 治疗组裸鼠体重减轻明显, 裸鼠均未出现死亡. 5-FU对肝癌移植瘤有明显的抑制作用, 联用L-Arg后, 肿瘤生长明显减慢, 抑瘤率明显增加(图1, 表1).
| 分组 | n | 体重变化(g) | 肿瘤体积变化(mm3) | 抑瘤率(%) |
| A:NS | 10 | +1.5±0.3 | 257.978±59.0 | |
| B:5-FU | 10 | -3.0±0.5 | 172.232±66.0 | 33.2 |
| C:5-FU+L-Arg | 10 | -2.5±0.4 | 91.523±26.7 | 64.5 |
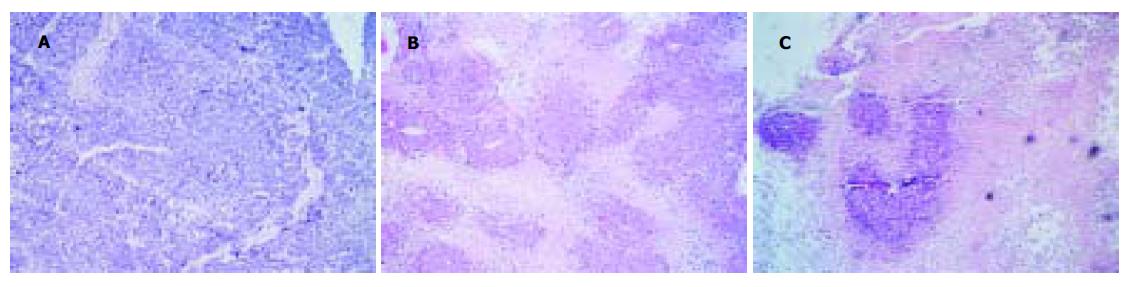
肉眼观察移植瘤为结节状, 表面有较完整的纤维包膜, 切面灰白, 周围有纤维组织向瘤中央生长并分隔移植瘤组织. 光镜下观察瘤组织间有较多粗细不一的纤维组织将瘤细胞分隔成巢状, 部分癌细胞呈梁状, 腺腔状排列, 可见较多发育不完整的血窦结构, 大多数细胞呈三角形, 胞质丰富, 较多嗜酸性颗粒, 胞核大小形态极不规则, 核质比例增大, 可见较多病理性核分裂象, 瘤巨细胞偶见. 用药后, 肿瘤组织出现不同程度的坏死, 结果显示, 各组坏死程度不一, 对照组肿瘤内可见局部坏死, 坏死(+)6, 坏死(++)3, 坏死(+++)1, 5-FU组坏死(++)5, 坏死(+++)3, 坏死(++++)2, 5-FU+L-Arg组, (++)1, (+++)4, (++++)5, 等级资料秩和检验结果χ2 = 15.963, P <0.05, 表明坏死范围与药物有明显关系(图2).
iNOS以细或粗颗粒存在于胞质, 部分表达于胞膜, 胞核内及间质细胞未见表达, 在越靠近坏死区的细胞, iNOS表达越强, 癌巢中央的细胞表达较弱或不表达. 在各组裸鼠移植瘤组织中, iNOS表达情况如下, 对照组"-"2, "+"6例, "++"2; 5-FU组"+"3, "++"5例, "+++"2例, 5-FU+L-Arg组"++"6例, "+++"4例, 等级资料秩和检验结果χ2 = 11.794, P <0.05, iNOS表达强度与用药有明显关联, 即对照组最弱, 5-FU+L-Arg组最强(图3).
5-FU在美国曾为化学治疗肝癌中应用最为普遍的药物之一. 诱导胃癌、结肠癌、胰腺癌的凋亡是其发挥治疗作用的一种方式 [5-7], 体外实验证实了5-FU也可以诱导人肝癌细胞的凋亡, 5-FU诱导细胞的凋亡是通过诱导iNOS的表达, 增加胞内自分泌NO介导的[4], 我们的实验进一步证实5-FU在体内也同样能够诱导肝癌细胞iNOS的表达. L-Arg是非必须氨基酸, 在代谢过程中可生成NO, 多胺及L-脯氨酸等, 参与细胞生长的调节[8-10]. L-Arg治疗肿瘤中已有研究, 伴恶病质的头颈部肿瘤患者, 围手术期提供富含精氨酸的营养, 患者营养状况及免疫功能虽未明显改善, 但患者生存期明显延长[11]. 关于Arg抗肿瘤的机制, 大量实验研究结果表明, Arg具有组织特异性免疫刺激作用, 能通过对宿主非特异性免疫调控, 起到改善宿主免疫力和抑制肿瘤细胞生长的作用[12-14]. 另一方面L-Arg是NO的前体, 在一氧化氮合酶的存在下生成一氧化氮和L-胍氨酸. 高浓度NO可以抑制三羧酸循环, DNA复制和线粒体呼吸, 使细胞受阻于S期, 亦可引起细胞死亡[15-16]. NO可诱导各种肿瘤细胞的凋亡[17-18], 其机制可能有: (1)直接损伤DNA和抑制蛋白质、核酸合成. (2) 通过修饰核苷酸合成限速酶一核苷酸还原酶抑制蛋白质合成. (3) 抑制三羧酸循环, 使ATP生成减少, 引起细胞凋亡, 也可使顺-乌头酸酶合成减少, 从而抑制细胞有氧代谢, 使无氧酵解增强, 产生过多酸性产物, 细胞内PH下降, 同时使细胞内线粒体Ca2+分布变化, 诱发NO的细胞毒作用[19-20]. (4) 诱导抑癌基因P53的表达[21-23]. 在体外实验中, 5-FU协同L-Arg能够使NO生成增加, 从而引起肝癌细胞的凋亡.在我们的实验中, 5-FU协同L-Arg能明显增加对裸鼠移植瘤的抑瘤率, 病理显示移植瘤组织的坏死程度明显增加, 免疫组化结果显示5-FU组, 5-FU+L-Arg组iNOS表达均有增加, 而后者增加更加明显, 表明诱导iNOS的表达是5-FU抗肿瘤的一种方式, 在iNOS表达增高的情况下, 补充底物L-Arg, 会使NO的生成增加, 从而引起肿瘤细胞的凋亡和坏死. L-Arg同时可能通过正反馈机制使iNOS的表达进一步增加.
L-Arg可以肝脏中合成, 在肝癌患者中一般肝功能较差, 合成功能减弱, 加之肿瘤患者食欲较差, L-Arg摄入减少, 因此体内L-Arg不足. 对肝癌患者应用5-FU进行化疗时, 肝癌中的iNOS的表达增强, 辅以L-Arg, 增加NO的生成, 可能会提高5-FU的化疗效果和患者的抗癌能力. 因此, L-Arg可为治疗肝癌的有效辅剂.
| 1. | Papapetropoulos N, Zhou Z, Roussos C, Goumas P, Papapetropoulos A. Effects of modulation of the NO/cGMP pathway in tumor cell lines derived from the upper airway tract. Pharmacology. 2004;72:167-176. [PubMed] [DOI] |
| 2. | Chan MH, Chien TH, Lee PY, Chen HH. Involvement of NO/cGMP pathway in toluene-induced locomotor hyperactivity in female rats. Psychopharmacology (Berl). 2004;176:435-439. [PubMed] [DOI] |
| 3. | Perrotta C, Falcone S, Capobianco A, Camporeale A, Sciorati C, De Palma C, Pisconti A, Rovere-Querini P, Bellone M, Manfredi AA. Nitric oxide confers therapeutic activity to dendritic cells in a mouse model of melanoma. Cancer Res. 2004;64:3767-3771. [PubMed] [DOI] |
| 4. | Jiang J, Liu J, Zhu J, Yang C, Zhang A. Mechanism of apoptotic effects induced by 5-fluorouracil on human liver carcinoma Bel7402 cell line. Chin Med J (Engl). 2002;115:968-971. [PubMed] |
| 5. | Li XH, Li XK, Cai SH, Tang FX, Zhong XY, Ren XD. Synergistic effects of nimesulide and 5-fluorouracil on tumor growth and apoptosis in the implanted hepatoma in mice. World J Gastroenterol. 2003;9:936-940. [PubMed] [DOI] |
| 6. | Yi TB, Yang LY. Caspase-8 in apoptosis of hepatoma cell induced by 5-fluorouracil. Hepatobiliary Pancreat Dis Int. 2003;2:98-101. [PubMed] |
| 11. | van Bokhorst-De Van Der Schueren MA, Quak JJ, von Blomberg-van der Flier BM, Kuik DJ, Langendoen SI, Snow GB, Green CJ, van Leeuwen PA. Effect of perioperative nutrition, with and without arginine supplementation, on nutritional status, immune function, postoperative morbidity, and survival in severely malnourished head and neck cancer patients. Am J Clin Nutr. 2001;73:323-332. [PubMed] |
| 13. | Rodriguez PC, Zea AH, Culotta KS, Zabaleta J, Ochoa JB, Ochoa AC. Regulation of T cell receptor CD3zeta chain expression by L-arginine. J Biol Chem. 2002;277:21123-21129. [PubMed] [DOI] |
| 16. | Gong JP, Tu B, Wang W, Peng Y, Li SB, Yan LN. Protective effect of nitric oxide induced by ischemic preconditioning on reperfusion injury of rat liver graft. World J Gastroenterol. 2004;10:73-76. [PubMed] |
| 17. | Hussain SP, Trivers GE, Hofseth LJ, He P, Shaikh I, Mechanic LE, Doja S, Jiang W, Subleski J, Shorts L. Nitric oxide, a mediator of inflammation, suppresses tumorigenesis. Cancer Res. 2004;64:6849-6853. [PubMed] [DOI] |
| 18. | Chang CS, Chen WN, Lin HH, Wu CC, Wang CJ. Increased oxidative DNA damage, inducible nitric oxide synthase, nuclear factor kappaB expression and enhanced antiapoptosis-related proteins in Helicobacter pylori-infected non-cardiac gastric adenocarcinoma. World J Gastroenterol. 2004;10:2232-2240. [PubMed] |
| 19. | Xu W, Liu LZ, Loizidou M, Ahmed M, Charles IG. The role of nitric oxide in cancer. Cell Res. 2002;12:311-320. [PubMed] [DOI] |
| 20. | Shen ZY, Shen WY, Chen MH, Shen J, Cai WJ, Yi Z. Nitric oxide and calcium ions in apoptotic esophageal carcinoma cells induced by arsenite. World J Gastroenterol. 2002;8:40-43. [PubMed] [DOI] |
| 21. | Yung HW, Bal-Price AK, Brown GC, Tolkovsky AM. Nitric oxide-induced cell death of cerebrocortical murine astrocytes is mediated through p53- and Bax-dependent pathways. J Neurochem. 2004;89:812-821. [PubMed] [DOI] |
| 22. | Wang X, Zalcenstein A, Oren M. Nitric oxide promotes p53 nuclear retention and sensitizes neuroblastoma cells to apoptosis by ionizing radiation. Cell Death Differ. 2003;10:468-476. [PubMed] [DOI] |
| 23. | Qiu LQ, Sinniah R, Hsu SI. Coupled induction of iNOS and p53 upregulation in renal resident cells may be linked with apoptotic activity in the pathogenesis of progressive IgA nephropathy. J Am Soc Nephrol. 2004;15:2066-2078. [PubMed] [DOI] |