修回日期: 2004-07-09
接受日期: 2004-07-27
在线出版日期: 2004-10-15
目的: 研究蚯蚓提取物地龙2号对实验性肝纤维化大鼠转化生长因子-b1(TGF-β1), 基质金属蛋白酶-13(MMP-13)及基质金属蛋白酶组织抑制物-1(TIMP-1)mRNA和蛋白表达的影响.
方法: 采用四氯化碳皮下注射诱导大鼠肝纤维化模型. ♂Wistar大鼠52只随机分成6组: 正常组、阴性对照组、模型组、阳性对照组、地龙2号大剂量组和小剂量组; 8 wk末, 用免疫组织化学染色法及RT-PCR检测肝组织中TGF-β1, MMP-13, TIMP-1 mRNA和蛋白的表达.
结果: 地龙2号大、小剂量组肝组织内TGF-β1及TIMP-1mRNA(TGF-β1: 0.68±0.16 vs 0.90±0.29, 0.66±0.14 vs 0.90±0.29, 后者P <0.05; TIMP-1: 1.01±0.22 vs 2.48±1.18, 1.21±0.38 vs 2.48±1.18, P <0.01)及蛋白表达均显著低于模型组(TGF-β1: 3.14 ± 2.67 vs 8.22 ± 2.99, 3.60 ± 1.90 vs 8.22 ± 2.99, P <0.01; TIMP-1: 3.57 ± 2.23 vs 7.56 ± 3.40, 3.30 ± 2.67 vs 7.56 ± 3.40, P <0.01), 而MMP-13 mRNA(1.69±0.75 vs 0.62±0.21, 1.82±0.71 vs 0.62±0.21, P <0.01)及蛋白表达则明显高于模型组(7.71 ± 1.25 vs 4.67 ± 2.45, P <0.01, 8.50 ± 2.88 vs 4.67 ± 2.45, P <0.01).
结论: 地龙2号可下调TGF-β1, TIMP-1mRNA及蛋白的表达, 并上调MMP-13mRNA及蛋白的表达, 从而抑制或减轻肝纤维化的形成.
引文著录: 陈洪, 陆亚琴, 刘顺英, 张治国, 陈平圣. 地龙2号对大鼠肝纤维化TGF-β1,MMP-13及TIMP-1 mRNA和蛋白表达的影响. 世界华人消化杂志 2004; 12(10): 2333-2337
Revised: July 9, 2004
Accepted: July 27, 2004
Published online: October 15, 2004
AIM: To investigate the effects of No.2 Earthworm extract (EE2) on the expression of TGF-β1, TIMP-1 and MMP-13 of in rats with hepatic fibrosis induced by carbon tetrachloride.
METHODS: Fifty-two male Wistar rats were randomly divided into 6 groups: normal group (N group, 6 rats), normal control group (NC group, 6 rats), model group (M group, 10 rats), positive control group (PC group, 10 rats), high dose of EE2 group (Eh group, 10 rats) and low dose of EE2 group (El group, 10 rats). The rats in M, PC, Eh and El groups were given the mixture of CCl4 and peanut oil (2:3 except the first dose) to induce liver fibrosis, 2 mL/kg sc twice a week. Eh and El groups were also treated with high (0.05 g/kg) and low (0.025 g/kg) doses of EE2, respectively, ig once a day; PC group was treated with colchicine, 0.1 mg/kg ig once a day; M and NC groups were given distilled water, 10 mL/kg ig once a day; and NC group was only administrated with peanut oil, 2 mL/kg sc twice a week. At the end of 8 wk all the survived rats were killed. The expression of mRNA and proteins of TGF-β1, MMP-13 and TIMP-1 were detected by RT-PCR and immunohistochemistry.
RESULTS: The levels of mRNA and protein of TGF-β1 and TIMP-1 in liver were significantly reduced in Eh and El groups compared with those in M group (TGF-β1 mRNA: 0.68±0.16 vs 0.90±0.29, 0.66±0.14 vs 0.90±0.29, the latter P <0.05; TIMP-1 mRNA: 1.01±0.22 vs 2.48±1.18, 1.21±0.38 vs 2.48±1.18, P <0.01. TGF-β1 protein: 3.14±2.67 vs 8.22±2.99, 3.60±1.90 vs 8.22±2.99, P <0.01; TIMP-1 protein: 3.57±2.23 vs 7.56±3.40, 3.30±2.67 vs 7.56±3.40, P <0.01); while the levels of mRNA and protein of MMP-13 in liver significantly increased in Eh and El groups compared with those in M group (MMP-13 mRNA: 1.69±0.75 vs 0.62±0.21, 1.82±0.71 vs 0.62±0.21, P <0.01; MMP-13 proteins: 7.71±1.25 vs 4.67±2.45, P <0.05; 8.50±2.88 vs 4.67±2.45, P <0.01).
CONCLUSION: EE2 significantly inhibit the development of liver fibrosis in rats induced by CCl4, and its underlying mechanism might relate to decreasing the expression of TGF-β1 and TIMP-1, and increasing that of MMP-13.
- Citation: Chen H, Lu YQ, Liu SY, Zhang ZG, Chen PS. Effects of No.2 earthworm extract on expression of TGF-β1, TIMP-1 and MMP-13 in rats with hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2333-2337
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2333.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2333
肝纤维化是肝纤维组织的生成超过了降解, 细胞外基质(extracellular matrix, ECM)在肝脏中过度沉积所致. 大量研究表明胶原酶、纤溶酶等参与了ECM的降解[1-2]. 地龙2号是采用独特生物工程技术从地龙中提取的有效活性成分, 含有蚯蚓纤溶酶及蚯蚓胶原酶. 研究发现地龙2号可以抑制大鼠肝内纤维组织的形成, 减轻肝细胞的损害, 明显降低血中透明质酸和层粘连蛋白[3]. 我们研究大鼠肝纤维化形成过程中地龙2号对肝组织内TGF-β1, MMP-13及TIMP-1 mRNA和蛋白表达的影响.
♂Wistar大鼠52只, 体质量160±10 g, 购自河南医科大学实验动物中心. 地龙2号由南京农业大学生命科学院张治国教授惠赠, 主要含有蚯蚓纤溶酶和蚯蚓胶原酶, 提取方法为: 赤子爱胜洗净、匀浆、生理盐水抽提、离心取上清, (NH4)2SO4盐析、离心去杂蛋白和核酸, 上清超滤脱盐、DEAE-纤维素层析、洗脱液超滤浓缩, 通过SephadexG75柱、第1峰系胶原酶活性峰、第二峰为纤溶酶活性峰、合并2个蛋白峰、超滤浓缩、冷冻干燥. 冻干粉含纤维蛋白溶解酶-尿激酶35 U/mg, 含胶原酶52 U/mg); CCl4由上海四星医药科技工贸公司出品; 精制花生油由山东鲁花集团出品; 秋水仙碱系昆明制药有限公司产品(1 mg /片);后两药临用前用单蒸水稀释. 兔抗大鼠TGF-β1多克隆抗体、兔抗大鼠MMP-13多克隆抗体及兔抗大鼠TIMP-1多克隆抗体均购自武汉博士德生物工程有限公司, 即用型SP免疫组化试剂盒购自福州迈新试剂公司, DAB购自北京中山生物公司. RT-PCR两步法试剂盒购自TAKARA公司. Trizol购自Sangon公司, TGF-β1, MMP-13, TIMP-1, G3PDH基因序列(表1), 由上海生工公司合成.
| Primers | Sense | Anti-sense | Length(bp) |
| TGF-β1 | 5'-TATAGCAACAATTCCTGGCG-3' | 5'-CATGGTGGTGAAGACGCCAG-3' | 165 |
| MMP-13 | 5'-TGACTATGCGTGGCTGGAA-3' | 5'-AAGCTGAAATCTTGCCTTGGA-3' | 355 |
| TIMP-1 | 5'-CCACAGATATCCGGTTCGCCTACA-3' | 5'-GCACACCCCACAGCCAGCACTAT-3' | 218 |
| G3PDH | 5'-CCCTTCATTGACCTCAACTACATGG-3' | 5'-CATGGTGGTGAAGACGCCAG-3' | 209 |
♂Wistar大鼠52只随机分成: 正常组(N) 6只, 阴性对照组(NC)6只, 模型组(M)10只, 阳性对照组(PC)10只, 地龙2号大剂量组(Eh)10只, 地龙2号小剂量组(El)10只共6组. M, PC, Eh, El组按2:3(V:V)的比例给予CCl4+花生油, 2 mL/kg, sc, 2次/wk, 共8 wk (其中首剂按3:1, 3 mL/kg给予, 后按2:3, 2 mL/kg给予); NC组只给予花生油, 2 mL/kg, sc, 2次/wk, 8 wk. 地龙2号和秋水仙碱溶于单蒸水, 每日10 mL/kg给药; Eh和El组同时用地龙2号灌胃, 每日0.05 g/kg和0.025 g/kg. PC组给予秋水仙碱每日灌胃0.1 mg/kg. M和NC组给予单蒸水每日灌胃10 mL/kg. 所有动物都给予自来水及大鼠饲料喂养, 每12 h灯照及黑暗交替. 于8 wk末处死大鼠, 分别切除同一解剖部位的肝脏于40 g/L中性缓冲甲醛中固定16 h, 3 d内石蜡包埋备组织病理学检测; 余下肝脏于液氮中速冻, -70 ℃冰箱内保存, 备提取肝组织RNA.
1.2.1 免疫组化检测: 采用SP法, 组织常规脱蜡脱水, 30 mL/L H2O2去除内源性过氧化物酶, 0.1 mol/L枸椽酸盐缓冲液微波处理, 马血清封闭非特异性抗原, 分别滴加兔抗大鼠多克隆抗体TGF-β1(1:100)、MMP-13(1:100)及TIMP-1 (1:150), 4 ℃过夜, 阴性对照以PBS代替一抗, 后依次加入羊抗兔抗体IgG, 辣根酶标记的链霉卵白素工作液进行反应, 用DAB显色、脱水、透明, 中性树胶封片, 分别检测组织中TGF-β1, MMP-13及TIMP-1的表达. 阳性片细胞胞质中出现棕黄色, 阴性片无着色. 免疫组化结果半定量判断参照[4]略修改, 每张切片不同部位随机观察五个高倍镜视野分别记录显色程度和显色范围. 显色程度分弱+、中++、强+++表示. 显色范围分: 显色范围占高倍视野<1/4为+, 占1/4-2/4为++, 占2/4-3/4为+++, >3/4为++++. 然后将每个高倍视野显色程度和范围换算成"显色指数", 显色指数 = 显色程度 × 显色范围(+, ++, +++, ++++分别按1, 2, 3, 4分计算). 取均数为每一种类蛋白表达的最终显色指数.
1.2.2 TGF-β1, MMP-13及TIMP-1 的mRNA表达: 取100 mg冻存肝脏标本放入0.5 mL玻璃匀浆器中, 加Trizol 1 mL室温下匀浆, 抽提组织RNA, 加氯仿0.2mL, 4 ℃, 14 000r低温离心15 min, 取上清0.4mL等体积异丙醇放置-20 ℃冰箱内20min, 4℃, 14 000 r低温离心15 min, 750 mL/L乙醇0.7 mL洗涤2次, 室温下晾干, 加灭菌的1 g/L DEPC水25 mL和0.5 mL RNA抑制酶, 紫外分光光度仪检测吸光度A值, -70 ℃冰箱内保存. 取RNA 2 mg, 70 ℃ 6 min, 0 ℃ 5 min预变性, 加入5 × Buffer 4mL, Oligo(dT)18 1 mL, 10 mmol/L dNTP 2 mL, Rnasin 0.5 mL, AMV 1 mL, 无Rnase酶水补至20 mL, 42 ℃ 1 h, 99 ℃ 5 min, 冰浴10 min进行逆转录. 分装每管4 mL, 加入10 × Buffer 2 mL, 25 mmol/L MgCl2 1-2 mL, 10 mmol/L dNTP 2 mL、Taq酶 1 U、Pimer 1 mL加双蒸水至25 mL, 置于PCR仪内进行扩增(引物序列及大小见表1, 各引物的扩增条件见表2). PCR产物经18 g/L脂糖凝胶, 60 mV, 30 mA下电泳. 电泳结果经FR-980生物电泳图像分析仪进行PCR产物半定量分析. TGF-β1, MMP-13, TIMP-1 mRNA相对含量分别用积分光密度值与G3PDH的积分光密度值的比值表示.
| mRNA | Enzyme | Denaturaling temp (℃) | Annealing temp (℃) | No. ofcycles | 25 mmol/L MgCl2 (mL) |
| TGF-β1 | TaqTM | 95 | 52 | 35 | 1.8 |
| MMP-13 | DyNAzymeTM | 94 | 52 | 30 | 1.2 |
| TIMP-1 | TaqTM | 95 | 60 | 35 | 1.5 |
| G3PDH | TaqTM | 95 | 52 | 30 | 1.6 |
统计学处理 用SPSS10.0软件包统计分析, 计量资料以mean±SD表示, 方差齐用多组间均数两两比较用单因素方差分析, LSD法, 方差不齐用秩和检验, 多样本两两比较用Nemenyi法进行统计分析, 双侧a=0.05为显著性检验水准.
TGF-β1mRNA表达在M, PC, Eh, El组较N, NC组均明显升高, 与M组相比Eh和El组均下降, 后者P <0.05(表3, 图1A). TIMP-1mRNA表达在M, PC, Eh, El组较N, NC组均明显升高, Eh和El组下降与M组相比P <0.01, 与PC组相比P <0.05(表3, 图1B). MMP-13mRNA表达在M, PC组升高不明显, Eh, El组升高显著, 与M, PC组相比P <0.01(表3, 图1C). MMP-13/TIMP-1mRNA在M, PC组较N, NC组明显降低, Eh和El组则显著升高, 与M, PC组相比P <0.01(表3).
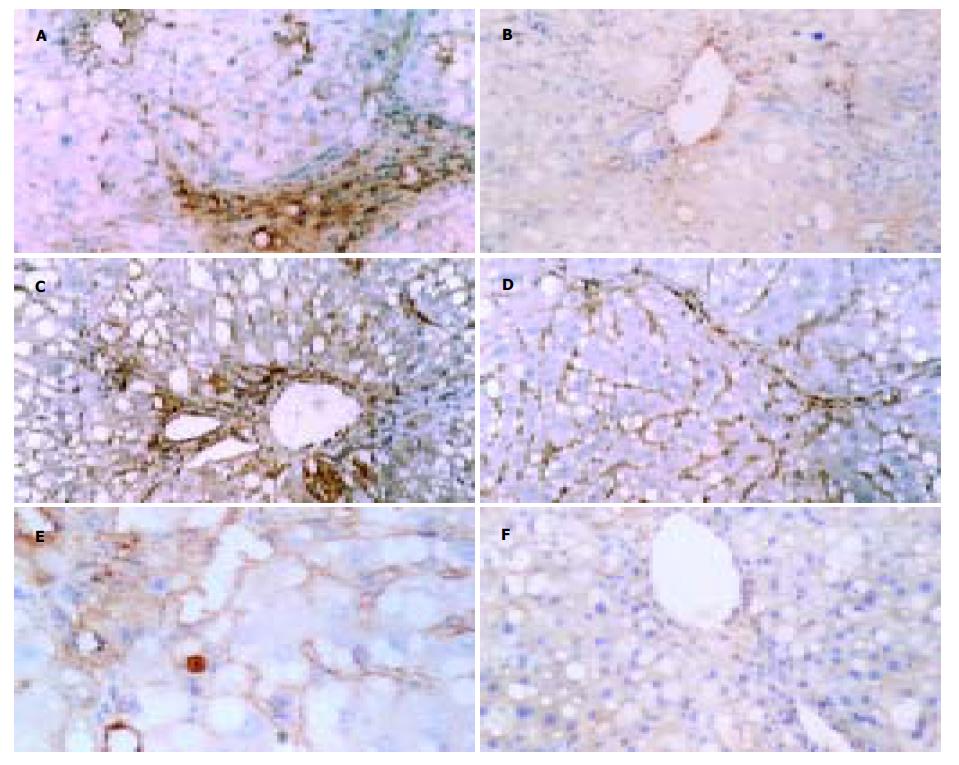
N及NC组TGF-β1未见表达; M组TGF-β1在汇管区和纤维隔中染色明显加深, 主要见于肝脏星状细胞和炎性细胞中, 呈染色较深的棕黄色; Eh及El组在纤维隔内间质细胞和炎细胞阳性染色程度减轻, 阳性细胞数目减少, 与M组相比P <0.01; PC组与M组相比, 无显著性差异(表4, 图2A, B). N及NC组MMP-13在汇管区的血管壁和胆管壁周围有阳性染色. M组阳性染色多集中于纤维间隔、中央静脉周围、肝窦处的间质细胞胞质棕黄色着色明显可见, 而在Eh及El组, 尤以纤维间隔及肝窦处的间质细胞胞质棕黄色着色明显增多, 与M组相比, MMP-13的表达显著升高, 前者P <0.05, 后者P <0.01(表4, 图2C, D). N, NC组TIMP-1在汇管区的血管壁和胆管壁周围有少量阳性染色. M组TIMP-1阳性染色表达部位和MMP-13组一致, M组可见大量表达, 与N及NC组相比P <0.01; Eh及El组仅见汇管区和纤维间隔中有少量较淡的阳性染色, 与M组相比表达明显下降, P <0.01. PC组与M组相比无统计学意义(表4, 图2E, F).
肝脏星状细胞(hepatic stellate cells, HSC)是肝纤维化发生过程中的中心环节. HSC可以产生纤溶酶, 后者能直接降解细胞外基质(ECM)[5], 并有效激活MMP-1(胶原酶-1)和MMP-3(间质溶素-1)[6], 纤溶酶通常被认为是MMPs的激活剂及血清蛋白酶级联反应通路与MMP介导的通路间的交换蛋白酶. MMP-13(胶原酶-3), 属于中性蛋白酶一族, 专门降解Ⅰ, Ⅲ型间质胶原酶, 参与肝纤维化过程中新形成的ECM的降解[6-7]. MMP-13由正常或活化的HSC产生, 亦可由库氏细胞产生[8]. 在肝纤维化发生发展过程中, TIMP-1的表达增强, MMP-13/TIMP-1比值下降, 基因不平衡表达增加了胶原纤维的累积并促进肝纤维的发展, 是肝硬化形成的重要决定因素[9-10]. 我们发现模型组MMP-13 mRNA表达与正常组及正常对照组的基因表达相近, 而地龙2号组MMP-13 mRNA表达比模型组、阳性对照组升高了2倍多. TIMP-1 mRNA表达在地龙2号组较模型组及阳性对照组明显降低. 我们也对MMP-13/TIMP-1 mRNA表达的比值进行了分析, 模型组及阳性对照组的比值只有正常0.3-0.4倍, 而用地龙2号药物干预后, MMP-13/TIMP-1 mRNA则升高了, 并超过正常的比值, 表明地龙2号可以促进MMP-13、抑制TIMP-1基因表达, 逆转肝纤维化时MMP-13/TIMP-1不平衡表达, 使其比值升高, 减轻肝纤维化程度. 我们的研究结果与用丹参治疗肝纤维化大鼠, 对MMP-13、TIMP-1mRNA表达的影响结果类似[11]. 这可能是地龙2号中含有蚯蚓胶原酶, 可以直接降解ECM, 并促进MMP-13基因的表达; 另一方面, 纤溶酶能有效激活MMP-1和MMP-3, 地龙2号中含有蚯蚓纤溶酶, 后者很可能也能促进MMP-13 mRNA基因的表达, 从而降解增生的ECM. 免疫组化实验表明: TIMP-1在模型组于纤维间隔、中央静脉周围、肝窦处的间质细胞胞质可见大量棕黄色着色, MMP-13于上述部位亦可见少量表达, 应用地龙2号后, TIMP-1的表达明显减轻, 而MMP-13的表达则显著升高. 因而, 地龙2号可以从基因和蛋白水平降低TIMP-1、提高MMP-13的表达, 从而促进过多的ECM降解, 减轻肝纤维化的程度.
TGF-β1由活化的肝脏星状细胞(HSC)分泌, 为现知最强的肝纤维化促进因子[12-15], 是启动和调控胶原代谢的主要因子, TGF-β1具有抑制肝细胞增生、诱导肝细胞凋亡, 反馈激活HSC、促进其产生ECM、减少ECM降解的作用[16]. 本实验中, 我们发现地龙2号组大鼠肝组织TGF-β1基因和蛋白表达均较模型组和阳性对照组明显降低, 而且我们同时的研究发现地龙2号组a-SMA蛋白表达较模型组显著降低[17], 而a-SMA为HSC活化的标志[18-19], 所以我们认为, 地龙2号通过抑制HSC的活化, 降低TGF-β1的表达, 也是其发挥抗肝纤维化作用的可能机制之一. 有文献[20]曾提到纤溶酶激活TGF-β1并加深肝纤维化, 这与我们的实验结果相反. 我们发现地龙2号组大鼠肝组织TGF-β1的基因和蛋白表达均较模型组和阳性对照组明显降低. 故我们推测, 由于地龙2号抑制了HSC的激活HSC受抑, 使得TGF-β1释放减少, 致纤维化因子释放减少, 且激活的HSC凋亡亦可提高MMP-13并降低TIMP-1 mRNA的表达[21]; 另一方面, 亦有可能是地龙2号降解ECM的作用大于TGF-β1致纤维化的作用, 因而使肝纤维化程度减轻.
由于地龙2号含有多种有效成分, 何种成分可以抑制HSC的激活, 在本研究中尚未得知, 有待今后更加深入研究.
| 1. | Ip E, Farrell G, Hall P, Robertson G, Leclercq I. Administration of the potent PPARalpha agonist, Wy-14,643, reverses nutritional fibrosis and steatohepatitis in mice. Hepatology. 2004;39:1286-1296. [PubMed] [DOI] |
| 2. | Goldshmidt O, Yeikilis R, Mawasi N, Paizi M, Gan N, Ilan N, Pappo O, Vlodavsky I, Spira G. Heparanase expression during normal liver development and following partial hepatectomy. J Pathol. 2004;203:594-602. [PubMed] [DOI] |
| 3. | 陆 亚琴, 刘 顺英, 陈 洪, 张 治国, 赵 成桂. 地龙2号抑制大鼠肝纤维化的研究. 胃肠病学和肝病学杂志. 2004;13:225-227. |
| 5. | Arthur MJ. Matrix degradation in liver: a role in injury and repair. Hepatology. 1997;26:1069-1071. [PubMed] [DOI] |
| 6. | Watanabe T, Niioka M, Hozawa S, Kameyama K, Hayashi T, Arai M, Ishikawa A, Maruyama K, Okazaki I. Gene expression of interstitial collagenase in both progressive and recovery phase of rat liver fibrosis induced by carbon tetrachloride. J Hepatol. 2000;33:224-235. [PubMed] [DOI] |
| 7. | Bennett RG, Kharbanda KK, Tuma DJ. Inhibition of markers of hepatic stellate cell activation by the hormone relaxin. Biochem Pharmacol. 2003;66:867-874. [PubMed] [DOI] |
| 8. | Hironaka K, Sakaida I, Matsumura Y, Kaino S, Miyamoto K, Okita K. Enhanced interstitial collagenase (matrix metalloproteinase-13) production of Kupffer cell by gadolinium chloride prevents pig serum-induced rat liver fibrosis. Biochem Biophys Res Commun. 2000;267:290-295. [PubMed] [DOI] |
| 10. | Iredale JP, Goddard S, Murphy G, Benyon RC, Arthur MJ. Tissue inhibitor of metalloproteinase-I and interstitial collagenase expression in autoimmune chronic active hepatitis and activated human hepatic lipocytes. Clin Sci (Lond). 1995;89:75-81. [PubMed] [DOI] |
| 11. | Wasser S, Ho JM, Ang HK, Tan CE. Salvia miltiorrhiza reduces experimentally-induced hepatic fibrosis in rats. J Hepatol. 1998;29:760-771. [PubMed] [DOI] |
| 12. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 13. | Xu JW, Gong J, Feng XL, Chang XM, Luo JY, Dong L, Jia A, Xu GD. Effects of estradiol on type I, III collagens and TGF-β1 in hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi. 2003;11:1185-1188. |
| 14. | Williams EJ, Gaça MD, Brigstock DR, Arthur MJ, Benyon RC. Increased expression of connective tissue growth factor in fibrotic human liver and in activated hepatic stellate cells. J Hepatol. 2000;32:754-761. [PubMed] [DOI] |
| 16. | Sprenger H, Kaufmann A, Garn H, Lahme B, Gemsa D, Gressner AM. Induction of neutrophil-attracting chemokines in transforming rat hepatic stellate cells. Gastroenterology. 1997;113:277-285. [PubMed] [DOI] |
| 17. | 陈 洪, 陆 亚琴, 刘 顺英, 张 治国, 陈 平圣. 地龙2号对大鼠肝纤维化TGF-β1,MMP-13及TIMP-1 mRNA和蛋白表达的影响. 世界华人消化杂志. 2004;12:2333-2337. [DOI] |
| 18. | Guo SG, Zhang W, Jiang T, Dai M, Zhang LF, Meng YC, Zhao LY, Niu JZ. Influence of serum collected from rat perfused with compound Biejiaruangan drug on hepatic stellate cells. World J Gastroenterol. 2004;10:1487-1494. [PubMed] [DOI] |
| 19. | Liu QH, Li DG, Huang X, Zong CH, Xu QF, Lu HM. Suppressive effects of 17beta-estradiol on hepatic fibrosis in CCl4-induced rat model. World J Gastroenterol. 2004;10:1315-1320. [PubMed] |
| 20. | Okuno M, Akita K, Moriwaki H, Kawada N, Ikeda K, Kaneda K, Suzuki Y, Kojima S. Prevention of rat hepatic fibrosis by the protease inhibitor, camostat mesilate, via reduced generation of active TGF-beta. Gastroenterology. 2001;120:1784-1800. [PubMed] [DOI] |
| 21. | Yuan GJ, Zhang ML, Gong ZJ. Effects of PPARg agonist pioglitazone on rat hepatic fibrosis. World J Gastroenterol. 2004;10:1047-1051. [PubMed] |