修回日期: 2004-07-01
接受日期: 2004-07-11
在线出版日期: 2004-10-15
目的: 应用半定量RT-PCR方法检测dynamin II 基因在大肠侧向发育型肿瘤细胞株同SW480细胞株及 Lovo细胞株之间的差异表达.
方法: 以三种肠癌细胞株为标本, 分别提取总RNA, 逆转录合成 cDNA, 选择加入的模板量及循环数, 优化PCR反应条件, 确定适宜的反应体系, 凝胶图像分析结果.
结果: 在大肠侧向发育型肿瘤细胞株同普通隆起型肠癌细胞株之间存在着dynamin II基因的差异表达.
结论: 半定量RT-PCR方法具有简单, 方便, 经济的特点, 通过该方法, 我们发现在大肠侧向发育型肿瘤癌细胞株同SW480细胞株及Lovo 细胞株之间存在dynamin II基因的差异表达, 此结果同我们基因芯片的筛选结果一致, 结合dynamin II基因的功能, 我们推测该基因可能在LST的形态学或癌变机制中发挥一定作用.
引文著录: 王新颖, 李恕军, 赖卓胜, 马文敏, 狄焱, 姜泊. 肠癌细胞株dynamin II的差异表达. 世界华人消化杂志 2004; 12(10): 2299-2301
Revised: July 1, 2004
Accepted: July 11, 2004
Published online: October 15, 2004
AIM: To detect different expressions of dynamin II between laterally spreading tumor (LST) and SW480 cell line as well as between LST and Lovo cell line.
METHODS: Different expressions were detected using semiquantitative polymerase chain reaction (PCR) method. Extraction of total RNA from LST, SW480 and Lovo cell lines, respectively, was performed to synthesize cDNA through reverse transcription. The conditions of PCR were optimized, including annealing temperature, cycle parameters and amount of template. UVI imaging was used to detect the PCR products.
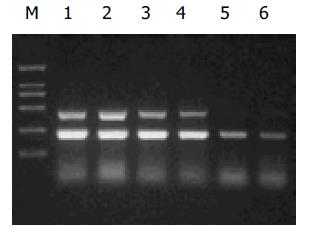
RESULTS: Dynamin II and amplificated segment of beta-actin were 475 bp and 239 bp respectively. The expression of dynamin II in colorectal LST cell line was twifold higher than that in both SW480 and Lovo cell lines. The genetic sequence we gained from targeted gene was the same as the sequence of L36983 and BC016045 in GeneBank.
CONCLUSION: Dynamin II is differently expressed in LST cell line compared with SW480 and Lovo cell lines. It may play an important role in the morphology and cancerogenesis of the tumor.
- Citation: Wang XY, Li SJ, Lai ZS, Ma WM, Geng Y, Jiang B. Different expressions of dynamin II between colorectal cancer cell lines. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2299-2301
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2299.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2299
定量检测基因表达水平常用Northern 印迹等方法, 但常有同位素污染, 样品用量大及敏感性低的缺点. 因此我们根据逆转录-多聚酶链反应的产量同RNA模板量及循环次数正相关的原理, 采用半定量RT-PCR (semiquantitative polymerase chain reaction)方法检测dynamin II基因在大肠侧向发育型肿瘤癌细胞株同SW480细胞株及 Lovo细胞株之间的差异表达.
大肠侧向发育型肿瘤(laterally spreading tumor, LST)癌细胞株由我科建株并保存, SW480购自武汉中国细胞培养物保藏中心; lovo细胞株为我科保存. TRIZOL为Gibco公司产品, RevertAidTM H Minus M-MuLV, dNTPs mix , 随机引物, Ribonuclease inhibitor 购自MBI公司, PCR反应体系购自北京赛百盛基因技术有限公司. dynamin II和beta-actin 基因引物分别参照基因文库L36983及BC016045序列自行设计, 由上海博亚基因技术有限公司合成, 序列如下: dynamin2: F1 5'-GCCGAGTCACTGTCCTGG TA-3', R1 5' GGTCTGCCGAGGAGTATAGGT-3', beta-actin: F2 5'-ACGTTGCTA TCCAGGCTGTG-3', R2 5'- AATGTCACGCACGATCGATTCC-3', 3K30高速低温离心机(Sigma公司), UNO II PCR扩增仪(Biometra 公司), UVI凝胶成像系统.
传代培养的LST癌细胞株、SW480细胞株及Lovo细胞株各一培养瓶(约1×107/L), 冰预冷的PBS液冲洗培养瓶3遍, 加入Trizol 1mL, 吹打细胞, 室温静置10 min, 按Trizol说明书操作, 提取3种细胞总RNA, 电泳分析其完整性, 测纯度, 定量. 按逆转录酶试剂操作说明合成cDNA. 目的基因与内参基因采用同管扩增, 参照标准PCR反应体系(94 ℃预变性2.5 min, 94 ℃变性45 s, 50 ℃退火1 min, 72 ℃延伸1.5 min, 共同30个循环, 72 ℃延伸5 min, 4 ℃终止反应), 分别优化退火温度、循环参数, 建立适宜的半定量PCR反应体系. 改变RNA模板量, 确定指数扩增范围. 选择最适条件后, 3株细胞株的对比实验重复3次. 将PCR产物用1*TAE缓冲液配制1.5 %琼脂糖进行水平板电泳, 电压60V, 电泳45 min, 在紫外灯下观察电泳结果, UVI凝胶成像系统分析. PCR产物测序.
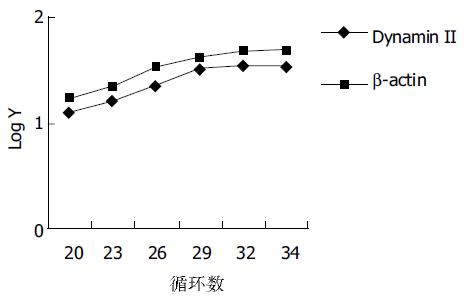
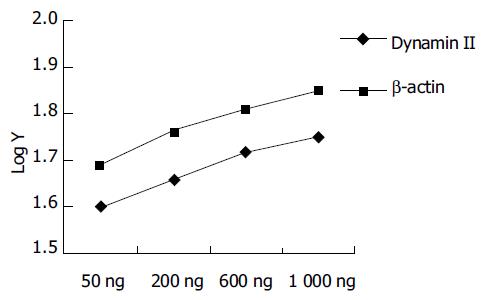
目的基因dynamin II和内参beta-actin PCR条件的优化. 采用同管扩增, 在一般反应环境不变条件下, 分别改变循环次数为20, 23, 26, 29, 32, 34; 退火温度为48, 50, 51, 53 ℃. 选出目的基因dynamin II和内参beta-actin均在直线增加阶段的条件是: 50 ul反应体积中含dNTP 0.2 mmol/L, Taq DNA聚合酶2U, dynamin2 和beta-actin的上下游引物均为40 pmmol, Mg2+ 2.0 mmol/L, cDNA 2 ul, 循环次数28次, 退火温度51 ℃ (图1). dynamin II半定量PCR循环参数的选择. (图2) dynamin II相对表达量随着循环次数的增加而增加, 在20个至32个循环之间的相对表达量为线性范围, 我们选择28个循环. 分别选RNA模板量为50 , 200, 600 , 1 000 ng呈良好线性关系, 选取600 ng做为模板量(图3). 琼脂糖凝胶电泳显示dynamin II和beta-actin扩增片段分别为475 bp和239 bp(图1). 凝胶图像分析显示dynamin II基因在大肠侧向发育型肿瘤癌细胞株中的表达高于其他两株细胞, 实验重复三次结果相同(图 4). 对目的基因PCR产物分析为475个碱基片段, 内参基因为239个碱基片段, 所获得的片段序列与Genebank中L36983及BC016045序列一致.
半定量RT-PCR[1]具有灵敏度高、所需样品量少、无同位素污染和快速等优点. 尽管他不能像实时定量RT-PCR和竞争性RT-PCR能对mRNA进行真正准确定量[2-3], 但由于其操作简便、耗费较低, 因而在临床及定量研究上仍不失为一种较好的方法[4-5]. 通常认为半定量RT-PCR的RT的效率是恒定的, 而PCR这一步中扩增片段是在PCR的第3个循环出现, 此后扩增产物呈指数增长, 即处于指数增长期, 若各实验组在相同循环数下, 扩增效率相同, 则扩增后的目的基因拷贝数与内参拷贝数的比值直接反映了他们起始拷贝数的比值. 这即是半定量RT-PCR方法的理论基础[6]. 在本文中我们即采用这种方法, 对我科所建立的大肠侧向发育型肿瘤(laterally spreading tumor, LST)癌细胞株进行了基因表达方面的研究, 检测其与普通肠癌细胞株 dynamin II基因的差异表达.
大肠侧向发育型肿瘤为一种新的类型的肠道肿瘤, 其病变形态和发生发展上有一定的特殊性, 呈侧向生长, 具恶变潜能, 有证据表明LST与大肠癌的发生有关[7-8]. 然而, 从LST概念的提出至今, 对该肿瘤的研究还停留在临床的内镜下诊断及治疗方面[9-12]. 有关LST病变与大肠癌发生的关系和确切机制及相关基因变化的研究, 现仅日本有流行病学及临床病理学的研究, 在分子水平上仅有与K-ras, APC, COX-2, p53等基因及细胞凋亡关系的初步研究[13-15]. 而我国LST病变的研究尚属空白, 但LST在我国的检出率并不低, 对此我科已有相关研究并且成功培养一株LST癌细胞株[16-17]. 由于其特殊的形态学表现且与大肠癌发生有关, 故从其形态学的异质性着手开展相关研究, 有可能对大肠癌的发生发展过程提供极有价值的资料及线索并在分子水平上找到早期诊断的可靠依据.
dynamin 基因分I, II, III三类, 为GTPase家族成员. 在哺乳动物中以前二者研究较多, 其中dynamin I主要在脑中表达, 而dynamin II(发动蛋白2)是GTPase家族成员之一, 普遍表达于各种组织中, 在心脏和骨骼肌中呈高表达. 其具五个独特的蛋白域, 包括: N末端GTP结合位点, 中间未知功能区(middle unknown domain), PH域(a pleckstrin-homology domain), GTPase活性位点(GED), C末端脯氨酸富集区(PRD)[18]. dynamin I和II的N末端具高度同源性, 由于C末端的不同而具有不同的功能. dynamin II最早发现其参与细胞内吞和分泌过程初期囊泡的形成, 继而研究表明其PRD区与cortactin蛋白等的SH3结合域相互作用而参与细胞的迁移、内吞、分泌过程及细胞形状的维持. 近年来有人发现其具有促进细胞外基质降解作用及做为信号转导GTPase而影响转录调节, 激活p53而诱导凋亡, 故考虑其可能在肿瘤的发生中起到一定甚至重要作用而日益受到重视[19-23].
我们研究的结果表明dynamin II基因在LST癌细胞株中的表达高于其他两株细胞株, 这与之前我们基因芯片的筛选结果是一致的. 故我们设想dynamin II基因可能在LST特殊的形态学表现及癌变机制中发挥一定甚至关键作用. 故我们将对其做进一步的研究, 以期发现新的肿瘤相关基因.
| 1. | Chelly J, Kaplan JC, Maire P, Gautron S, Kahn A. Transcription of the dystrophin gene in human muscle and non-muscle tissue. Nature. 1988;333:858-860. [PubMed] [DOI] |
| 6. | Halford WP. The essential prerequisites for quantitative RT-PCR. Nat Biotechnol. 1999;17:835. [PubMed] [DOI] |
| 7. | Ohno Y, Terai T, Ogihara T, Hirai S, Miwa H. Laterally spreading tumor: clinicopathological study in comparison with the depressed type of colorectal tumor. J Gastroenterol Hepatol. 2001;16:770-776. [PubMed] [DOI] |
| 8. | Tanaka S, Haruma K, Oka S, Takahashi R, Kunihiro M, Kitadai Y, Yoshihara M, Shimamoto F, Chayama K. Clinicopathologic features and endoscopic treatment of superficially spreading colorectal neoplasms larger than 20 mm. Gastrointest Endosc. 2001;54:62-66. [PubMed] [DOI] |
| 9. | Nakagoe T, Ishikawa H, Sawai T, Tsuji T, Jibiki M, Nanashima A, Yamaguchi H, Yasutake T. Gasless, video endoscopic transanal excision for carcinoid and laterally spreading tumors of the rectum. Surg Endosc. 2003;17:1298-1304. [PubMed] [DOI] |
| 10. | Tamura S, Nakajo K, Yokoyama Y, Ohkawauchi K, Yamada T, Higashidani Y, Miyamoto T, Ueta H, Onishi S. Evaluation of endoscopic mucosal resection for laterally spreading rectal tumors. Endoscopy. 2004;36:306-312. [PubMed] [DOI] |
| 11. | Nakagoe T, Sawai T, Tsuji T, Tanaka K, Shibasaki S, Hidaka S, Nanashima A, Yamaguchi H, Yasutake T. Minilaparotomy approach for the resection of laterally spreading tumors of the colon. Surg Today. 2004;34:737-741. [PubMed] [DOI] |
| 12. | Jiang B, Zhi FC, Liu SD, Han YJ, Pan DS, Zhou D, Wan TM, Zhou DY. [Pit pattern and endoscopic mucosal resection in diagnosis and treatment of colorectal tumors]. Zhonghua Yixue Zazhi. 2003;83:294-297. [PubMed] |
| 13. | Yamada H, Hasegawa H, Iino H, Eguchi H, Fujii H, Matsumoto Y. Evaluation of apoptosis as a factor affecting the growth of non-polypoid colorectal adenomas. J Int Med Res. 2001;29:516-522. [PubMed] [DOI] |
| 14. | Yamashita K, Arimura Y, Shimizu H, Takahashi H, Endo T, Imai K, Yamano H. Increased cyclooxygenase-2 expression in large flat colorectal tumors (laterally spreading tumors). J Gastroenterol. 2003;38:69-73. [PubMed] [DOI] |
| 15. | Noro A, Sugai T, Habano W, Nakamura S. Analysis of Ki-ras and p53 gene mutations in laterally spreading tumors of the colorectum. Pathol Int. 2003;53:828-836. [PubMed] [DOI] |
| 16. | Han YJ, Lai ZS, Wang YD, Jiang B, Zhou ZT, Zhou DY. [Electron microscopic observation of primary cultured laterally spreading tumor cell line]. Diyi Junyi Daxue Xuebao. 2004;24:79-80, 84. [PubMed] |
| 17. | Jiang B, Liu SD, Zhi FC, Pan DS, Zhou D, Wan TM, Zhou DY. [The diagnosis and treatment of 25 cases of laterally spreading tumor of the large intestine]. Diyi Junyi Daxue Xuebao. 2002;22:189-191. [PubMed] |
| 18. | van der Bliek AM. Functional diversity in the dynamin family. Trends Cell Biol. 1999;9:96-102. [PubMed] [DOI] |
| 19. | Thompson HM, Cao H, Chen J, Euteneuer U, McNiven MA. Dynamin 2 binds gamma-tubulin and participates in centrosome cohesion. Nat Cell Biol. 2004;6:335-342. [PubMed] [DOI] |
| 20. | Cao S, Yao J, Shah V. The proline-rich domain of dynamin-2 is responsible for dynamin-dependent in vitro potentiation of endothelial nitric-oxide synthase activity via selective effects on reductase domain function. J Biol Chem. 2003;278:5894-5901. [PubMed] [DOI] |
| 21. | Zhang Z, DuBois RN. Detection of differentially expressed genes in human colon carcinoma cells treated with a selective COX-2 inhibitor. Oncogene. 2001;20:4450-4456. [PubMed] [DOI] |
| 22. | Baldassarre M, Pompeo A, Beznoussenko G, Castaldi C, Cortellino S, McNiven MA, Luini A, Buccione R. Dynamin participates in focal extracellular matrix degradation by invasive cells. Mol Biol Cell. 2003;14:1074-1084. [PubMed] [DOI] |
| 23. | Schlunck G, Damke H, Kiosses WB, Rusk N, Symons MH, Waterman-Storer CM, Schmid SL, Schwartz MA. Modulation of Rac localization and function by dynamin. Mol Biol Cell. 2004;15:256-267. [PubMed] [DOI] |