修回日期: 2004-07-09
接受日期: 2004-07-22
在线出版日期: 2004-10-15
目的: 探讨全反式维甲酸联合奥曲肽对肝癌细胞HepG2增生和凋亡的作用.
方法: 将不同剂量的全反式维甲酸和奥曲肽(1 mg/L)直接作用于体外培养的人肝母细胞瘤株HepG2, 用MTT比色法分析两种药物联合作用对肝癌细胞生长的影响, 流式细胞仪检测细胞凋亡率, 细胞周期分布, 免疫细胞化学方法检测抑癌基因P21WAF1/CIP1的表达, 台盼兰染色观察药物对细胞毒性作用.
结果: 小剂量全反式维甲酸(10-6 mmol/L)和奥曲肽(1 mg/L)连用后, 对细胞具有增生抑制作用, 与无增生抑制的奥曲肽作用组和对照组相比有显著性差异(P = 0.0 087 P <0.01). 细胞免疫化学: 全反式维甲酸和奥曲肽药物联合作用48 h后, 细胞中目的基因P21WAF1/CIP1由胞膜, 胞质微弱表达转为核强烈表达. 于作用48 h后药物合用组对细胞各周期均有影响, 奥曲肽作用组可使肝癌细胞HepG2阻滞于S期, 且药物合用组于作用72 h后, 凋亡率为17%, 明显高于奥曲肽作用组与对照组. 台盼兰染色未发现大片死亡细胞.
结论: 小剂量全反式维甲酸(10-6 mmol/L) 联合生长抑素类似物奥曲肽(1 mg/L)对肝癌细胞HepG2具有增生抑制和诱导凋亡作用.抑癌基因表达增强说明二者的诱导凋亡和增生抑制作用可能是通过增强抑癌基因P21WAF1/CIP1的表达实现的. 从而为在临床上治疗肝癌提供了新的思路.
引文著录: 叶红, 但自力, 唐望先. 全反式维甲酸联合奥曲肽对肝癌细胞-HepG2增生和凋亡的影响. 世界华人消化杂志 2004; 12(10): 2295-2298
Revised: July 9, 2004
Accepted: July 22, 2004
Published online: October 15, 2004
AIM: To investigate the effects of all-trans retinoic acid combined with octreotide on proliferation and apoptosis of human liver cancer cell HepG2.
METHODS: The human liver cancer cell HepG2 cultured in vitro was designed into three groups: combined group, octreotide group and control group. For combined group, HepG2 was treated with different concentrations of all-trans retinoic acid (1×10-6, 5×10-6, 5×10-5 mmol/L) associated with octreotide (1 mg/L). MTT assays were adopted to determine their effects on cell growth. Cell apoptotic rate and cell cycle were detected by flow cytometry. The expression of tumor supressing gene p21WAF1/CIP1 was detected by immunocytochemical methods. Cytoxicity of the two drugs was observed with typan blue staining.
RESULTS: After being treated with the concentration of 1×10-6mmol/L of all-trans retinoic acid and 1mg/L of octreotide, cells'viability was significantly inhibited compared with the octreotide group and controls (P = 0.0087<0.01). No significant difference existed between octreotide group and control group. The expression of the target gene p21WAF1/CIP1 was significantly increased after associated application of all-trans retinoic acid with octreotide. Apoptosis rate of liver cancer cells (17%) in combined group was also significantly higher than those in octreotide and control group. No death of great numbers was observed with typan blue staining.
CONCLUSION: Proliferation of liver cancer cell HepG2 is inhibited by combination of low concentration of all-trans retinoic acid (1×10-6 mmol/L) with octreotide (1 mg/L) while apoptosis is induced. Meanwhile, different periods of cell cycle were also influenced. The effect of the two drugs on proliferating inhibition and apoptotic facilitation may be achieved by increasing the expression of gene p21WAF1/CIP1.
- Citation: Ye H, Dan ZL, Tang WX. Effects of all-trans retinoic acid with octreotide on proliferation and apoptosis of hepatoma cell HepG2. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2295-2298
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2295.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2295
近年来, 全反式维甲酸和生长抑素类似物奥曲肽由于其生长抑制和诱导凋亡作用日益受到人们重视[1]. 全反式维甲酸在治疗白血病方面疗效显著[2], 而奥曲肽也已应用于临床胃肠肿瘤的治疗[3-5]. 但是二者单独作用诱导凋亡作用皆较弱, 皆需要和其他化疗药物连用[6-8]. 如果两种较弱的诱导凋亡药物合用, 能具有较好的肿瘤抑制作用, 可大大降低肿瘤治疗的毒副作用. 目前, 此两种药物合用在国内外罕有报道, 我们探讨小剂量全反式维甲酸[1-2]和奥曲肽[9]连用后, 是否具有抑制体外肝癌细胞株增生及诱导凋亡作用.
奥曲肽(octreotide 瑞士诺华制药公司), 全反式维甲酸(无水乙醇配制成10-2 mmol/L)储存液, 无血清培养基稀释成10-4 mmol/L工作液, 塞唑蓝(MTT)及二甲基亚砜(DMSO Amresco公司), 胎牛血清(三利公司), DMEM(高糖Gibco公司), P21WAF1/CIP1抗体(美国 Neo Marker 公司), SP试剂盒(北京中山生物技术有限公司), 96孔, 6孔培养板(Costor, Greiner公司), 酶联检测酶标仪(Fortune Multiscan EX), 光学相差显微镜(日本 Olympus公司), 碘化吡啶, 台盼兰, RNA酶A(Sigma公司)FacSort (Becton Dikinson公司), 人HepG2肝母细胞瘤株由同济医学院临床免疫教研室和协和医院普外研究所惠赠, 于含50 mL/L血清的DMEM高糖培养基中, 37 ℃, 5 mL/L CO2条件下培养. 每2, 3 d传代, 取对数生长期细胞实验.
细胞胰酶消化, 成8×107/L单细胞悬液0.1 mL/孔种于96孔板, 每组8个复孔, 共8组, 于含5 mL/L胎牛血清的DMEM高糖培养基中培养24 h贴壁后, D-Hanks液洗两遍, 试验组培养基中加不同剂量药物(全反式维甲酸先加入, 4 h后加入奥曲肽)使得全反式维甲酸终浓度为10-6, 5×10-6, 10-5 mmol/L, 奥曲肽为1 mg/L. 对照组加不含药物等量培养基. 药物作用24 h后, 于每孔中加入5 g/L MTT 20 mL, 培养箱中继续培养4 h, 弃上清, 加入DMSO 100 mL, 震荡10 min, 结晶物充分溶解后, 酶联检测仪上492 nm波长, 测定各孔吸光度A值. 计算细胞增生抑制率=(1-试验组吸光度A值/对照组吸光度A值)%. 细胞胰酶消化, 成3×107/L单细胞悬液0.1 mL/孔种于96孔板, 每次同时接种3块, 50 mL/L胎牛血清的DMEM高糖培养基中培养24 h贴壁后, 各个试验组换液, 培养基中加不同剂量药物, 对照组加不含药物等量培养基. 分别培养24, 48, 72 h. 于492 nm波长处在酶联检测仪上测定不同浓度药物的吸光度A值, 并根据吸光度A值绘制药物作用下的生长曲线. 4×105等量细胞接种于100 mL培养瓶, 50 mL/L胎牛血清培养基培养24 h之后, D-Hanks液洗2遍, 每瓶加入培养基4 mL, 试验组加入相应药物, 对照组只加等量培养基. 分别培养24, 48, 72 h后, 消化后0.1 mol/L PBS 4 mL(4 ℃)中止, 吹打成单细胞悬液, 收集上清及洗液, 连同消化细胞一并离心(1 000 r/min ×5 min), 750 mL/L乙醇3 mL固定, -20 ℃储存备用. 等量细胞种于六孔培养板玻片(0.1g/L多聚赖氨酸处理, 高温灭菌)上, 1×105/ 孔, 24 h细胞贴壁后, D-Hanks液洗, 每孔加入培养基2 mL, 试验组加入相应药物, 对照组只加等量培养基. 分别培养24, 48, 72 h后, 取出细胞, 0.01 mol/LPBS洗, 2 min×2次, 40 g/L多聚甲醛固定30 min, 7.5 mL/L H2O2 37 ℃封闭30 min, 正常羊血清封闭37 ℃ 30 min, 一抗4 ℃过夜18 h, 二抗37 ℃ 30 min, 三抗37 ℃ 30 min, DAB显色, 自来水终止, 脱水, 中性树脂封片. 另台盼兰染色.
统计学处理 增生抑制率采用方差分析mean±SD, Stata 8.2 , 生长曲线采用t检验.
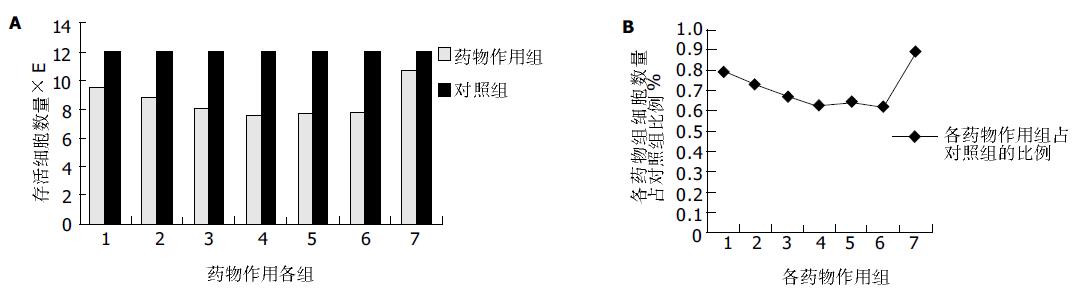
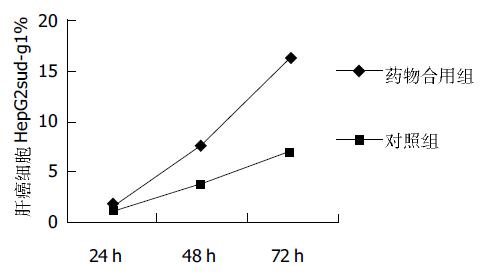
全反式维甲酸10-6 mmol/L、5×10-6mmol/L和 10-5mmol/L的抑制率为0%, 27.3%和33.5%; 如分别加入奥曲肽, 则抑制率为35.5%, 27.1%和37.1%;而单用奥曲肽和对照组增生抑制率皆为0%, 1 mg/L的奥曲肽对肿瘤细胞无增生抑制作用. 做方差分析, 药物合用3组之间没有显著性差异. 此3组与对照组有显著性差异. 奥曲肽组与药物合用组(全反式维甲酸先作用4 h)有显著性差异(P = 0.0 087, P <0.01), 与对照组没有显著性差异. 药物合用组与奥曲肽组的抑制率差别各组之间无明显变化. 三组的结果皆为全反式维甲酸的抑制效应随剂量增加而增加. 而药物合用组的增生抑制效应并不随全反式维甲酸的剂量变化而变化(图1). 生长曲线可以看出, 随着时间的延长, 合用药组与奥曲肽组的细胞数量差距增大, 奥曲肽作用组细胞数量多于合用药组, 反映在吸光度A值上, 即吸光度随着时间延长而增加, 合用药组作用随时间延长而增加. 流式结果分析采用Modifit LT软件处理系统. 采用PI染色, 合用药组72 h之后, 细胞凋亡率与对照组及奥曲肽组相比出现显著性差异, 为17%左右, 说明合用药组的作用是随着时间的延长而增强的. 72 h的作用效果强于24 h(图2). 细胞周期, 用药奥曲肽单用72 h后, 细胞凋亡率虽仍无明显增加, 周期S期自48 h起却已开始升高. 奥曲肽在HepG2肝母细胞瘤中可能是通过S期阻滞实现其作用的. 合用药组的各个细胞周期都有影响. 台盼兰染色后, 未发现大片死亡细胞, 各组之间结果无显著差异. 说明全反式维甲酸和奥曲肽导致细胞增生抑制不是依赖其毒性作用.
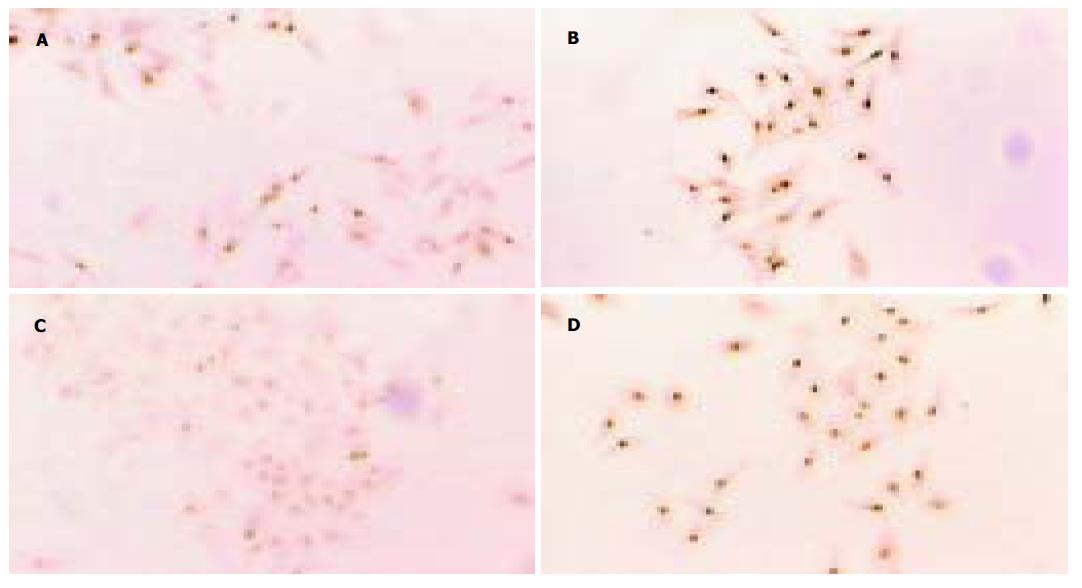
抑癌基因p21WAFI/CIP1在药物作用的细胞上表达强烈. 在无药物作用的各时间对照组中表达微弱, 以核, 膜表达为主, 但在药物作用后的细胞爬片上, 核表达增加明显, 膜表达微弱增加(图3).
全反式维甲酸由于其诱导分化引起细胞凋亡作用逐渐受到人们重视, 作为一种弱诱导凋亡剂, 人们将其与其他药物联合作用治疗肿瘤是一个很好的临床选择[10-11]. 奥曲肽对HepG2的作用, 可能是通过此种细胞上的生长抑素受体SSTR实现的[12-17], 而全反式维甲酸在肝癌细胞中的作用途径则不是十分明确[18-26], 全反式维甲酸可降低肝癌细胞对生长因子的反应能力. 在此方面, 可能与奥曲肽有相加作用. 全反式维甲酸10-6 mmol/L可激活奥曲肽(1 mg/L)的作用通道, 剂量再增加, 无明显效果. 在72 h生长曲线图形中可以看到, 随着药物作用时间的延长, 奥曲肽组和全反式维甲酸组两组间细胞数量差异日益显著. 说明两种药物合用, 效果具有时间依赖性. 抑癌基因p21WAFI/CIP1可以结合cyclin/cdk周期素复合物, 抑制周期素酶的活性, 从而阻止细胞周期进程, 并且还可以和增生细胞核抗原(PCNA)结合形成复合物, 抑制DNA的复制[27-28]. 在免疫组化中, 随着药物作用, 抑癌基因p21WAFI/CIP1在细胞核内表达有着明显的增强, 这说明在其合用的过程中, 共同作用的结果之一是使得核抑癌基因p21WAFI/CIP1增加, 来实现其肿瘤抑制作用. 这与国内杂志上抑癌基因 p21WAFI/CIP1主要在细胞膜, 胞质表达也有所不同[29].流式结果表明奥曲肽在48 h出现S期阻滞, 在48 h奥曲肽作用的细胞爬片上, p21WAFI/CIP1数量也略有增加, 但对比不甚明显, 在细胞全部表达且同一爬片有强有弱的情况下, 无法判断是否具有显著差异. 而有全反式维甲酸存在的合用药组, p21WAFI/CIP1表达普遍强烈增加, 可能是药物共同作用, 使得核表达大大加强. 但是尚不能肯定合用组p21WAFI/CIP1表达随时间延长而增加, 但是却可以得出随着用药时间延长, 各用药组与对照组之间的表达差异日趋强烈的结论. 流式测量结果证明, 药物合用对细胞的各个周期都有影响, 并随作用时间延长, sub-G1期细胞增多, 而凋亡率于72 h始出现显著性差异, 说明两药合用效果具有时间依赖性. 而奥曲肽对细胞影响是通过S期阻滞实现的, 这与以前的奥曲肽作用肝癌细胞如SMMC-7721、BEL-7402[30-31], 而使G0/G1期阻滞有所不同. 可能与不同细胞上受体表达不一致有关. 在24 h的药物作用后, 台盼兰染色发现, 各组并无明显的死亡细胞, 各组的存活率在93%以上, 且无显著性差异, 说明全反式维甲酸和奥曲肽导致肿瘤细胞增生抑制, 导致细胞凋亡, 并不是由于其毒性所致.
本实验证明了全反式维甲酸和奥曲肽联合应用有更强的抗肿瘤作用, 小剂量的全反式维甲酸可以增强奥曲肽的肿瘤增生抑制和诱导凋亡的作用, 他可能增强了奥曲肽的某种作用通道, 并且这种通道的数量可能是有限的, 且合用结果使得肿瘤细胞的各个周期都有所变化, 说明两种药物作用于不同阶段, 全反式维甲酸使得细胞停滞于G0/G1期, 而奥曲肽则作用于细胞的S期. 除了两种药物本身的作用途径之外, 维甲酸也可能重新激活奥曲肽另外的通道来发挥作用, 且这种通道的作用掩盖了全反式维甲酸本身的作用, 但二者的确切作用机制尚需要进一步研究. 我们是否可以借用小剂量的全反式维甲酸, 在临床上消化道肿瘤与肝硬化患者需要用奥曲肽之类的生长抑素制剂时辅助应用, 从而达到事半功倍的效果, 尚有待我们探索.
| 4. | Gao S, Yu BP, Li Y, Dong WG, Luo HS. Antiproliferative effect of octreotide on gastric cancer cells mediated by inhibition of Akt/PKB and telomerase. World J Gastroenterol. 2003;9:2362-2365. [PubMed] [DOI] |
| 5. | Wang CH, Tang CW, Liu CL, Tang LP. Inhibitory effect of octreotide on gastric cancer growth via MAPK pathway. World J Gastroenterol. 2003;9:1904-1908. [PubMed] [DOI] |
| 8. | Tang C, Wang C, Tang L. Effects of combined octreotide and aspirin on the growth of gastric cancer. Chin Med J (Engl). 2003;116:373-377. [PubMed] |
| 10. | Piao YF, Shi Y, Gao PJ. Inhibitory effect of all-trans retinoic acid on human hepatocellular carcinoma cell proliferation. World J Gastroenterol. 2003;9:2117-2120. [PubMed] [DOI] |
| 11. | Chen Y, Wu Q, Chen Z, Chen F, Su W. Effect of all-trans retinoic acid on growth of xenograft tumor and its metastasis in nude mice. Chin Med J (Engl). 2000;113:345-349. [PubMed] |
| 12. | Jia WD, Xu GL, Sun HC, Wang L, Xu RN, Xue Q. Effect of octreotide on angiogenesis induced by hepatocellular carcinoma in vivo. Hepatobiliary Pancreat Dis Int. 2003;2:404-409. [PubMed] |
| 13. | Mearadji A, Breeman W, Hofland L, van Koetsveld P, Marquet R, Jeekel J, Krenning E, van Eijck C. Somatostatin receptor gene therapy combined with targeted therapy with radiolabeled octreotide: a new treatment for liver metastases. Ann Surg. 2002;236:722-8; discussion 728-9. [PubMed] [DOI] |
| 14. | Jia WD, Xu GL, Xu RN, Sun HC, Wang L, Yu JH, Wang J, Li JS, Zhai ZM, Xue Q. Octreotide acts as an antitumor angiogenesis compound and suppresses tumor growth in nude mice bearing human hepatocellular carcinoma xenografts. J Cancer Res Clin Oncol. 2003;129:327-334. [PubMed] [DOI] |
| 15. | Hu C, Yi C, Hao Z, Cao S, Li H, Shao X, Zhang J, Qiao T, Fan D. The effect of somatostatin and SSTR3 on proliferation and apoptosis of gastric cancer cells. Cancer Biol Ther. 2004;3:726-730. [PubMed] [DOI] |
| 16. | Xidakis C, Kolios G, Valatas V, Notas G, Mouzas I, Kouroumalis E. Effect of octreotide on apoptosis-related proteins in rat Kupffer cells: a possible anti-tumour mechanism. Anticancer Res. 2004;24:833-841. [PubMed] |
| 17. | Pan DY, Qiao JG, Chen JW, Huo YC, Zhou YK, Shi HA. Tamoxifen combined with octreotide or regular chemotherapeutic agents in treatment of primary liver cancer: a randomized controlled trial. Hepatobiliary Pancreat Dis Int. 2003;2:211-215. [PubMed] |
| 18. | 崔 儒涛, 蔡 淦, 程 勇, 杨 秋泓, 田 涛. 全反式维甲酸对大鼠胃黏膜上皮异型增生细胞凋亡及调控基因(Bcl-2、Fas、ICE)蛋白表达的影响. 中华消化杂志. 2000;20:82-84. |
| 19. | Liu F, Qi HL, Chen HL. Effects of all-trans retinoic acid and epidermal growth factor on the expression of nm23-H1 in human hepatocarcinoma cells. J Cancer Res Clin Oncol. 2000;126:85-90. [PubMed] |
| 20. | Watanabe A, Kanai H, Arai M, Sekiguchi K, Uchiyama T, Nagai R, Kurabayashi M. Retinoids induce the PAI-1 gene expression through tyrosine kinase-dependent pathways in vascular smooth muscle cells. J Cardiovasc Pharmacol. 2002;39:503-512. [PubMed] [DOI] |
| 21. | Johst U, Betsch A, Wiskirchen J, Schöber W, Vonthein R, Rinkert N, Kehlbach R, Claussen CD, Duda SH. All-trans and 9-cis retinoid acids inhibit proliferation, migration, and synthesis of extracellular matrix of human vascular smooth muscle cells by inducing differentiation in vitro. J Cardiovasc Pharmacol. 2003;41:526-535. [PubMed] [DOI] |
| 22. | Feng Y, Wang LY, Cai T, Jin JW, Zhou GF, Cao LH, Zha XL. All-trans-retinoic acid increased the expression of integrin alpha5beta1 and induced "anoikis" in SMMC-7721 hepatocarcinoma cell. J Exp Clin Cancer Res. 2001;20:429-438. [PubMed] |
| 23. | Rowling MJ, Schalinske KL. Retinoid compounds activate and induce hepatic glycine N-methyltransferase in rats. J Nutr. 2001;131:1914-1917. [PubMed] |
| 24. | Sun SY, Wan H, Yue P, Hong WK, Lotan R. Evidence that retinoic acid receptor beta induction by retinoids is important for tumor cell growth inhibition. J Biol Chem. 2000;275:17149-17153. [PubMed] |
| 25. | Hatoum A, El-Sabban ME, Khoury J, Yuspa SH, Darwiche N. Overexpression of retinoic acid receptors alpha and gamma into neoplastic epidermal cells causes retinoic acid-induced growth arrest and apoptosis. Carcinogenesis. 2001;22:1955-1963. [PubMed] [DOI] |
| 26. | Dragnev KH, Rigas JR, Dmitrovsky E. The retinoids and cancer prevention mechanisms. Oncologist. 2000;5:361-368. [PubMed] [DOI] |
| 27. | Zhang H, Rosdahl I. Expression profiles of p53, p21, bax and bcl-2 proteins in all-trans-retinoic acid treated primary and metastatic melanoma cells. Int J Oncol. 2004;25:303-308. [PubMed] [DOI] |