修回日期: 2003-07-01
接受日期: 2003-07-16
在线出版日期: 2004-01-15
目的: 应用基因芯片技术, 阐明甘草甜素作用于T淋巴细胞之后, 甘草甜素对于T淋巴细胞基因表达谱的影响.
方法: 应用基因表达谱芯片技术, 对甘草甜素诱导的Jurkat细胞和以生理盐水处理的相同细胞的mRNA进行差异显示分析, 研究甘草甜素诱导人T淋巴细胞系Jurkat细胞后的差异表达基因.
结果: Jurkat细胞经甘草甜素诱导后, 所检测的1 152条目的基因中有30条产生差异表达, 其中12条基因表达增强, 18条基因表达降低. 表达增强的基因主要有: 胸腺素及促胸腺生成素蛋白编码基因; 白介素-18(IL-18); 细胞代谢相关酶类. 表达降低的基因主要有:细胞信号转导相关基因(如血清/糖皮质激素调节激酶、丝裂素活化的蛋白激酶激酶激酶2、磷脂酶2调节亚基、鸟嘌呤核苷结合蛋白、神经营养的酪氨酸激酶3型受体等); La自身抗原.
结论: 应用基因表达谱芯片成功筛选了甘草甜素诱导T淋巴细胞后差异表达基因, 为进一步阐明甘草甜素的免疫调节机制及深入了解甘草甜素用于防治病毒性肝炎的药理作用机制提供依据.
引文著录: 刘妍, 成军, 杨倩, 王建军, 纪冬, 王春花, 党晓燕, 徐志强. 应用基因表达谱芯片技术克隆甘草甜素诱导Jurkat细胞后的差异表达基因. 世界华人消化杂志 2004; 12(1): 70-73
Revised: July 1, 2003
Accepted: July 16, 2003
Published online: January 15, 2004
AIM: To study the difference in gene expression profile in human lymphoma cell line Jurkat cells treated with glycyrrhizin (GL), and to further elucidate the molecular immune mechanism of glycyrrhizin against T lymphocyte.
METHODS: cDNA microarray technology was employed to detect the mRNA from Jurkat cells treated with GL and 0.9 percent sodium chloride, respectively.
RESULTS: The results indicated that among 1 152 genes which were obtained from gene expression profile analysis, there were 30 genes different from those in GenBank in which 12 genes were up-regulated and 18 genes were down-regulated in Jurkat cells treated with GL, compared to those treated with 0.9 percent sodium chloride. These genes differentially regulated by GL included human genes encoding proteins involved in immune regulation, cell signal transduction, cell proliferation and differentiation.
CONCLUSION: cDNA microarray technology is successfully used to screen the genes differentially expressed in Jurkat cells treated with GL, which brings some new clues for studying the immune regulation mechanism of GL.
- Citation: Liu Y, Cheng J, Yang Q, Wang JJ, Ji D, Wang CH, Dang XY, Xu ZQ. Cloning of genes differentially expressed in Jurkat cells treated with glycyrrhizin using cDNA microarray. Shijie Huaren Xiaohua Zazhi 2004; 12(1): 70-73
- URL: https://www.wjgnet.com/1009-3079/full/v12/i1/70.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i1.70
从甘草的根茎提取的甘草甜素(glycyrrhizin, GL), 是由2分子的葡萄糖醛酸与甘草酸组成的复合物, 具有抗炎症及抗过敏作用, 曾作为过敏性皮肤病的治疗药被广泛使用. 自1958年首次用于慢性肝病患者以来, 作为肝病的治疗药物引起人们的关注. 研究表明, 甘草甜素在乙型肝炎和丙型肝炎抗病毒治疗、保护肝细胞、避免肝损害中具有重要应用前景, 并且具有潜在的抑制肝细胞肿瘤增生的作用[1]. 进一步研究发现, 甘草甜素能诱导小鼠血清中细胞因子干扰素(IFN)的产生, 对巨噬细胞及NK细胞活性有显著增强作用[2], 并且选择性刺激小鼠肝内T细胞的增生[3]. 这些初步的研究结果表明, 甘草甜素可能具有免疫调节作用, 但是具体的调节机制目前还不十分清楚.
基因芯片技术(cDNA microarray)是由大量目的基因片段有序、密集地固定于玻片或尼龙膜上而制成芯片, 将两组组织或细胞的mRNA逆转录成cDNA, 掺入荧光标记, 同时与芯片杂交, 通过扫描分析每一位置的荧光信息可以快速有效地检测到二者间差异表达的基因. 本项研究应用基因芯片技术, 筛选甘草甜素作用于T淋巴细胞系Jurkat细胞后差异表达的免疫调节基因, 并应用生物信息学(bioinformatics)技术初步获得其基因全长序列. 甘草甜素免疫调节靶基因的研究, 为深入了解其免疫调节作用机制及在肝炎病毒的清除过程中的作用机制提供理论依据.
T淋巴细胞系Jurkat细胞由本室保存, 细胞培养相关试剂及总RNA提取试剂TRIzol均购自Gibco公司, GL由深圳健安医药公司提供. 在35 mm培养皿中常规培养Jurkat细胞, 细胞生长至对数期时分别将GL及0.9% NaCl加入细胞培养液中, 使终浓度达到1.0 mM, 24 h后收获细胞, 每5×106个细胞加入1 mL TRIzol试剂. 立即于液氮中保存.
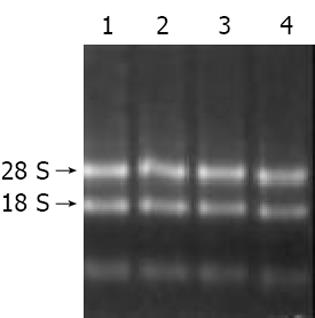
使用TRIzol试剂一步法提取甘草甜素及0.9% NaCl处理的Jurkat细胞总RNA(分别标记为实验组和对照组), 样品经分光光度计检测吸光度A值, 并行热稳定实验, 于-20 ℃和70 ℃保温1 h后, 经琼脂糖凝胶电泳检测28 S、18 S条带变化. 以Qiagen公司Oligotex mRNA Midi Kit纯化得mRNA. 操作按说明书进行, 并行电泳检测.
常规方法逆转录标记cDNA探针并纯化. Cy3-dUTP标记对照组细胞mRNA(5 g), Cy5-dUTP标记实验组细胞mRNA(5 g). 乙醇沉淀后溶解在20 l 5×SSC+0.2% SDS杂交液中.
芯片包含的1 152个cDNA由上海联合基因有限公司提供, 包括原癌基因和抑癌基因、免疫调节相关基因、细胞凋亡和应激反应蛋白相关基因、信号转导相关基因等. 以通用引物进行PCR扩增, PCR产物长度为1 000-3 000 bp. 靶基因以0.5 g/l溶解于3×SSC溶液中,用Cartesian公司的Cartesian 7 500 点样仪及TeleChem公司的硅烷化玻片进行点样.玻片经水合(2h)、室温干燥(0.5 h), UV交联, 再分别用0.2% SDS、水及0.2% 的硼氢化钠溶液处理10 min, 晾干备用.
将基因芯片和杂交探针在95 ℃水浴变性5 min, 将混合探针加在基因芯片上, 置于60 ℃杂交15-17 h. 依次以2×SSC+ 0.2% SDS、0.1%×SSC+ 0.2% SDS、0.1%×SSC洗涤10 min, 室温晾干.
用General Scanning公司的ScanArray 3 000扫描芯片. 用预先选定的内参照基因(24条管家基因, 每个基因点2个点, 共48个点)对Cy3和Cy5的原始提取信号进行均衡和修正. 用ImaGene3.0软件分析Cy3、Cy5两种荧光信号的强度, 计算Cy5/Cy3比值. 阳性结果判断: Cy5/Cy3>1.8, 红色荧光, 显示表达增强; Cy5/Cy3<0.6, 为绿色荧光, 显示表达减弱.
实验组和对照组总RNA的吸光度比值A260/A280分别为1.988和2.007, 热稳定实验70 ℃保温1 h与-20 ℃ 1 h电泳条带比较, 显示28 S条带无明显降解, 电泳结果证实已抽提高纯度的总RNA(图1). mRNA主要集中于0.9-4.0 kb的连续条带.
在芯片上共有1 152个cDNA. 为了监控芯片杂交技术体系的整个过程, 在芯片上设置了阴性对照(8条水稻基因, 共8个点), 这些点的杂交信号均很低, 证实了数据的可靠性. 由于实验组探针标记Cy5荧光素(呈红色), 对照组探针标记Cy3荧光素(呈绿色), 红绿颜色的差异就显示该基因在实验组和对照组中基因表达水平上的差异, 黄色代表表达水平无差异. 按阳性标准, 从1 152个基因中筛选出差异表达基因共30条, 占2.62%, 其中12条基因表达增强, 18条基因表达降低.
表达增强的基因主要有: 胸腺素及促胸腺生成素蛋白编码基因; 白介素-18; 细胞代谢相关酶类. 部分表达显著增强的基因见表1. 表达降低的基因主要有: 细胞信号转导相关基因(如血清/糖皮质激素调节激酶、丝裂素活化的蛋白激酶激酶激酶2、磷脂酶2调节亚基、鸟嘌呤核苷结合蛋白、神经营养的酪氨酸激酶3型受体等); La自身抗原. 部分表达显著降低的基因见表2.
| 序号 | GenBank登录号 | 编码蛋白 | Cy5/Cy3 |
| 1 | NM_004525 | 低密度脂蛋白相关蛋白2 | 1.804 |
| 2 | NM_000560 | CD53抗原 | 1.864 |
| 3 | NM_003276 | 促胸腺生成素 | 1.955 |
| 4 | AK055976 | 胸腺素 -4 | 1.968 |
| 5 | NM_001562 | 白介素18 | 1.998 |
| 6 | NM_003129 | 鲨烯环氧酶 | 2.463 |
| 7 | NM_014762 | 24-胆固醇脱氢还原酶 | 2.807 |
| 序号 | GenBank登录号 | 编码蛋白 | Cy5/Cy3 |
| 1 | NM_001762 | 含TCP1的伴侣蛋白 | 0.374 |
| 2 | NM_004728 | DEAD/H 盒21多肽 | 0.438 |
| 3 | NM_003142 | La自身抗原 | 0.453 |
| 4 | NM_001961 | 真核翻译延伸因子2 | 0.473 |
| 5 | NM_005627 | 血清/糖皮质激素调节激酶 | 0.551 |
| 6 | NM_006609 | 丝裂素活化的蛋白激酶激酶激酶2 | 0.554 |
| 7 | NM_002719 | 磷酸脂酶2调节亚基 | 0.560 |
| 8 | NM_006098 | 鸟嘌呤核苷结合蛋白 | 0.577 |
| 9 | NM_002530 | 神经营养的酪氨酸激酶3型受体 | 0.579 |
日本米诺发(Minophagen)制药公司生产的甘草甜素注射液, 具有广泛的药理作用, 在抗炎、抗溃疡、抗过敏反应、皮肤病治疗等方面具有很好疗效. 自首次用于慢性肝病患者以来, 越来越多的临床和流行病学研究显示, 甘草甜素在治疗慢性乙型、丙型肝炎病毒感染, 预防肝硬化、肝细胞癌方面同样具有明显疗效[1-7]. 众所周知, 免疫调节作用在抗乙型、丙型肝炎病毒治疗中, 发挥着十分重要的作用. 干扰素、核苷类似物、免疫调节剂、天然药物对于肝炎病毒的清除, 都离不开机体免疫系统的参与. 虽然甘草甜素在慢性病毒性肝炎治疗中有一定的作用, 但应用甘草甜素之后, 究竟是甘草甜素对于免疫系统直接的作用, 还是由于甘草甜素的抗肝炎病毒作用, 抑制病毒复制过程, 使病毒载量降低, 对于机体免疫系统的抑制减轻, 机体免疫功能的自然恢复等, 目前都不十分清楚. 因此关于甘草甜素免疫调节机制的研究, 对于深入阐明甘草甜素的药理作用机制, 提高甘草甜素在慢性病毒性肝炎中的疗效, 都具有十分重要的意义.
基因表达谱芯片是将大量的基因特异的探针或其cDNA片段固定在一块基因芯片上, 对来源不同的个体、不同组织、不同细胞周期、不同发育阶段、不同分化阶段、不同病变、不同刺激(包括不同诱导、不同治疗手段)下的细胞内的mRNA或逆转录产物cDNA进行检测, 从而大规模对这些基因表达的个体特异性、组织特异性、发育阶段特异性、分化阶段特异性、病变特异性、刺激特异性进行综合分析和判断[8-12]. 本研究应用基因表达谱芯片对甘草甜素诱导的Jurkat细胞和以生理盐水处理的相同细胞系的基因表达进行检测, 通过分析二者之间基因表达的差异信息, 寻找甘草甜素刺激后的差异表达基因. 在1 152个基因中筛选出30个差异表达的基因, 从表1、2列出的部分表达变化显著的基因中, 看出这些基因涉及细胞信号传导、免疫调节、炎症反应、能量代谢等生物过程, 说明甘草甜素与免疫调节、细胞增生、分化等密切相关.
分析表达增强的基因, 促胸腺生成素和胸腺素, 为广泛使用的免疫增强剂, 由此可以推测甘草甜素通过上调机体的促胸腺生成素及胸腺素的表达水平, 增强机体的免疫力, 发挥其抗病毒感染的作用[13-17]. 已知IL-18是一种强有力的干扰素(IFN-)诱导因子, 能够诱导各类白细胞产生IFN-, 甘草甜素通过上调IL-18的表达, 发挥其抗感染、抗肿瘤、介导炎症反应、诱发靶细胞凋亡等多种生物学活性[18-23]. 胆固醇脱氢还原酶是黄素腺嘌呤二核苷酸依赖的氧化还原酶家族成员, 降低胆固醇生化合成过程中间产物水平. 鲨烯环氧酶是胆固醇生物合成过程中重要的限速酶, 甘草甜素通过上调两酶的表达水平, 从而影响胆固醇的生物合成[24,25].
表达降低的基因主要有: 与信号传递相关基因: 如丝裂素活化的蛋白激酶激酶激酶2、鸟嘌呤核苷结合蛋白、神经营养的酪氨酸激酶3型受体等基因在甘草甜素诱导后表达降低, 提示甘草甜素可能通过负调控细胞信号传递途径, 而抑制某些与细胞转录调节密切相关的基因, 间接抑制癌基因的转录, 在抗病毒治疗及抑制肿瘤发生中发挥作用. 已知La自身抗原能够与HBV RNA结合, 对HBV RNA的稳定起决定性作用, 能够干扰细胞因子对HBV RNA转录后水平的下调作用, 甘草甜素通过下调La自身抗原的表达水平, 降低了La-HBV RNA之间的相互作用, 促进了HBV RNA的降解, 抑制病毒的增生, 推测这是甘草甜素治疗HBV感染的另一重要分子机制[26-28]. DEAD/H盒多肽是核糖体RNA合成及加工过程中重要的酶, 真核翻译延伸因子2是蛋白质合成过程中必不可少的, 甘草甜素下调上述两基因表达水平, 提示甘草甜素可能在调控肝细胞生长过程中起一定的作用[29-31]. 此外, 甘草甜素下调磷酸脂酶2调节亚基的表达, 蛋白磷酸酶2A是细胞内主要的丝氨酸/苏氨酸磷酸脂酶, 对细胞的生长及代谢具有广泛的调节作用, 推测甘草甜素间接调节细胞的生长过程[32].
总之, 利用基因表达谱芯片对甘草甜素免疫调节基因的表达研究表明, 甘草甜素能够上调或下调Jurkat细胞中许多不同基因表达的变化, 这些基因与细胞信号转导、细胞增生与分化、免疫调节等生物过程密切相关. 本实验结果对于阐明甘草甜素免疫调节机制及其在清除肝炎病毒感染中的作用具有重要意义.
编辑: N/A
| 1. | Khaksa G, Zolfaghari ME, Dehpour AR, Samadian T. Anti-inflammatory and anti- nociceptive activity of disodium glycyrrhetinic acid hemiphthalate. Planta Med. 1996;62:326-328. [PubMed] [DOI] |
| 2. | Kimura M, Watanabe H, Abo T. Selective activation of extrathymic T cells in the liver by glycyrrhizin. Biotherapy. 1992;5:167-176. [PubMed] [DOI] |
| 3. | Homma M, Oka K, Ikeshima K, Takahashi N, Niitsuma T, Fukuda T, Itoh H. Different effects of traditional Chinese medicines containing similar herbalconstituents on prednisolone pharmacokinetics. J Pharm Pharmacol. 1995;47:687-692. [PubMed] [DOI] |
| 4. | Zhang YH, Isobe K, Nagase F, Lwin T, Kato M, Hamaguchi M, Yokochi T, Nakashima I. Glycyrrhizin as a promoter of the late signal transduction for interleukin-2 production by splenic lymphocytes. Immunology. 1993;79:528-534. [PubMed] |
| 5. | Zhang YH, Kato M, Isobe K, Hamaguchi M, Yokochi T, Nakashima I. Dissociated control by glycyrrhizin of proliferation and IL-2 production ofmurine thymocytes. Cell Immunol. 1995;162:97-104. [PubMed] [DOI] |
| 6. | Jeong HG, You HJ, Park SJ, Moon AR, Chung YC, Kang SK, Chun HK. Hepatoprotective effects of 18beta-glycyrrhetinic acid on carbon tetrachloride-induced liver injury: inhibition of cytochrome P450 2E1 expression. Pharmacol Res. 2002;46:221-227. [PubMed] [DOI] |
| 7. | Tanahashi T, Mune T, Morita H, Tanahashi H, Isomura Y, Suwa T, Daido H, Gomez-Sanchez CE, Yasuda K. Glycyrrhizic acid suppresses type 2 11 beta-hydroxysteroid dehydrogenase expression in vivo. J Steroid Biochem Mol Biol. 2002;80:441-447. [PubMed] [DOI] |
| 8. | Kaminski S. DNA microarrays-a methodological breakthrough in genetics. J Appl Genet. 2002;43:123-130. [PubMed] |
| 9. | Lakhani SR, Ashworth A. Microarray and histopathological analysis of tumours: the future and the past? Nat Rev Cancer. 2001;1:151-157. [PubMed] [DOI] |
| 10. | Borrebaeck CA, Ekstrom S, Hager AC, Nilsson J, Laurell T, Marko-Varga G. Protein chips based on recombinant antibody fragments: a highly sensitive approach as detected by mass spectrometry. Biotechniques. 2001;30:1126-1130. [PubMed] |
| 13. | Huff T, Muller CS, Otto AM, Netzker R, Hannappel E. beta-Thymosins, small acidic peptides with multiple functions. Int J Biochem Cell Biol. 2001;33:205-220. [PubMed] [DOI] |
| 14. | Sosne G, Szliter EA, Barrett R, Kernacki KA, Kleinman H, Hazlett LD. Thymosin beta 4 promotes corneal wound healing and decreases inflammation in vivo following alkali injury. Exp Eye Res. 2002;74:293-299. [PubMed] [DOI] |
| 15. | Oh IS, So SS, Jahng KY, Kim HG. Hepatocyte growth factor upregulates thymosin beta4 in human umbilical vein endothelial cells. Biochem Biophys Res Commun. 2002;296:401-405. [PubMed] [DOI] |
| 16. | Girardi M, Sherling MA, Filler RB, Shires J, Theodoridis E, Hayday AC, Tigelaar RE. Anti-inflammatory effects in the skin of thymosin-beta 4 splice-variants. Immunology. 2003;109:1-7. [PubMed] [DOI] |
| 17. | Oh IS, So SS, Jahng KY. Hepatocyte growth factor upregulates thymosin beta4 in human umbilical vein endothelial cells. Biochem Biophys Res Commun. 2002;296:401-405. [DOI] |
| 18. | Okamura H, Tsutsi H, Komatsu T, Yutsudo M, Hakura A, Tanimoto T, Torigoe K, Okura T, Nukada Y, Hattori KL. Cloning of a new cytokine that induces IFN-gamma production by T cells. Nature. 1995;378:88-91. [PubMed] [DOI] |
| 19. | Liebau C, Baltzer AW, Schmidt S, Roesel C, Karreman C, Prisack JB, Bojar H, Merk H. Interleukin-12 and interleukin-18 induce indoleamine 2, 3-dioxygenase (IDO) activity in human osteosarcoma cell lines independently from interferon-gamma. Anticancer Res. 2002;22:931-936. [PubMed] |
| 20. | Nakamura S, Otani T, Ijiri Y, Motoda R, Kurimoto M, Orita K. IFN-gamma-dependent and -independent mechanisms in adverse effects caused by concomitant administration of IL-18 and IL-12. J Immunol. 2000;164:3330-3336. [PubMed] [DOI] |
| 22. | Kremer L, Dupre L, Wolowczuk I, Locht C. In vivo immunom-odulation following intradermal injection with DNA encoding IL-18. J Immunol. 1999;163:3226-3231. [PubMed] |
| 23. | Dinarello CA. IL-18: A TH1-inducing, proinflammatory cytokine and new member of the IL-1 family. J Allergy Clin Immunol. 1999;103:11-24. [PubMed] [DOI] |
| 24. | Waterham HR, Koster J, Romeijn GJ, Hennekam RC, Vreken P, Andersson HC, FitzPatrick DR, Kelley RI, Wanders RJ. Mutations in the 3beta-hydroxysterol Delta24-reductase gene cause desmosterolosis, an autosomal recessive disorder of cholesterol biosynthesis. Am J Hum Genet. 2001;69:685-694. [PubMed] [DOI] |
| 25. | Nakamura Y, Sakakibara J, Izumi T, Shibata A, Ono T. Transcriptional regulation of squalene epoxidase by sterols and inhibitors in HeLa cells. J Biol Chem. 1996;271:8053-8056. [PubMed] [DOI] |
| 26. | Horke S, Reumann K, Rang A, Heise T. Molecular characterization of the human La protein.hepatitis B virus RNA. B interaction in vitro. J Biol Chem. 2002;277:34949-34958. [PubMed] [DOI] |
| 27. | Heise T, Guidotti LG, Chisari FV. La autoantigen specifically recognizes a predicted stem-loop in hepatitis B virus RNA. J Virol. 1999;73:5767-5776. [PubMed] |
| 28. | Heise T, Guidotti LG, Chisari FV. Characterization of nuclear RNases that cleave hepatitis B virus RNA near the La protein binding site. J Virol. 2001;75:6874-6883. [PubMed] [DOI] |
| 29. | Valdez BC, Perlaky L, Henning D. Expression, cellular localization, and enzymatic activities of RNA helicase II/Gu(beta). Exp Cell Res. 2002;276:249-263. [PubMed] [DOI] |
| 30. | Zhu K, Henning D, Valdez B, Busch H. Human RNA helicase II/Gu gene: genomic organization and promoter analysis. Biochem Biophys Res Commun. 2001;281:1006-1011. [PubMed] [DOI] |
| 31. | Kang KR, Lee SY. Effect of serum and hydrogen peroxide on the Ca2+/ calmodulin-dependent phosphorylation of eukaryotic elongation factor 2(eEF-2) in Chinese hamster ovary cells. Exp Mol Med. 2001;33:198-204. [PubMed] [DOI] |
| 32. | Tehrani MA, Mumby MC, Kamibayashi C. Identification of a novel protein phosphatase 2A regulatory subunit highly expressed in muscle. J Biol Chem. 1996;271:5164-5170. [PubMed] [DOI] |