修回日期: 2003-07-01
接受日期: 2003-07-16
在线出版日期: 2004-01-15
目的: 筛选与克隆NS5A反式激活的新型靶基因NS5ATP6的反式激活基因, 探讨其可能存在的调节功能.
方法: 应用抑制性消减杂交(SSH)技术及生物信息学(bioin-formatics)技术筛选并克隆NS5ATP6反式激活的新型靶基因.以NS5ATP6表达质粒pcDNA3.1(-)-NS5ATP6转染HepG2细胞, 以空载体pcDNA3.1(-)为平行对照, 制备转染后的细胞裂解液, 提取mRNA并逆转录为cDNA, 经Rsa I酶切后, 将实验组cDNA分成两组, 分别与两种不同的接头衔接, 再与对照组cDNA进行两次消减杂交及两次抑制性聚合酶链反应(PCR), 将产物与T/A载体连接, 构建cDNA消减文库, 并转染大肠杆菌进行文库扩增, 随机挑选克隆PCR扩增后进行测序及同源性分析.
结果: 成功构建人NS5ATP6反式激活基因差异表达的cDNA消减文库. 文库扩增后得到33个阳性克隆, 进行菌落PCR分析, 均得到200-2 000 bp插入片段. 对插入片段测序, 并通过生物信息学分析获得其全长基因序列, 结果共获得26种编码基因, 包括24种已知基因和2种未知基因.
结论: 筛选到的cDNA全长序列, 包括一些与细胞生长调节、信号转导、肿瘤免疫发生及细胞凋亡密切相关的蛋白编码基因, 推测了NS5ATP6可能存在的调控机制的线索, 尚需进一步的实验证明.
引文著录: 王建军, 刘妍, 成军, 杨倩, 纪冬, 党晓燕, 王春花. 丙型肝炎病毒非结构蛋白5A反式激活基因6的反式激活基因的筛选. 世界华人消化杂志 2004; 12(1): 54-57
Revised: July 1, 2003
Accepted: July 16, 2003
Published online: January 15, 2004
AIM: To clone and identify human genes transactivated by NS5ATP6 by constructing a cDNA subtractive library with suppression subtractive hybridization technique.
METHODS: Suppression subtractive hybridization (SSH) and bioinformatics techniques were used for screening and cloning of the target genes transactivated by NS5ATP6 protein. The mRNA was isolated from HepG2 cells transfected pcDNA3.1(-)-NS5ATP6 and pcDNA3.1(-) empty vector, respectively, and SSH method was employed to analyze the differentially expressed DNA sequence between the two groups. After restriction enzyme Rsa I digestion, small sizes of cDNAs were obtained. Then tester cDNA was divided into two groups and ligated to the specific adaptor 1 and adaptor 2, respectively. After tester cDNA was hybridized with driver cDNA twice and underwent two times of nested PCR and then was subcloned into T/A plasmid vectors to set up the subtractive library. Amplification of the library was carried out with E. coli strain JM109. The cDNA was sequenced and analyzed in GenBank with Blast search after PCR.
RESULTS: The subtractive library of genes transactivated by NS5ATP6 was constructed successfully. The amplified library contained 33 positive clones. Colony PCR showed that these clones contained 200-2 000 bp inserts. Sequence analysis was performed in 33 clones, and the full length sequences were obtained with bioinformatics method. Altogether 26 coding sequences were obtained, which consisted of 24 known and 2 unknown ones.
CONCLUSION: The obtained sequences may be target genes transactivated by NS5ATP6, among which some genes coding proteins involve in cell cycle regulation, signal transduction, tumor immunity and development, and apop-tosis. Advanced experiments need to be done to prove those findings.
- Citation: Wang JJ, Liu Y, Cheng J, Yang Q, Ji D, Dang XY, Wang CH. Screening and cloning of target genes transactivated by human gene 6 transa-ctivated by nonstructural protein 5A of hepatitis C virus using suppression subtractive hybridization technique. Shijie Huaren Xiaohua Zazhi 2004; 12(1): 54-57
- URL: https://www.wjgnet.com/1009-3079/full/v12/i1/54.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i1.54
丙型肝炎病毒(HCV)非结构蛋白5A(NS5A)是HCV基因组编码的一种最为重要的具有多种生物学活性的非结构蛋白质[1-3], 是HCV基因组编码的一种具有反式激活作用等多种生物学活性的非结构蛋白质. 其基因序列的变异, 决定部分HCV病毒株对于干扰素α(IFNα)治疗的疗效应答. HCV NS5A蛋白还具有结合双链RNA激酶(PKR)的生物学活性, 与HCV感染的靶细胞的细胞周期和细胞凋亡的分子生物学调节机制密切相关[4]. NS5A蛋白是一种作用很强的转录激活因子, 能够影响细胞信号转导途径, 激活多种病毒及细胞基因启动子, 调控着细胞基因的转录, 推测NS5A蛋白的这种反式激活作用, 可能是HCV感染与肝细胞癌(hepatocellular carcinoma, HCC)发生发展密切相关的重要分子生物学机制[5-6].
本室利用抑制性消减杂交技术(suppression subtractive hybridization, SSH), 对于表达HCV NS5A载体转染的HepG2细胞进行研究, 结合生物信息学技术(bioinformatics)克隆了NS5A蛋白反式激活作用的新靶基因, 命名为HCV NS5A蛋白反式激活基因6(NS5ATP6)[7]. 并继续应用抑制性消减杂交技术筛选与克隆NS5ATP6反式激活的基因, 推测其在体内可能存在功能的线索, 为研究HCV的致病机制及探索未知基因的功能提供了新的方向.
HepG2细胞及感受态大肠杆菌JM109 (本室保存), pcDNA3.1(-)真核表达载体(Invitrogen); FuGENE6 转染试剂(Roche),mRNA Purification试剂盒(Amersham Pharmacia Biotech), PCR-Select cDNA Subtraction试剂盒, 50×PCR Enzyme Mix、Advantage PCR Cloning试剂盒(Clontech), High Pure PCR Product Purification试剂盒(Boehringer Mannheim), T7、SP6通用引物及pGEM-Teasy载体(Promega).
1.2.1 真核表达载体及细胞转染: HCV NS5ATP6核表达质粒pcDNA3.1(-)-NS5ATP6 由本室构建. 用FuGENE6 转染试剂将2 g pcDNA3.1(-)-NS5ATP6及pcDNA3.1(-)空载体分别转染35 mm平皿HepG2 细胞, 48 h后收获细胞.
1.2.2 细胞mRNA提取: 使用mRNA Purification试剂盒, 直接提取转染了核心表达质粒及空载体的HepG2细胞mRNA, 经琼脂糖凝胶电泳及分光光度计进行定性、定量分析.
1.2.3 双链cDNA(dscDNA)合成: 用Clontech公司的PCR-SelectTM cDNA Subtraction Kit中的试剂, 以获得的mRNA为模板逆转录合成cDNA.
1.2.4 消减杂交文库的建立: 采用Clontech公司的PCR-SelectTM cDNA Subtraction Kit[3], 常规SSH方法按说明书进行: 转染了核心表达质粒及空载体的HepG2 细胞cDNA分别标记为Tester和Driver, 经Rsa I (一种识别4碱基序列的内切酶)消化, 产生相对较短的平端片段, 纯化酶切产物.将Tester的cDNA分为两份, 分别连接试剂盒提供的特殊设计的寡核苷酸接头adapter 1和adapter 2, 然后与过量的Driver cDNA进行杂交; 合并两种杂交产物后再与Driver cDNA作第2次杂交; 然后将杂交产物做选择性PCR扩增, 使Tester cDNA中特异性表达或高表达的片段得到特异性扩增.
1.2.5 克隆鉴定分析: 扩增产物与pGEM-Teasy载体连接, 转化JM109感受态细菌, 在含氨苄青霉素的LB/X-gal/IPTG培养板上, 37 ℃培养18 h. 挑取白色菌落, 增菌, 以pGEM-Teasy载体多克隆位点两端T7/SP6引物进行菌落PCR扩增, 证明含有插入片段后(100-2 000 bp), 测序(上海申友公司). 应用生物信息学将测得序列与GenBank数据库进行同源性分析.
使用高质量的mRNA是保证cDNA高产量的前提. 紫外分光检测显示, 转染了pcDNA3.1(-)-NS5ATP6质粒及空载体的HepG2 细胞mRNA分别为4.64 g和4.38 g, A260/A280= 1.87.10 g/L琼脂糖凝胶电泳见 mRNA为大于0.5 kb清晰慧尾片状条带.
dscDNA与接头连接效率的高低是决定抑制性消减杂交成败的最关键步骤. 将连接有adaptor l和adaptor 2的两组dscDNA分别用不同的特异性引物(看家基因甘油三磷酸脱氢酶G3PDH引物)进行28个循环扩增, 产物用20 g/L琼脂糖凝胶电泳鉴定.结果显示两组dscDNA扩增产物浓度相当, 说明dscDNA已与接头高效率连接.
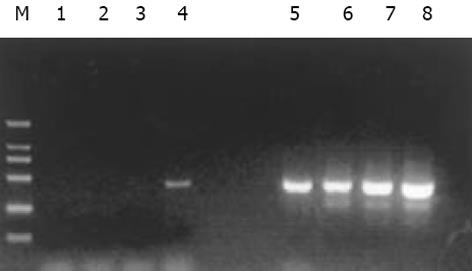
分别取1 L抑制性及非抑制性PCR产物为模板, 用看家基因G3PDH引物进行PCR扩增, 分别在18、23、28、33次循环结束时从体系中吸取5 L进行电泳鉴定. 结果显示: 与非抑制性PCR产物相比, 抑制性PCR产物中G3PDH基因产物大大减少, 说明所构建的消减文库具有很高的消减效率(图1).
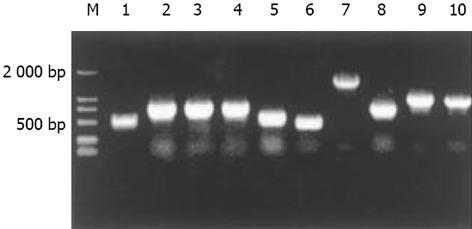
杂交产物经两轮PCR扩增后, 菌落PCR扩增结果显示为200-2 000 bp大小不等的插入片段, 所获得的33个克隆中几乎均含有插入片段, 这些条带可能代表差异表达的基因片段(图2).
全部克隆测序, 与GenBank数据库进行初步比较. 其中有2个克隆未检索到任何对应的相似序列, 可能代表了某些新基因, 进一步的分析和功能鉴定正在进行中. 有31个克隆与已知基因的部分序列高度同源(96%-100%)(表1).
| 序号 | 同源序列编码蛋白 | 相同克隆数 | 同源性 |
| 1 | 核糖体蛋白质 | 6 | 99% |
| 2 | 尿苷二磷酸氨基半乳糖基转移酶 | 1 | 97% |
| 3 | 甲硫氨酸腺苷基转移酶II | 1 | 100% |
| 4 | 磷脂酶A2 | 1 | 100% |
| 5 | 线粒体单倍型 | 2 | 100% |
| 6 | 丝氨酸/苏氨酸激酶17a | 1 | 97% |
| 7 | 细胞色素C氧化酶III | 1 | 97% |
| 8 | 肿瘤蛋白翻译调控因子1 | 1 | 100% |
| 9 | 微粒体氨肽酶 | 1 | 99% |
| 10 | 肿瘤排斥抗原1 | 1 | 99% |
| 11 | 抗胰蛋白酶 | 1 | 100% |
| 12 | 桥粒斑蛋白 | 1 | 100% |
| 13 | 含有TCP1亚单位5的伴侣蛋白 | 1 | 99% |
| 14 | 脂肪酸结合蛋白1 | 1 | 99% |
| 15 | 短小杆菌素类似物1 | 1 | 96% |
| 16 | 转铁蛋白 | 2 | 100% |
| 17 | 白蛋白 | 1 | 99% |
| 18 | 鸟嘌呤核苷酸结合蛋白 | 1 | 100% |
| 19 | 环孢素A受体 | 1 | 100% |
| 20 | 醛脱氢酶7家族A1 | 1 | 99% |
| 21 | 黄体酮受体膜结构1 | 1 | 97% |
| 22 | 磷酸核糖酰氨基咪唑羧化酶 | 1 | 99% |
| 23 | 甘露糖苷酶 | 1 | 98% |
| 24 | 肌动蛋白 | 1 | 100% |
丙型肝炎病毒的NS5A蛋白是转录反式激活因子, 其羧基末端富含酸性氨基酸及脯氨酸, 这是真核细胞转录因子特有的结构特征, 但是其参与细胞转录调节的机制仍不十分清楚[7-9]. 一般来说, 转录的反式激活因子是在细胞核中起作用的, 而NS5A定位于细胞内质网(ER), 因此推测NS5A可能参与了细胞信号传导途径. NS5A能够反式激活核转录因子NF-B及STAT3, 在细胞炎症反应、肿瘤发生及转移过程中起重要作用[8]. Ghosh et al[9]研究发现, NS5A蛋白能够抑制细胞周期调节基因p21WAF1, 激活人肝癌细胞中增生的细胞核抗原基因(PCNA), 从而调节细胞凋亡, 促进细胞增生. NS5A cDNA能够使转染的小鼠成纤维细胞NIH 3T3具有转化特性, 且转化细胞移植入裸鼠体内可形成纤维肉瘤灶, 这一证据直接证明了HCV NS5A蛋白的恶性转化潜能. 可见, HCV非结构蛋白NS5A的反式激活功能在HCV致病中发挥了重要作用. 本室利用SSH对表达HCV NS5A载体转染的HepG2细胞进行研究, 结合生物信息学技术克隆了NS5A蛋白反式激活作用的新靶基因, 命名为HCV NS5A蛋白反式激活基因6 (NS5ATP6),并构建其真核表达载体pcDNA3.1(-)-NS5ATP6 [7]. 继续应用SSH筛选与克隆NS5ATP6反式激活的基因, 推测其在体内可能存在功能的线索.
SSH方法是近年发展起来的一项新的基因克隆技术, 与传统的方法比较, 具有实验周期短、易操作、可靠性高、假阳性率低等特点, 能有效地分离扩增低丰度特异表达的基因, 可以在较短的时间内获得较理想的实验结果[10]. 我们将真核表达载体pcDNA3.1(-)-NS5ATP6, 转染肝母细胞瘤细胞系HepG2, 并以转染空白载体的相同细胞系作为对照, 以2种转染的细胞系中提取的mRNA为起始材料, 应用SSH方法成功地构建了NS5ATP6反式激活相关基因差异表达的cDNA消减文库, 挑选33个克隆测序分析, 结果主要包括2种类型, 第一种是已知基因的序列, 共31个克隆, 与GenBank中数据高度同源(96%-100%). 这些克隆大致可分三类: (1)与细胞的结构、代谢相关, 如线粒体蛋白、核糖体蛋白编码基因, 肌动蛋白基因, 细胞色素C氧化酶III(CO III), FABP1, 桥粒斑蛋白(DSP)和白蛋白与细胞的转录、代谢功能及维持细胞结构相关[11-13] 微粒体氨肽酶可影响血清白蛋白活性[14]. (2)与肿瘤的发生、免疫等相关, 如GalNAc-T2常常与上皮细胞鳞状细胞癌相关[15-17], 甲硫氨酸腺苷基转移酶II和TPT1可上调肿瘤蛋白的表达[18-20], TRA1和环孢素A受体和体内的抗肿瘤机制有关[21-22], 而有报道醛脱氢酶的过表达可抑制环磷酰胺的抗癌作用[23], 抗胰蛋白酶也有报道在肝癌早期升高[24].(3)与细胞周期生长调节及信号转导途径密切相关基因, 如G-蛋白可参与细胞内信号传导, PCA2也与信号传导系统相关, 并且近来的研究发现其在体内的升高具有一定的抗微生物感染, 抗肿瘤的作用[25-30]. 丝氨酸/苏氨酸激酶被认为可调节c-fos和p27基因的表达[31], 并且参与对细胞凋亡的调节, 可以抑制前调亡蛋白的活性, 抑制T细胞的活性[32]. 第二种是未知基因序列, 共获得2个差异表达的未知序列.我们采用生物信息学方法对其中的2个序列分析, 获得了其全长基因序列, 已被GenBank收录.
通过对NS5ATP6的上述反式激活基因的分析, 我们发现他有可能参与体内肿瘤蛋白的表达与免疫的调控, 对于细胞内信号转导系统及细胞凋亡也可能有一定作用. NS5ATP6是正常人体存在的基因, 在病毒蛋白NS5A的存在下其功能可能被进一步激活. 本文所研究的, 仅仅是其在体内可能上调的基因的功能, 这是由于SSH实验本身的特点决定的. 关于其在体内是否存在下调某些基因的功能及与各种活性因子的具体调节机制, 仍需进一步实验来研究.
编辑: N/A
| 1. | 成 军. 丙型肝炎病毒基因的干扰素敏感决定区. 国外医学. 流行病学传染病学分册. 2000;27:55-58. |
| 2. | 钟 彦伟, 成 军, 陈 新华, 王 刚, 洪 源, 王 琳, 李 莉, 张 玲霞, 陈 菊梅. 应用噬菌体表面展示技术筛选丙型肝炎病毒NS5A抗原模拟表位. 世界华人消化杂志. 2002;10:133-136. [DOI] |
| 3. | 成 军, 钟 彦伟, 施 双双, 刘 妍, 王 刚, 董 菁, 夏 小兵, 陈 菊梅. HCV非结构蛋白NS5A人源单链可变区抗体基因的筛选与鉴定. 中华实验与临床病毒学杂志. 2001;15:216-218. |
| 4. | 成 军, 陈 菊梅. 丙型肝炎病毒NS5A蛋白的生物学调节作用. 国外医学微生物学分册. 2001;24:12-14. |
| 5. | Kato N, Lan KH, Ono-Nita SK, Shiratori Y, Omata M. Hepatitis C virus nonstructural region 5A protein is a potent transcriptional activator. J Virol. 1997;71:8856-8859. [PubMed] |
| 6. | Kato N, Yoshida H, Kioko Ono-Nita S, Kato J, Goto T, Otsuka M, Lan K, Matsushima K, Shiratori Y, Omata M. Activation of intracellular signaling by hepatitis B and C viruses: C-viral core is the most potent signal inducer. Hepatology. 2000;32:405-412. [PubMed] [DOI] |
| 7. | 王 建军, 杨 倩, 成 军, 刘 妍, 纪 冬, 党 晓燕, 王 春花. 丙型肝炎病毒非结构蛋白HS5A反式激活基因HS5ATP6的克隆化研究. 胃肠病学与肝病学杂志. 2003;12:251. |
| 8. | Gong GZ, Waris G, Tanveer R, Siddiqui A. Human hepatitis C virus NS5A protein alters intracellular calcium levels, induces oxidative stress, and activates STAT-3 and NF-B. Proc Natl Acad Sci USA. 2001;98:9599-9604. [DOI] |
| 9. | Ghosh AK, Steele R, Meyer K, Ray R, Ray RB. Hepatitis C virus NS5A protein modulates cell cycle regulatory genes and promotes cell growth. J Gen Virol. 1999;80:1179-1183. [PubMed] [DOI] |
| 10. | Kuang WW, Thompson DA, Hoch RV, Weigel RJ. Differential screening and suppression subtractive hybridization identified genes differentially expressed in an estrogen receptor-positive breast carcinoma cell line. Nucleic Acids Res. 1998;26:1116-1123. [PubMed] [DOI] |
| 11. | Wu S, Moreno-Sanchez R, Rottenberg H. Involvement of cytochrome c oxidase subunit III in energy coupling. Biochemistry. 1995;34:16298-16305. [PubMed] [DOI] |
| 12. | Vasioukhin V, Bowers E, Bauer C, Degenstein L, Fuchs E. Desmoplakin is essential in epidermal sheet formation. Nat Cell Biol. 2001;3:1076-1085. [PubMed] [DOI] |
| 13. | Palmer DG, Rutter GA, Tavare JM. Insulin-stimulated fatty acid synthase gene expression does not require increased sterol response element binding protein 1 transcription in primary adipocytes. Biochem Biophys Res Commun. 2002;291:439-443. [PubMed] [DOI] |
| 14. | Dehm P, Nordwig A. Influence of serum albumin on the activity of a microsomal aminopeptidase. FEBS Lett. 1970;9:225-228. [PubMed] [DOI] |
| 15. | Mandel U, Hassan H, Therkildsen MH, Rygaard J, Jakobsen MH, Juhl BR, Dabelsteen E, Clausen H. Expression of polypeptide GalNAc-transferases in stratified epithelia and squamous cell carcinomas: immunohistological evaluation using monoclonal antibodies to three members of the GalNAc-transferase family. Glycobiology. 1999;9:43-52. [PubMed] [DOI] |
| 16. | Rottger S, White J, Wandall HH, Olivo JC, Stark A, Bennett EP, Whitehouse C, Berger EG, Clausen H, Nilsson T. Localization of three human polypeptide GalNAc-transferases in HeLa cells suggests initiation of O-linked glycosylation throughout the Golgi apparatus. J Cell Sci. 1998;111:45-60. [PubMed] |
| 17. | Sutherlin ME, Nishimori I, Caffrey T, Bennett EP, Hassan H, Mandel U, Mack D, Iwamura T, Clausen H, Hollingsworth MA. Expression of three UDP-N-acetyl-alpha-D-galactosamine: polypeptide GalNAc N-acetylgalactosaminyltransferases in adenocarcinoma cell lines. Cancer Res. 1997;57:4744-4748. [PubMed] |
| 18. | Martinez-Chantar ML, Garcia-Trevijano ER, Latasa MU, Martin-Duce A, Fortes P, Caballeria J, Avila MA, Mato JM. Methionine adenosyltransferase II beta subunit gene expression provides a proliferative advantage in human hepatoma. Gastroenterology. 2003;124:940-948. [PubMed] [DOI] |
| 19. | LeGros HL Jr, Halim AB, Geller AM, Kotb M. Cloning, expression, and functional characterization of the beta regulatory subunit of human methionine adenosyltransferase (MAT II). J Biol Chem. 2000;275:2359-2366. [PubMed] [DOI] |
| 20. | Tuynder M, Susini L, Prieur S, Besse S, Fiucci G, Amson R, Telerman A. Biological models and genes of tumor reversion: cellular reprogramming through tpt1/TCTP and SIAH-1. Proc Natl Acad Sci USA. 2002;99:14976-14981. [PubMed] [DOI] |
| 21. | Harada K, Yamada A, Yang D, Itoh K, Shichijo S. Binding of a SART3 tumor-rejection antigen to a pre-mRNA splicing factor RNPS1: a possible regulation of splicing by a complex formation. Int J Cancer. 2001;93:623-628. [PubMed] [DOI] |
| 22. | Howard BR, Vajdos FF, Li S, Sundquist WI, Hill CP. Structural insights into the catalytic mechanism of cyclophilin A. Nat Struct Biol. 2003;10:475-481. [PubMed] [DOI] |
| 23. | Bunting KD, Lindahl R, Townsend AJ. Oxazaphosphorine-specific resistance in human MCF-7 breast carcinoma cell lines expressing transfected rat class 3 aldehyde dehydrogenase. J Biol Chem. 1994;269:23197-23203. [PubMed] |
| 24. | Zelvyte I, Lindgren S, Janciauskiene S. Multiple effects of alpha1-antitrypsin on breast carcinoma MDA-MB 468 cell growth and invasiveness. Eur J Cancer Prev. 2003;12:117-124. [PubMed] [DOI] |
| 25. | Edwards SH, Thompson D, Baker SF, Wood SP, Wilton DC. The crystal structure of the H48Q active site mutant of human group IIA secreted phospholipase A2 at 1.5 A resolution provides an insight into the catalytic mechanism. Biochemistry. 2002;41:15468-15476. [PubMed] [DOI] |
| 26. | Leung SY, Chen X, Chu KM, Yuen ST, Mathy J, Ji J, Chan AS, Li R, Law S, Troyanskaya OG. Phospholipase A2 group IIA expression in gastric adenocarcinoma is associated with prolonged survival and less frequent metastasis. Proc Natl Acad Sci USA. 2002;99:16203-16208. [PubMed] [DOI] |
| 27. | Koprivnjak T, Peschel A, Gelb MH, Liang NS, Weiss JP. Role of charge properties of bacterial envelope in bactericidal action of human group IIA phospholipase A2 against Staphylococcus aureus. J Biol Chem. 2002;277:47636-47644. [PubMed] [DOI] |
| 28. | Gronroos JO, Laine VJ, Nevalainen TJ. Bactericidal group IIA phospholipase A2 in serum of patients with bacterial infections. J Infect Dis. 2002;185:1767-1772. [PubMed] [DOI] |
| 29. | Koumanov KS, Momchilova AB, Quinn PJ, Wolf C. Ceramides increase the activity of the secretory phospholipase A2 and alter its fatty acid specificity. Biochem J. 2002;363:45-51. [PubMed] [DOI] |
| 30. | Jiang J, Neubauer BL, Graff JR, Chedid M, Thomas JE, Roehm NW, Zhang S, Eckert GJ, Koch MO, Eble JN. Expression of group IIA secretory phospholipase A2 is elevated in prostatic intraepithelial neoplasia and adenocarcinoma. Am J Pathol. 2002;160:667-671. [PubMed] [DOI] |
| 31. | Choudhury GG. Akt serine threonine kinase regulates platelet-derived growth factor-induced DNA synthesis in glomerular mesangial cells: regulation of c-fos AND p27(kip1) gene expression. J Biol Chem. 2001;276:35636-35643. [PubMed] [DOI] |