修回日期: 2003-05-25
接受日期: 2003-06-02
在线出版日期: 2004-01-15
目的: 研究肠型胃癌发生发展的基因表达变化.
方法: 利用肠型胃癌和相应非癌组织的mRNA通过逆转录方法, 将Cy3和Cy5两种荧光分别标记到两种cDNA上制成探针, 然后与表达谱芯片(含4 096条基因)进行杂交后扫描, 通过计算机辅助判别基因的差异表达.
结果: 肠型胃癌和相应非癌组织组织中差异表达的基因有666条, 上调表达333条, 下调表达333条. 参与细胞增生、凋亡、分化和转移调控的多种基因的表达水平发生了明显改变.
结论: 高通量、高灵敏度的cDNA微阵列芯片技术提供了全面了解肠型胃癌基因表达谱的新思路, 一些与肿瘤发生相关的差异表达基因有可能发展成为生物标记物或肿瘤早期诊断和治疗的靶点.
引文著录: 李新华, 张万岱, 王波涛, 肖冰, 张振书. 肠型胃癌基因表达的cDNA微阵列分析. 世界华人消化杂志 2004; 12(1): 16-19
Revised: May 25, 2003
Accepted: June 2, 2003
Published online: January 15, 2004
AIM: To identify a set of genes involved in the development of intestinal-type gastric carcinoma.
METHODS: Pure mRNAs from 6 cases of intestinal-type gastric carcinoma and corresponding noncancerous mucosae were reversely transcribed into cDNAs labeled with Cy5 and Cy3 dyes for probes, then mixed and hybridized with the cDNA microarray consisting of 4 096 genes, and the fluorescent signals were scanned.
RESULTS: Among total genes, 333 were up-regulated and 333 down-regulated in intestinal-type gastric cancer tissues. Within altered expression of those genes, cell-cycle regulators and growth factors were up-regulated, and the promoter genes of apoptosis were down-regulated; Oncogenes and cell-adhesion molecules were more up-regulated; The cancer progression genes were up-regulated, while the anti-cancer progression genes were down-regulated.
CONCLUSION: The quick and high-throughout method of gene expression profile by cDNA array provides us with an overview of gene changes that may involved in intestinal-type gastric cancer development, and will open up new possibilities to identify novel molecular targets for diagnosis and therapy. Several genes are altered in intestinal-type gastric cancer, which need to be further investigated.
- Citation: Li XH, Zhang WD, Wang BT, Xiao B, Zhang ZS. Gene expression profiling in intestinal-type gastric carcinoma by cDNA microarray. Shijie Huaren Xiaohua Zazhi 2004; 12(1): 16-19
- URL: https://www.wjgnet.com/1009-3079/full/v12/i1/16.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i1.16
胃癌是我国目前发病率和死亡率最高的恶性肿瘤之一[1-6], 在胃癌的形成过程中, 常伴有多个抑癌基因的失活(p53, APC, DCC等)[7-12]及多个原癌基因的扩增(k-RAS, C-MET, K-SAM和C-ERBB2)[13-17], 以及DNA修复基因异常等. 但是以上基因的变化没有一种存在于所有的胃癌, 而且不同类型的胃癌其发病机制也不尽相同. 因此从基因组整体水平系统地分析胃癌的基因表达谱[18], 系统地揭示基因在疾病发展中表达上的时空差别信息, 为全面了解正常胃黏膜到癌前变再到胃癌过程基因表达谱的变化及最终揭示胃癌的发病机制并提供诊断和治疗的靶点前进一步.
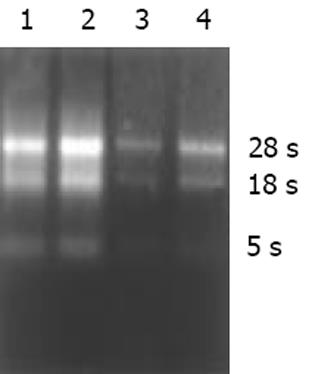
第四军医大学西京医院和第一军医大学南方医院普外科的肠型胃腺癌组织标本6例, 对照为其自身萎缩性胃炎或肠上皮化生的非癌黏膜组织. 术前患者均未接受过放疗或化疗. 全部标本均经病理切片及AB/PAS黏液组织化学染色证实. 胃癌切除手术中, 组织离体后立即在癌灶生长旺盛处取癌组织, 并剔除其他组织类型, 迅速切成多个1 cm3小块; 非癌黏膜组织为刮取所得. 在RNase-Free生理盐水中漂洗, 以去除污渍或血渍, 用冷冻管迅速置入液氮中保存备用, 此过程在组织离体后30 min内完成. 用TRIzol (GIBCO公司)试剂一步法抽提胃癌和非癌黏膜组织的总RNA, 样品经紫外分光光度计检测吸光度值, 并进行热稳定实验, 于-20 ℃和70 ℃保温1 h后电泳检测28 s, 18 s条带无降解.
以Qiagen公司Oligotex mRNA Midi Kit纯化得mRNA. 按说明书操作与紫外分析其质量. 将6例胃癌患者的癌组织及非癌组织总RNA分别等量混合, 参照Schena et al[Science 1995; 270: 467]方法逆转录标记cDNA, 用Cy3-dUTP标记非癌组织mRNA, Cy5-dUTP标记癌组织mRNA .用逆转录酶以RNA为模板反转录为单位cDNA, 乙醇沉淀后将探针混合溶解在20 L杂交液中. 所用含4 096个靶基因的cDNA microarray为复旦大学、上海博星基因芯片公司提供(型号为H40s). 以通用引物进行PCR扩增, 以Cartesian Pixsys 7 500点样仪(Cartesian公司)在硅化玻片(TeleChem公司)上进行点样; 玻片经水合、室温干燥、UV交联, 再分别用2 g/LSDS, 水及2 g/L硼氢化钠溶液处理10 min, 凉干备用. 将芯片和标记cDNA探针分别在95 ℃水浴变性5 min, 将混合的标记探针加在芯片上, 用盖玻片封片, 置于60 ℃杂交15-17 h. 解开盖玻片, 依次以2碨SC+2 g/L SDS, 1 g/L SSC+2 g/L SDS, 1 g/L SSC洗涤10 min, 室温凉干. 用ScanArray4000扫描仪(General Scanning公司)扫描芯片, 观察杂交结果, 用GenePix3.0软件分析Cy3和Cy5荧光信号强度, 用40个管家基因均衡后, 计算Cy5/Cy3值. 判定基因差异转录的标准: (1) Cy3和Cy5信号值二者皆必须大于200, 或Cy3和Cy5信号值之一必须大于800; (2)Cy5/Cy3大于2或小于0.5. (3)PCR结果良好.
癌与非癌组织抽提的总RNA中A260/A280值为1.972-2.06, 电泳显示28 s, 18 s条带无明显降解(图1).
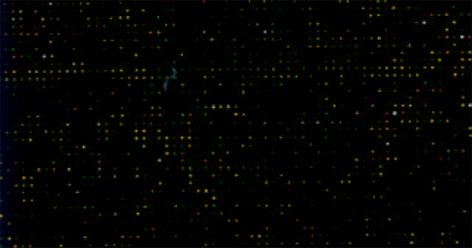
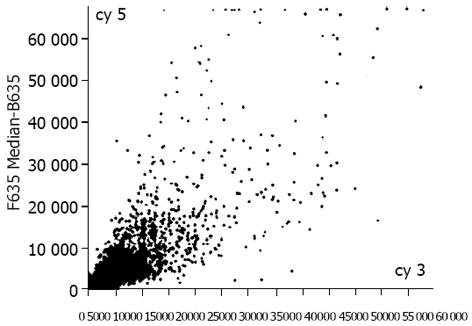
肠型胃癌组织表达谱(Cy5)扫描结果与非癌组织表达谱(Cy3)扫描结果经计算机数据叠加后产生的图像(图2), 为单个基因在2种组织中表达丰度的比值, 反应了两种组织基因表达的差异. 黄色点表示该基因在2种组织中接近; 绿色点表示Cy3信号较强, 代表该基因在非癌组织中高表达, 而癌组织低表达或不表达; 红色点代表Cy5信号强, 说明基因有上调表达趋势. 将上图经软件处理后制成杂交信号强度散点图(图3). 每个点的X轴和Y轴分别表示Cy3和Cy5荧光信号的相对强度. 若数据点为红色, 则代表Y值与X值在0.5-2.0之间, 属非差异表达; 黄点代表Y值与X值在0.5-2.0之外, 可能属于差异表达. 由图可以看出芯片上绝大多数基因在2种组织中的表达丰度一致.
按照阳性标准, 我们所用芯片上含有4096个人类基因, 在实验中一共检测到3 840个基因在胃癌和非癌组织中有表达, 其中333个在癌组织中高表达, 333个在癌组织中低表达. 差异表达的基因被分为如下几类: 癌基因和抑癌基因、离子通道和运输蛋白类、细胞周期蛋白类、细胞骨架和运动类、细胞凋亡相关蛋白类、DNA合成和修复蛋白类、DNA合成和转录因子类、细胞受体类、免疫相关类、细胞信号和传递蛋白类、代谢类、蛋白翻译合成类、发育相关类等.
人类基因组测序草图的公布, 为疾病的诊断、新药物的研制和新疗法的探索带来一场革命[19]. cDNA微阵列技术提供了高通量(high throughout)或平行监测基因表达变化和功能的新方法, 有可能成为未来生物学研究和临床诊断的通用手段. 目前该技术已应用于包括人肝癌、食管癌、结肠癌等消化系肿瘤在内的基因差异性研究中[20], 但尚罕见于正常胃黏膜到癌前变再到胃癌过程基因变化的研究, 为此我们应用cDNA微阵列同时分析4 096种细胞基因的表达, 筛选与肠型胃癌相关的已知基因, 对其进行研究将有助于了解肠型胃癌发生机制的概貌, 为诊断和治疗提供必要的理论基础.
由于遗传背景和环境因素的差别, 患同一种肿瘤的不同患者的癌细胞基因表达模式可能不尽相同[21]. 为寻找肠型胃癌患者基因表达的共同规律, 我们将6例肠型胃癌组织和相应萎缩性胃炎或肠上皮化生组织总RNA分别等量混合, 使每例样品对基因表达改变的贡献相同, 使在多数样品中呈上/下调的基因在结果中显示明显的上/下调, 结果反映了多数患者的共同趋势. 我们一共检测到666个基因在癌及非癌组织有差异表达, 其中在肠型胃癌组织中表达上调的基因333个, 表达下调的基因333个, 进一步分析显示, 在胃癌组织中, 多数对细胞增生起促进作用的基因表达上调, 起抑制作用的基因表达下调, 抗凋亡基因上调, 而促凋亡基因表达下调, 异常分化及侵袭相关基因上调, 与上细胞发育分化相关的多种蛋白酶类表达明显改变, 一些基因在胃癌中的表达变化明显不同于其他恶性肿瘤, 这些改变既构成肠型胃癌细胞特异的基因表达谱, 也是其增生失控、去分化、转移与侵袭等恶性表型的基础. 我们的结果, 胃癌组织中表达上调的有生长因子、生长因子受体信号转导通路组分及细胞周期调控因子等多种对细胞增生起正调控作用的基因(如CDC25 B, EGF, CDK, 多种泛素结合蛋白等), 而表达下调的有抑癌基因、生长抑制因子等, (如P21, growth inhibitory factor MT3, TGF-), 显示了癌细胞明显的生长失控, 而该生长调控的缺陷发生在多个层面上.其中表皮生长因子在癌组织中表达上调与Karameris et al[22]对63例胃癌组织的研究结果相似.
调节细胞程序性死亡或凋亡的基因明显与肿瘤的发展有关. 本结果中介导-TNF诱导的细胞凋亡的基因DAPK1表达下调. 而对凋亡起抑制作用的基因NM23-H6/IPIA-ALPHA和BAG5表达上调. DAPK1是新型的钙离子依赖的丝氨酸/苏氨酸蛋白激酶家族成员, 他们的结构中含重复锚定序列和死亡结构域, 与细胞骨架蛋白关联. DAP激酶的高度甲基化导致了癌细胞躲避凋亡而生长和侵袭[23]. DAPK1在胃癌细胞凋亡中的网络关系尚未见报道. 基质金属蛋白酶(matrix metalloproteinase, MMP)已有25个成员, 他们可以降解多种细胞间质成分[24]. 在胃癌组织中, MMP1, MMP2, MMP12呈明显高表达, 其中MMP2在胃癌中高表达与Monig et al[25]的结果相似, 且在有淋巴结转移的肿瘤中呈显著高表达. 目前, MMP的抑制剂用作抗侵袭药物已进入临床试验[26], 了解胃癌细胞中MMP的种类为应用MMP抑制剂进行治疗提供了基础. CD44是作为一种细胞与细胞相互作用的重要的细胞黏附蛋白因子, 所有的胃癌组织和他的转移瘤都含有CD44剪接重组子的过度表达[27,28]. 有趣的是MMP和CD44蛋白的过度表达在分化程度好的和低分化的胃癌之间不相同, 提示肠型胃癌与扩散型胃癌的发生可能有不同的遗传学途径. 由以上讨论可以看出, 胃癌细胞中基因表达的改变是非常复杂的, 决定了恶性表型的各个方面, 是多种基因共同运作的结果. 因此, 利用基因芯片高通量多角度系统地进行基因特征分析, 为我们从一个全新的视角认识胃癌的病因和发病机制提供了一个可用的方法.
编辑: N/A
| 1. | Werner M, Becker KF, Keller G, Hofler H. Gastric adenocarcinoma: pathomorphology and molecular pathology. J Cancer Res Clin Oncol. 2001;127:207-216. [PubMed] [DOI] |
| 2. | Yin T, Ji XL, Shen MS. Relationship between lymph node sinuses with blood and lymphatic metastasis of gastric cancer. World J Gastroenterol. 2003;9:40-43. [PubMed] [DOI] |
| 3. | Yang L, Kuang LG, Zheng HC, Li JY, Wu DY, Zhang SM, Xin Y. PTEN encoding product: a marker for tumorigenesis and progression of gastric carcinoma. World J Gastroenterol. 2003;9:35-39. [PubMed] [DOI] |
| 4. | Jiang YA, Zhang YY, Luo HS, Xing SF. Mast cell density and the context of clinicopathological parameters and expression of p185, estrogen receptor, and proliferating cell nuclear antigen in gastric carcinoma. World J Gastroenterol. 2002;8:1005-1008. [PubMed] [DOI] |
| 5. | Zhang H, Wu J, Meng L, Shou CC. Expression of vascular endothelial growth factor and its receptors KDR and Flt-1 in gastric cancer cells. World J Gastroenterol. 2002;8:994-998. [PubMed] [DOI] |
| 6. | Niu WX, Qin XY, Liu H, Wang CP. Clinicopathological analysis of patients with gastric cancer in 1200 cases. World J Gastroenterol. 2001;7:281-284. [PubMed] [DOI] |
| 7. | Fang DC, Luo YH, Yang SM, Li XA, Ling XL, Fang L. Mutation analysis of APC gene in gastric cancer with microsatellite instability. World J Gastroenterol. 2002;8:787-791. [PubMed] [DOI] |
| 8. | Fang DC, Jass JR, Wang DX, Zhou XD, Luo YH, Young J. Infrequent loss of heterozygosity of APC/MCC and DCC genes in gastric cancer showing DNA microsatellite instability. J Chin Pathol. 1999;52:504-508. [PubMed] [DOI] |
| 13. | Sasano H, Date F, Imatania A, Asaki S, Nagura H. Double immunostaining for c-erbB-2 and P53 in human stomach cancer cells. Hum Pathol. 1993;584-589. [DOI] |
| 14. | 郭 长青, 王 玉萍, 刘 国永, 马 社旺, 丁 贯一, 李 继昌. 胃黏膜癌变过程中的幽门螺杆菌感染与p53, c-erbB-2基因表达的研究. 世界华人消化杂志. 1999;7:313-315. [DOI] |
| 17. | Tsugawa K, Yonemura Y, Hirono Y, Fushida S, Kaji M, Miwa K, Miyazaki I, Yamamoto H. Amplification of the c-met, c-erbB-2 and epidermal growth factor receptor gene in human gastric cancers: correlation to clinical features. Oncology. 1998;55; 475-481. [PubMed] [DOI] |
| 18. | Liotta L, Peticoin E. Molecular profiling of human cancer. Nat Rev Genet. 2000;1:48-56. [PubMed] [DOI] |
| 20. | Okabe H, Satoh S, Kato T, Kitahara O, Yanagawa R, Yamaoka Y, Tsunoda T, Furukawa Y, Nakamura Y. Genome-wide analysis of gene expression in human hepatocellular carcinomas using cDNA microarray: identification of genes involved in viral carcinogenesis and tumor progression. Cancer Res. 2001;61:2129-2137. [PubMed] |
| 21. | Yasui W, Oue N, Kuraoka K, Nakayama H. Molecular diagnosis of gastric cancer. Nippon Geka Gakkai Zasshi. 2002;103:463-467. [PubMed] |
| 22. | Karameris A, Kanavaros P, Aninos D, Gorgoulis V, Mikou G, Rokas T, Niotis M, Kalogeropoulos N. Expression of epidermal growth factor(EGF)and epidermal growth factor receptor (EGFR)in gastric and colorectal carcinomas. An immunohistological study of 63cases. Pathol Res Pract. 1993;189:133-137. [PubMed] [DOI] |
| 23. | Simpson DJ, Clayton RN, Farrell WE. Preferential loss of Death Associated Protein kinase expression in invasive pituitary tumours is associated with either CpG island methylation or homozygous deletion. Oncogene. 2002;21:1217-1224. [PubMed] [DOI] |
| 24. | Cox G, O'Byrne KJ. Matrix metalloproteinases and cancer. Anticancer Res. 2001;21:4207-4219. [PubMed] |
| 25. | Monig SP, Baldus SE, Hennecken JK, Spiecker DB, Grass G, Schneider PM, Thiele J, Dienes HP, Holscher AH. Expression of MMP-2 is associated with progression and lymph node metastasis of gastric carcinoma. Histopathology. 2001;39:597-602. [DOI] |
| 26. | Bramhall SR, Hallissey MT, Whiting J, Scholefield J, Tierney G, Stuart RC, Hawkins RE, McCulloch P, Maughan T, Brown PD. Marimastat as maintenance therapy for patients with advanced gastric cancer: a randomizsed trial. Br J Cancer. 2002;86:1864-1870. [DOI] |
| 27. | Hsieh HF, Yu JC, Ho LI, Chiu SC, Harn HJ. Molecular studies into the role of CD44 variants in metastasis in gastric cancer. Mol Pathol. 1999;52:25-28. [PubMed] [DOI] |
| 28. | Chen GY, Wang DR. The expression and clinical significance of CD44v in human gastric cancers. World J Gastroenterol. 2000;6:125-127. [PubMed] [DOI] |