修回日期: 2002-12-29
接受日期: 2003-01-08
在线出版日期: 2003-09-15
建立羟基磷灰石纳米粒子体外诱导人肝癌细胞凋亡的模型, 为进一步研究纳米粒子诱导肝癌细胞凋亡的分子机制奠定基础.
用羟基磷灰石纳米粒子以不同终浓度、不同时间作用于人肝癌BEL-7402细胞, 用细胞毒性实验(MTT比色法)观察其细胞毒性, 倒置相差显微镜、荧光显微镜、透射电镜、DNA琼脂糖凝胶电泳等方法观察凋亡在形态学和生化方面的变化. 流式细胞仪分析以进一步了解凋亡发生的时间和程度.
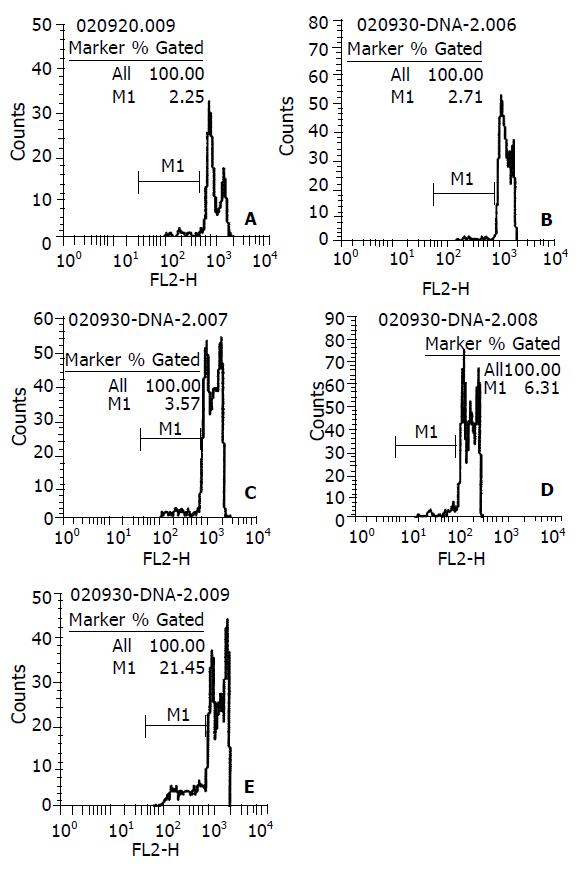
羟基磷灰石纳米粒子以剂量依赖和时间依赖的方式抑制BEL-7402细胞的生长. 50-200 mg/L的纳米粒子处理48 h后, 形态学上, 肝癌细胞表现为细胞皱缩、核质浓缩、核碎裂、细胞起泡以及凋亡小体形成等凋亡特征. 琼脂糖凝胶电泳观察到DNA"梯带". 流式细胞仪定量分析, 0, 50、75、100、150、200 mg/L 浓度下凋亡率分别为2.2%, 20.3%, 25.3%, 29.8%, 45.1%和53.1%. 50 mg/L作用12 h后肝癌细胞出现凋亡, 48 h达高峰, 12, 24, 36, 48 h细胞凋亡率分别为2.7%, 3.5%, 6.3%和21.4%.
羟基磷灰石纳米粒子既能抑制人肝癌BEL-7402细胞增生, 又能诱导其凋亡, 该凋亡模型的成功建立将有助于进一步探讨纳米粒子诱导肝癌细胞凋亡的分子机制.
引文著录: 刘志苏, 唐胜利, 艾中立, 孙权, 钱群, 何跃明, 朱忠超. 羟基磷灰石纳米粒子诱导人肝癌细胞凋亡模型的构建. 世界华人消化杂志 2003; 11(9): 1357-1361
Revised: December 29, 2002
Accepted: January 8, 2003
Published online: September 15, 2003
To establish an apoptotic model induced by hydroxyapatite (HAP) nanoparticles in human hepatoma cell line in vitro in order to explore the mechanism of nanoparticles-induced apoptosis.
The selected human hepatoma cell line BEL-7402 was treated with HAP nanoparticles at different concentrations and for various durations of time. Growth suppression was evaluated by MTT method. Apoptosis-related alterations in morphology and biochemistry were ascertained under cytochemical staining (Hoechst 33 258), transmission electron microscopy (TEM), and DNA agarose gel electrophoresis. Flow cytometry (FCM) was used to investigate the apoptotic rate.
HAP nanoparticles inhibited the growth of hepatoma cells in a dose and time-dependent manner. After BEL-7402 cells were treated with 50-200 mg/L HAP nanoparticles for 48 h, apoptosis with nuclear chromatin condensation and fragmentation as well as cell shrinkage were observed using fluorescent staining and TEM. DNA ladder could be demonstrated on DNA electrophoresis. By FCM analysis, the apoptotic rates at concentrations of 0 mg/L, 50 mg/L,75 mg/L, 100 mg/L, 150 mg/L, 200 mg/L were 2.2%, 20.3%, 25.3%, 29.8%, 45.1% and 53.1%, respectively. Cell apoptosis began approximately at 12h after administration of 50 mg/L and peaked at 48 h following treatment. The rates at 12, 24, 36, and 48 h were 2.7%, 3.5%, 6.3%, and 21.4%, respectively.
HAP nanoparticles not only inhibit proliferation but also induce apoptosis of human hepatoma cell line BEL-7402 in vitro. The successful establishment of this model will help further explore the molecular mechanism of hepatoma cells apoptosis.
- Citation: Liu ZS, Tang SL, Ai ZL, Sun Q, Qian Q, He YM, Zhu ZC. Establishment of apoptotic model induced by hydroxyapatite nanoparticles in human hepatoma cell line BEL-7402. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1357-1361
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1357.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1357
纳米技术1990年代取得了突破性进展, 其在医学领域的应用开创了纳米医学研究的新篇章. 羟基磷灰石纳米粒子(hydroxyapatite nanoparticles)是随之发展起来的一种新型纳米材料. 已有研究发现其对癌细胞的生长有抑制作用, 且抗瘤谱广, 但在诱导癌细胞凋亡方面国内外尚未见报道. 我们从羟基磷灰石纳米粒子诱导人肝癌BEL-7402细胞凋亡的角度探讨其抑制癌细胞生长的机制, 为纳米材料用于临床提供理论依据和实验依据.
羟基磷灰石纳米粒子由华东理工大学生物材料中心提供, 用培养液配制成浓度400 mg/L的溶胶, 0.22 mm滤膜过滤除菌备用; RNase酶、蛋白酶K、碘化丙啶(PI)及Hoechst 32258荧光染色剂购于Sigma公司; RPMI1640培养基、小牛血清、MTT购自Gibco公司; MODEL2300型CO2培养箱, Shellab公司; BH-2型荧光显微镜, Olympus公司; Hitachi-600型透射电镜, 日立公司; FACSort流式细胞仪, Becton Dickinson公司. 人肝癌细胞系BEL-7402, 武汉大学中国典型培养物保藏中心(CCTCC)提供, 培养于含100 mL/L小牛血清的RPMI1 640培养液中, 37 °C, 50 mL/L CO2 培养箱内常规传代培养. 细胞贴壁生长2 4 h, 至70-80%单层后更换含药培养基进行实验.
细胞毒性实验(MTT比色法)参考(Hussain J Immunol Methods 1993; 160: 89)方法, 取密度为2×108/L的细胞接种于96孔培养板中每孔200 mL, 培养24 h后, 弃原培养液, 加含不同浓度药物的新培养液, 各为200, 50, 12.5 mg/L及对照(0 mg/L), 每浓度设8个复孔, 分别作用24, 48, 72 h后, 加入新配制的MTT液每孔20 mL, 置37 °C CO2培养箱内培养作用4h, 小心吸去上清液, 加入二甲亚砜(DMSO) 150 mL, 在振荡器上轻轻振荡5 min后, 用酶标仪于490 nm处测吸光度值(A值). 取8孔平均值, 计算抑制率. 根据公式: 细胞抑制率=(1- 实验组A值/对照组A值)×100%, 以横坐标为时间, 纵坐标为抑制率, 绘制细胞生长抑制曲线. 预定时间倒置相差显微镜观察不同浓度作用的细胞的生长情况. 收集200, 150, 100, 75, 50, 0 mg/L (对照)药物作用48 h后的肝癌细胞, 离心, PBS缓冲液洗涤, 3:1甲醇/冰醋酸固定液固定10 min, 再离心, 留取少量固定液悬浮细胞; 于盖玻片上用荧光染液Hochest33258染色45 min; 将有细胞一面的盖玻片封盖在预滴封片液的载玻片上, 自然晾干, 在BH-2荧光显微镜下观察并摄影. 收集接种于T-25培养瓶内, 经100 mg/L药物处理48 h后的细胞, 30 g/L戍二醛固定, 再用10 g/L锇酸固定, 逐级酒精脱水, 氧化丙烯浸透, 树脂包埋, 超薄切片机切片, 于透射电子显微镜下观察并摄影. 细胞溶解于裂解缓冲液400mL中,4°C 12 000 r/min离心15 min, 收集上清, 加蛋白酶K及RNase置50 °C孵育2 h. 再加入NaCl及同体积异丙醇-20 °C过夜 , 离心去上清, 700 mL/L乙醇溶解沉淀, 离心后空气干燥. 加TE 9 mL和载样缓冲液1 mL, 15 g/L琼脂糖凝胶, 35V电压, 电泳2h. 紫外灯下观察并摄影. 收集经羟基磷灰石纳米粒子(0, 50, 75, 100, 150, 200 mg/L)处理48 h和50 mg/L浓度处理12, 24, 36, 48 h的细胞, 用胰酶消化制成单细胞悬液, 离心弃上清, 沿管壁缓慢加入700 mL/L预冷(-20 °C)乙醇1 mL固定, (注意边加边振荡, 以免细胞成团), 4 °C过夜后再经PBS洗2次, 100 mL RNA酶(100 mg/L)消化, 37 °C 30 min, 再加入50 mg/L PI染色液100 mL, 4 °C避光30 min后上机测试, 采用FACScort流式细胞仪对样品进行检测, 每次计细胞数6 000个, 激发波长488 nm, 分析软件CellQuest计算凋亡率.
统计学处理 所有实验数据均以表示, 用SPSS 11.0软件进行统计分析, 实验组与对照组比较行t 检验.
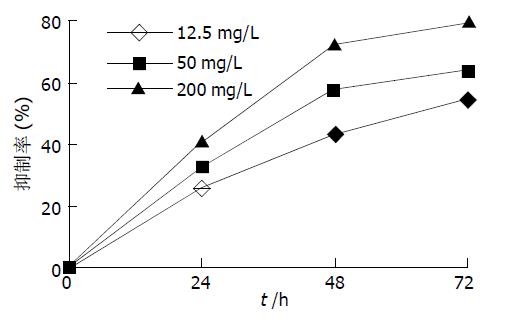
MTT检测结果显示纳米粒子对肝癌细胞的抑制率均随着剂量的增大和作用时间的延长而增强, 同时间不同浓度组与其对照组比较均有极显著性差异(表1, 图1).
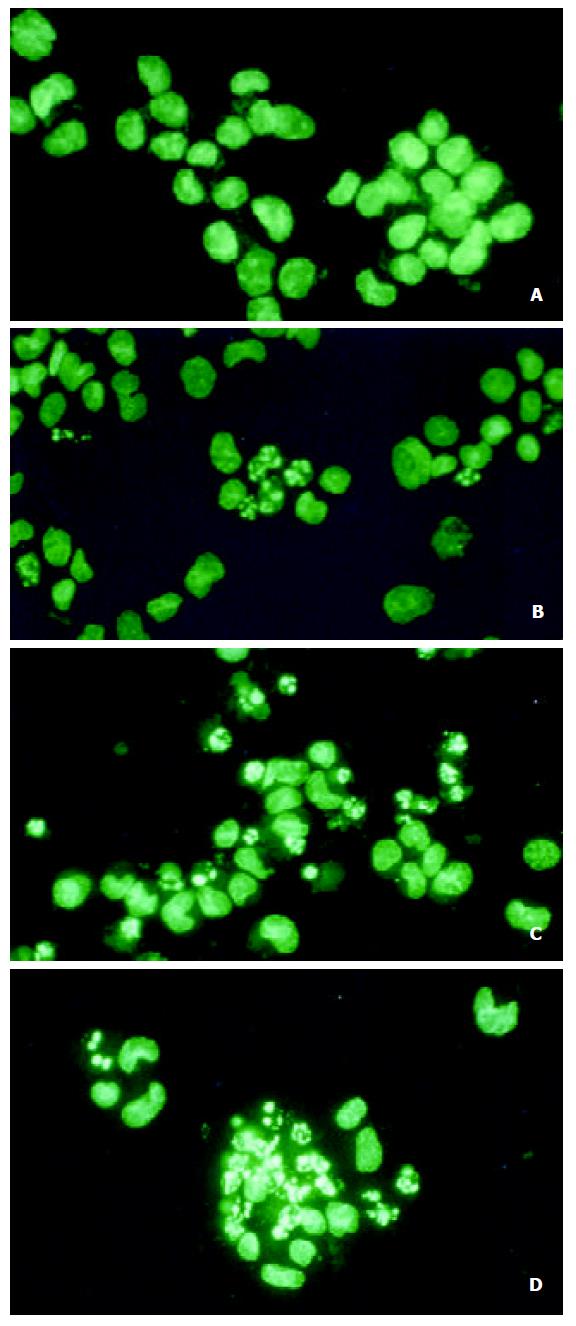
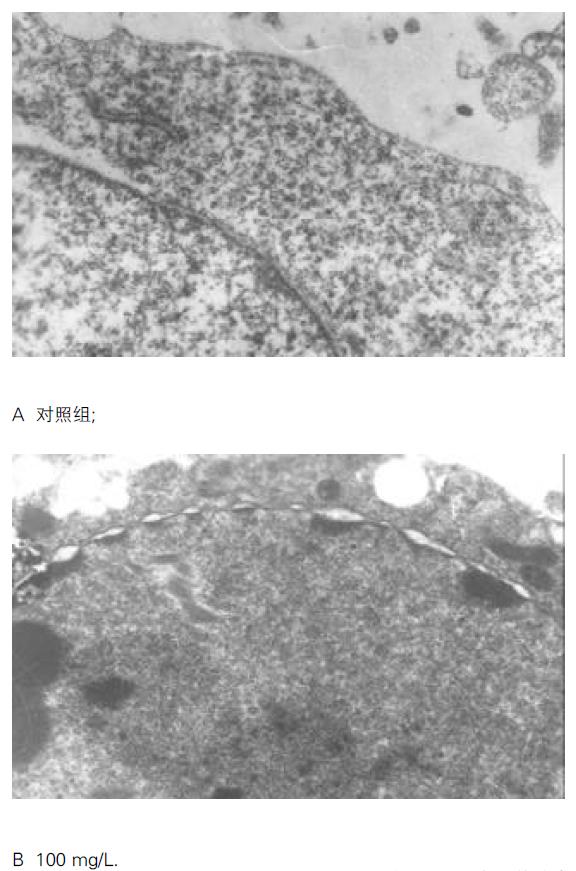
倒置相差显微镜下见对照组肝癌细胞贴壁生长, 核膜、核仁轮廓明显, 核糖体颗粒丰富胞质饱满, 相邻细胞生长融合成片; 经HAP处理的各组细胞, 24 h后观察见细胞逐渐由贴壁而脱落, 48 h脱落更明显, 脱落细胞悬浮于培养液中, 细胞形态变圆, 折光性差, 生长增生明显受抑. 细胞经Hoechst 33258染色后, 荧光显微镜下见对照组BEL-7402细胞胞膜完整, 胞质丰富, 核形态饱满, 表现为弥散均匀的蓝色荧光.而处理组可见核体积缩小, 荧光染色增强, 染色质呈致密浓染的块状或颗粒状荧光以及凋亡小体形成, 呈现典型的凋亡形态特征. 而且随浓度增加凋亡细胞增多 (图2). 镜下计算各浓度组凋亡率, 50, 75, 100, 150, 200 mg/L分别为18.7%、22.3%、33.5%、49.0%和57.2%. 透射电镜观察下对照组细胞胞质密度高, 细胞器正常, 染色质均匀分散、密度一致, 核膜完整, 核仁大且完整(图3 A); 而经羟基磷灰石纳米粒子处理的细胞发生皱缩, 胞质空泡形成, 细胞核固缩、染色质凝集、染色质聚集于核膜周边形成数个团块或境界分明的新月形小体(图3 B).
不同浓度羟基磷灰石纳米粒子作用48 h后, 对照组仅显示基因组, 当浓度为100 mg/L, 200 mg/L时出现典型的梯状带.
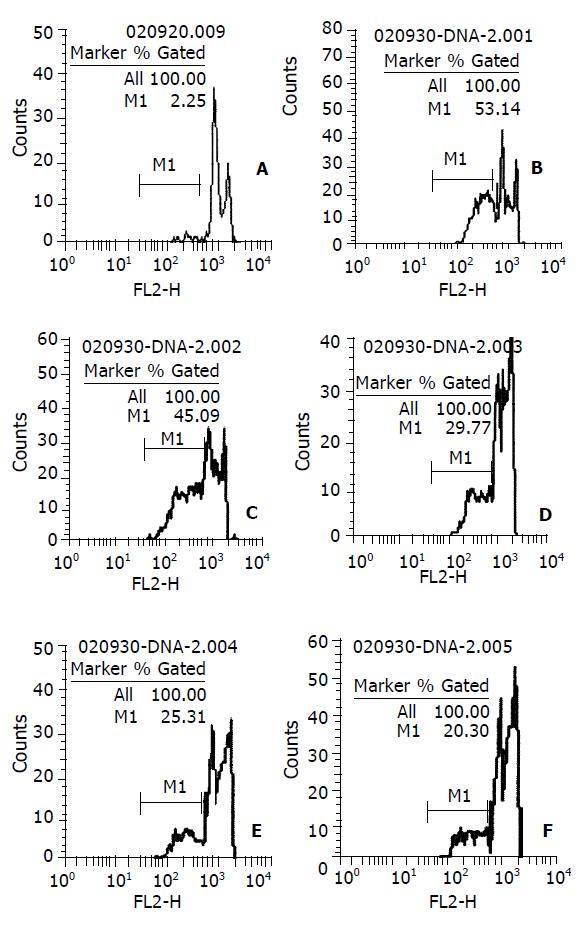
DNA直方图上可见亚二倍体峰(即AP峰apoptotic peak), 此一低DNA含量的亚二倍体峰的百分比, 即为细胞的凋亡率(图4). 0, 50、75、100、150、200 mg/L 羟基磷灰石纳米粒子作用48 h后的细胞凋亡率分别为2.2%, 20.3%, 25.3%, 29.8%, 45.1%和53.1%. 相关分析示二者呈高度正相关(r =0.994, P <0.01); 回归方程为y凋亡率=0.0842+0.0023 x浓度, 计算得半数有效凋亡浓度EC50 =181.82 mg/L. 50 mg/L作用12, 24, 36, 48 h凋亡率为2.7%, 3.5%, 6.3%和21.4%(图5).
肿瘤的发生和发展不仅与细胞的分化异常及增生过度有关, 而且与其细胞凋亡的减少密切相关[1-8]. 而一旦细胞增生与凋亡失控, 则可导致肿瘤的发生[9-25]. 因此, 开发诱导肿瘤细胞凋亡的新药, 成为肿瘤治疗的新方向. 迄今为止, 已证实化疗药物、生长抑素类似物、砷剂及多种中药成分[26-37] 都能以诱导细胞凋亡的方式抑制肿瘤细胞生长.羟基磷灰石[Ca10(PO4)6(OH)2]简称HAP是人类骨无机组成的主要成分, 有很好的组织相容性及黏附性, 其粉末用作骨缺损部位的填补材料已被广泛应用于临床. 本研究所用羟基磷灰石纳米粒子由溶胶-凝胶法合成, 其粒径为50 nm左右, 介于0.1-100 nm(纳米级范围)间, 表现出纳米粒子所独有的小尺寸效应, 表面与界面效应, 量子尺寸效应, 宏观量子隧道效应, 具有高溶解度, 高表面能, 强的离子交换能力, 强极化力等特性. 作用于体外培养的人肝癌BEL-7402细胞后, MTT毒性实验显示其对肝癌细胞的生长增生具有较强的抑制作用, 呈明显的剂量效应和时间效应关系. 低浓度时即有明显的抑制作用, 高浓度时此作用更强; 24 h时细胞抑制率都未达到50%, 48h时是BEL-7402细胞对羟基磷灰石纳米粒子作用较敏感的时期, 抑制率升高非常明显, 作用72h抑制率继续升高, 但增幅并不大. 这一结果与文献报道羟基磷灰石溶胶(HAP Sol)对W-256癌肉瘤细胞和艾氏腹水瘤细胞作用24 h后, 半数有效抑制浓度分别为189 mg/L和210 mg/L相当. MTT毒性实验结果有助于指导羟基磷灰石纳米粒子的实际应用, 便于选择合适的浓度和作用时间.
倒置相差显微镜亦显示羟基磷灰石纳米粒子作用后, 肝癌细胞贴壁能力下降, 细胞悬浮于培养液中, 浓度越高, 作用时间越长, 悬浮细胞越多, 与MTT毒性实验结果相一致. 荧光显微镜和透射电镜示细胞凋亡形态学上的变化, 可见细胞体积缩小, 胞膜皱缩, 核固缩, 核质沿核膜浓缩边集, 形成数个团块或境界分明的新月形小体, 有的细胞核碎裂, 形成由膜状物包裹内容物凋亡小体. 琼脂糖凝胶电泳显示DNA梯状带型, 呈细胞凋亡典型的生化改变, 并且浓度越高, 梯状带型越明显.
FCM分析则定量检测细胞凋亡, 其结果与MTT法所示剂量依赖效应和时间依赖效应相一致.不同浓度作用48 h后细胞凋亡率与荧光显微镜下计数结果相符合, 相关分析示细胞凋亡率与浓度呈高度正相关; 回归分析得半数有效凋亡浓度EC50=181.82 mg/L, 而在MTT毒性实验中, 同一浓度作用48 h后的细胞抑制率接近70%. 此结果表明羟基磷灰石纳米粒子对人肝癌BEL-7402细胞的抑制作用中, 诱导细胞凋亡占主要作用.纵观不同浓度的细胞抑制率和凋亡率, 纳米粒子浓度越高, 诱导细胞凋亡作用越强. 浓度为50 mg/L的纳米粒子作用不同时间后, 36 h凋亡率都较低, 小于10%, 48 h增至21.64%, 说明48 h后羟基磷灰石纳米粒子对BEL-7402细胞的凋亡诱导作用可达到高峰. 因此实际应用中作用时间应以48 h或更长时间为宜, 以达到较好的凋亡诱导率.
总之, 本实验结果表明在体外羟基磷灰石纳米粒子能以诱导细胞凋亡的方式抑制肝癌细胞的生长. 该凋亡模型的成功建立, 为进一步探讨细胞凋亡发生的机制奠定了基础.
| 1. | He SW, Shen KQ, He YJ, Xie B, Zhao YM. Regulatory effect and mechanism of gastrin and its antagonists on colorectal carcinoma. World J Gastroenterol. 1999;5:408-416. [DOI] |
| 2. | Tian G, Yu JP, Luo HS, Yu BP, Yue H, Li JY, Mei Q. Effect of nimesulide on proliferation and apoptosis of human hepatoma SMMC-7721 cells. World J Gastroenterol. 2002;8:483-487. [DOI] |
| 3. | Tao HQ, Zou SC. Effect of preoperative regional artery chemotherapy on proliferation and apoptosis of gastric carcinoma cells. World J Gastroenterol. 2002;8:451-454. [DOI] |
| 4. | Liu S, Wu Q, Ye XF, Cai JH, Huang ZW, Su WJ. Induction of apoptosis by TPA and VP-16 is through translocation of TR3. World J Gastroenterol. 2002;8:446-450. [DOI] |
| 5. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [DOI] |
| 6. | Tanaka S, Akaike T, Fang J, Beppu T, Ogawa M, Tamura F, Miyamoto Y, Maeda H. Antiapoptotic effect of haem oxygenase-1 induced by nitric oxide in experimental solid tumour. Br J Cancer. 2003;88:902-909. |
| 7. | Shigeno M, Nakao K, Ichikawa T, Suzuki K, Kawakami A, Abiru S, Miyazoe S, Nakagawa Y, Ishikawa H, Hamasaki K. Interferon-alpha sensitizes human hepatoma cells to TRAIL-induced apoptosis through DR5 upregulation and NF-kappaB inactivation. Oncogene. 2003;22:1653-1662. |
| 8. | Perez EA, Gandara DR, Edelman MJ, O'Donnell R, Lauder IJ, DeGregorio M. Phase I trial of high-dose tamoxifen in combination with cisplatin in patients with lung cancer and other advanced malignancies. Cancer Invest. 2003;21:1-6. |
| 9. | Lin HL, Lui WY, Liu TY, Chi CW. Reversal of Taxol resistance in hepatoma by cyclosporin A: involvement of the PI-3 kinase-AKT 1 pathway. Br J Cancer. 2003;88:973-980. |
| 10. | Yamashita H, Iwase H, Toyama T, Fujii Y. Naturally occurring dominant-negative Stat5 suppresses transcriptional activity of estrogen receptors and induces apoptosis in T47D breast cancer cells. Oncogene. 2003;22:1638-1652. [DOI] |
| 11. | Shen ZY, Shen J, Li QS, Chen CY, Chen JY, Yi Z. Morphological and functional changes of mitochondria in apoptotic esophageal carcinoma cells induced by arsenic trioxide. World J Gastroenterol. 2002;8:31-35. [DOI] |
| 12. | Shen ZY, Shen WY, Chen MH, Shen J, Cai WJ, Yi Z. Nitric oxide and calcium ions in apoptotic esophageal carcinoma cells induced by arsenite. World J Gastroenterol. 2002;8:40-43. [DOI] |
| 13. | Sun ZJ, Pan CE, Liu HS, Wang GJ. Anti-hepatoma activity of resveratrol in vitro. World J Gastroenterol. 2002;8:79-81. [DOI] |
| 14. | Wu YL, Sun B, Zhang XJ, Wang SN, He HY, Qiao MM, Zhong J, Xu JY. Growth inhibition and apoptosis induction of Sulindac on Human gastric cancer cells. World J Gastroenterol. 2001;7:796-800. [DOI] |
| 15. | Li J, Yang XK, Yu XX, Ge ML, Wang WL, Zhang J, Hou YD. Overexpression of p27 (KIP1) induced cell cycle arrest in G (1) phase and subsequent apoptosis in HCC-9204 cell line. World J Gastroenterol. 2000;6:513-521. |
| 16. | Chen YN, Chen JC, Yin SC, Wang GS, Tsauer W, Hsu SF, Hsu SL. Effector mechanisms of norcantharidin-induced mitotic arrest and apoptosis in human hepatoma cells. Int J Cancer. 2002;100:158-165. [DOI] |
| 17. | Sun BH, Zhao XP, Wang BJ, Yang DL, Hao LJ. FADD and TRADD expression and apoptosis in primary hepatocellular carcinoma. World J Gastroenterol. 2000;6:223-227. |
| 18. | Pals DR, Thompson CB. Cell metabolism in the regulation of programmed cell death. Trends Endocrinol Metab. 2002;13:75-78. |
| 19. | Shan CM, Li J. Study of apoptosis in human liver cancers. World J Gastroenterol. 2002;8:247-252. [DOI] |
| 20. | Misawa M, Tauchi T, Sashida G, Nakajima A, Abe K, Ohyashiki JH, Ohyashiki K. Inhibition of human telomerase enhances the effect of chemotherapeutic agents in lung cancer cells. Int J Oncol. 2002;21:1087-1092. [DOI] |
| 21. | Shoieb AM, Elgayyar M, Dudrick PS, Bell JL, Tithof PK. In vitro inhibition of growth and induction of apoptosis in cancer cell lines by thymoquinone. Int J Oncol. 2003;22:107-113. [DOI] |
| 22. | Satomi D, Takiguchi N, Koda K, Oda K, Suzuki H, Yasutomi J, Ishikura H, Miyazaki M. Apoptosis and apoptosis-associated gene products related to the response to neoadjuvant chemotherapy for gastric cancer. Int J Oncol. 2002;20:1167-1171. |
| 23. | Tu SP, Zhong J, Tan JH, Jiang XH, Qiao MM, Wu YX, Jiang SH. Induction of apoptosis by arsenic trioxide and hydroxy camptothecin in gastriccancer cells in vitro. World J Gastroenterol. 2000;6:532-539. |
| 24. | Zhao AG, Zhao HL, Jin XJ, Yang JK, Tang LD. Effects of Chinese Jianpi herbs on cell apoptosis and related gene expression in human gastric cancer grafted onto nude mice. World J Gastroenterol. 2002;8:792-796. [DOI] |
| 25. | Li JM, Zhou H, Cai Q, Xiao GX. Role of mitochondrial dysfunction in hydrogen peroxide-induced apoptosis of intestinal epithelial cells. World J Gastroenterol. 2003;9:562-567. [DOI] |
| 26. | Ma L, Tai H, Li C, Zhang Y, Wang ZH, Ji WZ. Photodynamic inhibitory effects of three perylenequinones on human colorectal carcinoma cell line and primate embryonic stem cell line. World J Gastroenterol. 2003;9:485-490. [DOI] |
| 27. | Zhang JK, Li J, Zhang J, Chen HB, Chen SB. Antitumor immunopreventive and immunotherapeutic effect in mice induced by hybrid vaccine of dendritic cells and hepatocarcinoma in vivo. World J Gastroenterol. 2003;9:479-484. [DOI] |
| 28. | Li QF, Ou-Yang GL, Peng XX, Hong SG. Effects of tachyplesin on the regulation of cell cycle in human hepatocarcinoma SMMC-7721 cells. World J Gastroenterol. 2003;9:454-458. [DOI] |
| 29. | Zhou HB, Zhu JR. Paclitaxel induces apoptosis in human gastric carcinoma cells. World J Gastroenterol. 2003;9:442-445. [DOI] |
| 30. | Zhou HB, Yan Y, Sun YN, Zhu JR. Resveratrol induces apoptosis in human esophageal carcinoma cells. World J Gastroenterol. 2003;9:408-411. [DOI] |
| 31. | Liu WB, Yang CQ, Jiang W, Wang YQ, Guo JS, He BM, Wang JY. Inhibition on the production of collagen type I, III of activated hepatic stellate cells by antisense TIMP-1 recombinant plasmid. World J Gastroenterol. 2003;9:316-319. [DOI] |
| 32. | Huang ZH, Fan YF, Xia H, Feng HM, Tang FX. Effects of TNP-470 on proliferation and apoptosis in human colon cancer xenografts in nude mice. World J Gastroenterol. 2003;9:281-283. [DOI] |
| 33. | Wu BW, Wu Y, Wang JL, Lin JS, Yuan SY, Li A, Cui WR. Study on the mechanism of epidermal growth factor-induced proliferation of hepatoma cells. World J Gastroenterol. 2003;9:271-275. [DOI] |
| 34. | Chen C, Liu FK, Qi XP, Li JS. The study of chemiluminescence in gastric and colonic carcinoma cell lines treated by anti-tumor drugs. World J Gastroenterol. 2003;9:242-245. [DOI] |
| 35. | Xie DP, Chen LB, Liu CY, Liu JZ, Liu KJ. Effect of oxytocin on contraction of rabbit proximal colon in vitro. World J Gastroenterol. 2003;9:165-168. [DOI] |
| 36. | Shi M, Wang FS, Wu ZZ. Synergetic anticancer effect of combined quercetin and recombinant adenoviral vector expressing human wild-type p53, GM-CSF and B7-1 genes on hepatocellular carcinoma cells in vitro. World J Gastroenterol. 2003;9:73-78. [DOI] |
| 37. | Liu JW, Tang Y, Shen Y, Zhong XY. Synergistic effect of cell differential agent-II and arsenic trioxide on induction of cell cycle arrest and apoptosis in hepatoma cells. World J Gastroenterol. 2003;9:65-68. [DOI] |