修回日期: 2003-02-03
接受日期: 2003-03-10
在线出版日期: 2003-09-15
探讨人原发性肝细胞肝癌中纺锤体组装关卡hsMAD2蛋白的表达及其意义.
采用免疫组织化学SABC法检测了hsMAD2在39例HCC组织、26例肝硬化组织和3例HCC细胞系的表达情况, 并分析了其阳性率与HCC病理分级的关系.
59% (23/39)的HCC组织表达hsMAD2, 而癌旁肝组织的阳性率为100% (15/15); 肝硬化为92% (24/26), 3例HCC细胞系均未见表达.hsMAD2在HCC中表达率与HCC病理分级无关, 而在癌组织与癌旁肝组织(x2=6.888, P <0.01)、肝硬化组织(x2=8.656, P <0.01)之间的差异具有显著性.
hsMAD2在HCC组织中的表达率相对于癌旁肝组织和肝硬化组织显著降低, 提示该蛋白的表达可能与早期HCC发生相关.
引文著录: 李擒龙, 王文亮, 张晓晖, 晏伟. 纺锤体组装关卡基因hsMAD2在人肝细胞肝癌中的表达及其意义. 世界华人消化杂志 2003; 11(9): 1326-1328
Revised: February 3, 2003
Accepted: March 10, 2003
Published online: September 15, 2003
To study the expression of hsMAD2 in primary human hepatocellular carcinoma(HCC) tissues and its significance.
The expression of hsMAD2 was detected with immunohistochemical SABC method in 39 cases of HCC tissue and 26 cases of liver cirrhosis tissue and 3 cases of HCC cell lines, and the relationship between HCC pathological grade and hsMAD2 expression rate was analyzed.
Fifty nine percent (23/39) of HCC tissues expressed hsMAD2, the positive rate was 100% (15/15) in non-tumor liver cells adjacent to HCC and 92% (24/26) in cirrhosis tissues. No expression was found in 3 cases of HCC cell lines. There was no significant difference between pathological grade and expression rate of hsMAD2.However, there was a significant difference of expression of hsMAD2 between HCC tissues and cancerous tissues arrounding liver tissues (x2=6.888, P <0.01) and liver cirrhosis tissues(x2=8.656, P <0.01).
Expression rate of hsmad2 in HCC decreases significantly compared to surrounding liver tissues and liver cirrhosis tissues. hsMAD2 is possibly related to early pathogenesis of HCC.
- Citation: Li QL, Wang WL, Zhang XH, Yan W. Expression of hsMAD2 in Human Hepatocellular carcinoma and its significance. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1326-1328
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1326.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1326
原发性肝细胞肝癌(primary human hepatocellular carcinoma, HCC)是消化系统常见的恶性肿瘤之一[1-8], 已经成为严重危害人类生命的主要疾病, 其发病率在我国肝病患者中有明显增加趋势, 其诊断和防治亟待解决[9-12]. 但有关HCC的发病机制仍未完全清楚. hsMAD2(human, mitotic arrest deficient-2, hsMAD2)是监控有丝分裂时纺锤体行为的最重要的关卡(checkpoint)基因之一. 这类基因可能控制着最初的癌变过程, 因为MAD基因控制着的关卡(纺锤体组装关卡)的失效会导致染色体畸变和基因组的不稳定. 有关人HCC的hsMAD2表达, 及其与HCC病理分级之间的关系, 目前尚未见报道. 我们采用免疫组化技术结合组织病理学观察, 检测了hsMAD2在HCC、癌旁、肝硬化组织和HCC细胞系的表达与分布情况, 分析其阳性率与HCC病理分级的关系, 并探讨hsMAD2在HCC发生和发展中可能的作用及意义.
HCC39例、肝硬化组织标本26例, 为第四军医大学西京医院病理科经病理诊断证实. HCC参照WHO病理分级标准划分等级, 包括I级(HCCI, 肿瘤细胞分化程度高)13例, II级(HCCII, 肿瘤细胞分化程度中等)16例和III级(HCCIII, 肿瘤细胞分化程度低)10例. 在39例HCC中, 15例伴有癌旁肝组织. 所有标本均经中性甲醛固定, 石蜡包埋, 5 mm厚连续切片. 3例HCC细胞系HepG2、SMMC-7721和HCC, 均为本室保存. 羊抗人hsMAD2 (C-19)多克隆抗体为美国SantaCruz公司产品. 生物素标记的兔抗山羊IgG为北京中山公司产品. 免疫组化SABC试剂盒武汉博士德公司产品. DAB为华美公司产品.
将细胞培养在含100 mL/L胎牛血清的PRMI 1 640培养液中, 在各组细胞培养皿中分别加入已消毒的玻璃盖玻片, 分别接种转染后的细胞约1×105个. 待细胞进入对数生长期后, 取出盖玻片, 用pH7.4的PBS洗涤3次, 再用950 mL/L酒精固定1 h. 自然晾干后, -20 °C冰箱保存备用. 免疫细胞与组织化学染色, 按照博士德公司SABC试剂盒操作步骤进行, 每次染色时均用PBS代替hsMAD2作为阴性对照. 以多次重复实验证明为hsMAD2阳性的1例乳腺癌为阳性对照. 同时用抗生物素(avidin)排除了内源性生物素的干扰. 数据处理采用网格测试法[13], 每例选择10个40倍视野, 向同一方向移动切片, 不重复, 不重叠, 按照hsMAD2阳性细胞数占视野中总细胞数的百分比分为阴性、阳性. 无阳性着色或阳性细胞率小于5%者为阴性(-); 阳性细胞率在大于5%为阳性(+). 采取2人双盲法阅片, 观察结果应一致.
统计学处理 对数据采用SPSS软件进行样本率的x2检验.
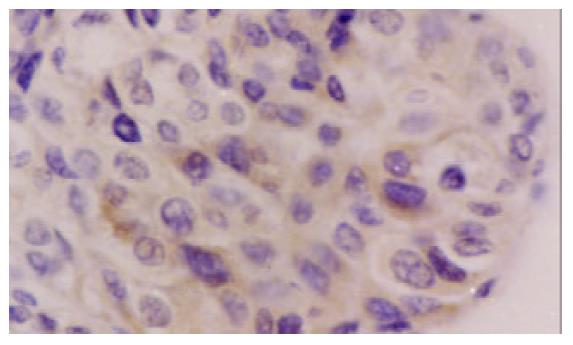
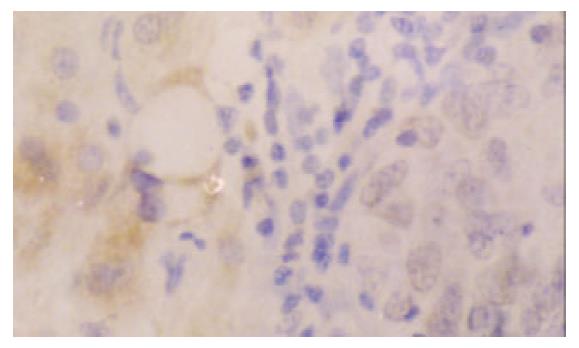
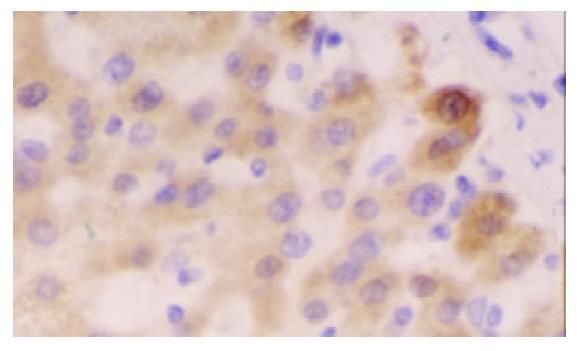
hsMAD2阳性的细胞主要为细胞质着色, 呈棕黄色、细颗粒状, 少部分细胞有细胞核和细胞质同时着色; hsMAD2在HCC中的阳性表达以弥漫性弱阳性为主, 偶见局灶性强阳性表达; 癌旁肝组织特别是癌旁肝硬化组织的表达普遍为较强阳性, 部分肝硬化组织中胆管上皮也可见阳性着色(图1-3); 所有阴性对照均无阳性着色. hsMAD2在HCC中表达的阳性率为59% (23/39), 其中HCCI62% (8/13)、HCCII56% (9/16)、HCCIII60% (6/10); 癌旁肝组织的阳性率为100% (15/15); 肝硬化为92% (24/26). 3例HCC细胞系(HepG2, SMMC-7721和HHCC)均为阴性表达.
经x2检验, HCC中hsMAD2表达率与癌旁肝组织比较 (x2=6.888, P <0.01)、与肝硬化组织比较x2=8.656, P <0.01) 差异均具有显著性, 但在HCC各病理分级之间无显著性差异.
HCC常见, 位居我国恶性肿瘤发病的第3位, 约占全世界HCC病例的42.5%, 每年死于HCC的人数约为11万[14]. HCC复发率高, 预后较差[15-20]. 有关HCC的发病机制, 目前仍不完全清楚.
目前认为以MAD2基因为代表的这类基因可能控制着最初的癌变过程, 因为MAD基因控制着的关卡的失效会导致染色体畸变和基因组的不稳定(Science 1996;274(5285):246-248). hsMAD2在结肠癌、肺癌、胃癌[21]乳腺癌[22]和膀胱癌[23]的突变率都很低, 但在乳腺癌[22]、卵巢癌[24]细胞系和肺癌、鼻咽癌[25]的蛋白表达降低, 而且, 我们此前在急性白血病中以半定量RT-PCR的方法研究也发现hsMAD2的表达较正常明显降低[26]. 我们应用免疫细胞与组织化学检测技术, 初步检测了hsMAD2在HCC、癌旁肝组织和肝硬化中的表达与分布情况, 结果表明: hsMAD2在HCC组织的检出率(59%)明显低于肝硬化(92%)和癌旁肝组织(100%), 存在着显著的统计学差别(P <0.01); 而且, hsMAD2在HCC中的阳性表达以弥漫性弱阳性为主, 偶见局灶性强阳性表达, 而在癌旁肝组织特别是癌旁的肝硬化组织的表达普遍为较强阳性; 在检测的3例HCC细胞系中, 更是全部为阴性表达. 因此可以推测, hsMAD2表达的降低或缺失可能与HCC的发生演进之间存在某种联系. 另外, 在HCC各病理分级之间无显著性差异, 说明hsMAD2的表达降低或缺失可能主要在HCC的早期发生中具有某些作用. hsMAD2能与CDC20 (cell division cycle control protein)结合, 后者能直接结合并活化APC(anaphase- promoting complex), 而APC的活化是哺乳动物细胞分裂后期开始和细胞分裂完成所必需的, hsMAD2的功能在于当其与CDC20结合后, 抑制CDC20对APC的活化, 从而引起细胞停滞在分裂的中-后期, 使细胞周期受阻[27,28]. 理论上, 纺锤体组装关卡失常可以导致复制后的染色体在两个子细胞中分布不均, 即产生非整倍体, 并导致基因组不稳定性, 多基因突变的原因可能即在于此. 据此我们推测, 在HCC的发生演进过程中, 由于细胞周期调控发生紊乱或存在其他机制, 造成hsMAD2的表达水平降低甚至缺失表达, 致使其关卡功能削弱或丧失, 从而引起其间接抑制APC活化的功能减弱或丧失, 如果细胞在分裂过程中存在某种错误, 也不会在此关卡处停滞下来, 而是按照错误的方式继续分裂下去, 继而引起细胞染色体组的不稳定, 甚至发生癌变. hREV7能与hsMAD2结合, 前者的过表达不引起细胞周期的停留[29]. GM-CSF(粒-巨细胞集落刺激因子)也可能通过与MAD2作用参与调节细胞周期M期关卡[30]. 总之, 这类基因与肿瘤的关系值得我们注目.
| 9. | 戚 跃勇, 邹 利光, 王 文献, 陈 卫军, 熊 坤林, 赵 晓晏, 杨 彤翰, 易 习之. 肝细胞肝癌合并门静脉癌栓的双期增强螺旋CT诊断. 世界华人消化杂志. 2002;10:384-387. |
| 15. | Tang ZY, Sun FX, Tian J, Ye SL, Liu YK, Liu KD, Xue Q, Chen J, Xia JL, Qin LX. Metastatic human hepatocellular carcinoma models in nude mice and cell line with metastatic potential. World J Gastroenterol. 2001;7:597-601. [DOI] |
| 16. | Wang ZX, Hu GF, Wang HY, Wu MC. Expression of liver cancer associated gene HCCA3. World J Gastroenterol. 2001;7:821-825. [DOI] |
| 17. | Tang ZY. Hepatocellular carcinoma-Cause, treatment and metastasis. World J Gastroenterol. 2001;7:445-454. [DOI] |
| 18. | Cui J, Zhou XD, Liu YK, Tang ZY, Zile MH. Abnormal beta-catenin gene expression with invasiveness of primary hepatocellular carcinoma in China. World J Gastroenterol. 2001;7:542-546. [DOI] |
| 19. | Huang XF, Wang CM, Dai XW, Li ZJ, Pan BR, Yu LB, Qian B, Fang L. Expressions of chromogranin A and cathepsin D in human primary hepatocellular carcinoma. World J Gastroenterol. 2000;6:693-698. |
| 21. | Tanaka K, Nishioka J, Kato K, Nakamura A, Mouri T, Miki C, Kusunoki M, Nobori T. Mitotic checkpoint protein hsMAD2 as a marker predicting liver metastasis of human gastric cancers. Jpn J Cancer Res. 2001;92:952-958. [DOI] |
| 22. | Percy MJ, Myrie KA, Neeley CK, Azim JN, Ethier SP, Petty EM. Expression and mutational analyses of the human MAD2L1 gene in breast cancer cells. Genes Chromosomes Cancer. 2000;29:356-362. [DOI] |
| 23. | Hernando E, Orlow I, Liberal V, Nohales G, Benezra R, Cordon-Cardo C. Molecular analyses of the mitotic checkpoint components hsMAD2, hBUB1 and hBUB3 in human cancer. Int J Cancer. 2001;95:223-227. |
| 24. | Wang X, Jin DY, Ng RW, Feng H, Wong YC, Cheung AL, Tsao SW. Significance of MAD2 expression to mitotic checkpoint control in ovarian cancer cells. Cancer Res. 2002;62:1662-1668. |
| 25. | Wang X, Jin DY, Wong YC, Cheung AL, Chun AC, Lo AK, Liu Y, Tsao SW. Correlation of defective mitotic checkpoint with aberrantly reduced expression of MAD2 protein in nasopharyngeal carcinoma cells. Carcinogenesis. 2000;21:2293-2297. [DOI] |
| 27. | Zhang Y, Lees E. Identification of an overlapping binding domain on Cdc20 for Mad2 and anaphase-promoting complex: model for spindle checkpoint regulation. Mol Cell Biol. 2001;21:5190-5199. [DOI] |
| 28. | Luo X, Fang G, Coldiron M, Lin Y, Yu H, Kirschner MW, Wagner G. Structure of the Mad2 spindle assembly checkpoint protein and its interaction with Cdc20. Nat Struct Biol. 2000;7:224-229. |
| 29. | Murakumo Y, Roth T, Ishii H, Rasio D, Numata S, Croce CM, Fishel R. A human REV7 homolog that interacts with the polymerase zeta catalytic subunit hREV3 and the spindle assembly checkpoint protein hMAD2. J Biol Chem. 2000;275:4391-4397. [DOI] |
| 30. | Takeda M, Dohmae N, Takio K, Arai K, Watanabe S. Cell cycle-dependent interaction of Mad2 with conserved Box1/2 region of human granulocyte-macrophage colony-stimulating factor receptor common betac. J Biol Chem. 2001;276:41803-41809. [DOI] |