修回日期: 2003-03-20
接受日期: 2003-03-28
在线出版日期: 2003-09-15
寻找不同胃癌证型组织中的相关基因表达谱差异表达,对研究胃癌证型实质进行探讨、胃癌的中医证的基因诊断及指导临床用药有重大的意义.
我们运用含有4 096条人类全长基因的cDNA表达芯片技术,对胃癌中医证型邪热内蕴证和气滞血瘀证共4例,胃癌组织及胎胃正常组织基因表达进行了分析.
两证型都有免疫相关基因的下降,也有癌基因的上调,但热毒内蕴亚型基因表达提示了正气未虚,尚有防御能力,如nm23基因增高, P18基因表达增高; 而气虚夹瘀亚型中则无此改变.
胃癌患者的基因表达既有相同表达改变,也有不同中医证型的基因谱表达改变也不相同,基因表达谱可为中医的证型提供科学依据.
引文著录: 刘莺, 李俊军, 朱文锋, 刘平. 胃癌中医证型相关基因的表达谱. 世界华人消化杂志 2003; 11(9): 1318-1321
Revised: March 20, 2003
Accepted: March 28, 2003
Published online: September 15, 2003
To find difference in gene expression pedigree of gastric carcinoma tissue and different syndrome, and its significance in the exploration of the syndrome typ and diagnosisof gastric carcinoma, with gene diagnosis as well as the use of drugs in its treatment.
The gene expression in two TCM syndrome types of gastric carcinoma due to internal stagnancy of pathogenic heat and stagnancy of qi and blood stasis, respectively, including 4 human gastric carcinoma tissues and normal embryo stomach tissue, was analyzed by using 4096 pieces of human full-length genic CDNA expression CMOS chip technology.
The gene expression in the two TCM syndrome types of gastric carcinoma was decreased in their immune associated genes, but increased in cancer-associated genes. Gene expression in the interior stagnancy of toxic heat showed that the body resistance was not weakened, suggesting that there was no deficiency of qi and stagnancy of blood stasis
The change in gene expression of gastric cancer is identical, but the gene expression spectrum is different in different types of TCM syndromes.
- Citation: Liu Y, Li JJ, Zhu WF, Liu P. Gastric cancer related gene expression spectrum in disease pattern of traditional Chinese medicine. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1318-1321
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1318.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1318
人类基因组计划的实现给中医现代化带来了新的机遇[1]. 基因组学研究方法与中医学的整体观、辨证观有许多相似之处,一种疾病可能由于多个基因改变所致,而同一种基因有不同表达状态可能导致多种疾病[2]; 反映出基因组学与中医学两个学科在思维方法上的趋近特征,为中医病证实质性突破提供了条件. 肿瘤在不同的个体、不同的病理类型中其生长、浸润、转移是不同的,这一点与中医证的形成有某些相通之处[3]. 他们都是依赖有特异编码的基因产物起作用,正是由于这种基因的微细异常,决定其生物行为出现极大的变化[4]. 因此,运用基因芯片技术寻找不同证型胃癌组织中的相关基因表达谱差异表达,对研究胃癌证型的实质,胃癌的中医证的基因诊断及指导临床用药有重大的意义.
上海博星公司的基因表达谱芯片上一共有4 096个点,其中设有几个阴性对照: 水稻U2RNA基因(8 个点)、HCV外壳蛋白基因(8 个点),空白点样液(32个点). 芯片所用的4 000个靶基因cDNA克隆,来自博星公司及合作伙伴. 以通用引物进行PCR扩增,PCR引物为1 000-3 000 bp (少数例外),PCR反应及产物提纯采用标准方法[5],通过琼脂糖凝胶电泳检测PCR产物质量,靶基因溶解于3×SSC溶液中,用Cartesian公司的7 500点样仪及Tele Chem公司的硅烷化玻片进行点样,点样玻片经水合(2 h)室温干燥(30 min)UV交联(能量设定65 mI/cm),再分别用2 g/ LSDS、水及2 g/L硼氢化钠溶液处理10 min,晾干备用. 胃癌组织标本4例,是湖南省肿瘤医院2001-03行标准胃癌切除手术切除的胃癌标本. 例1: 男,23岁. 胃癌组织类型为低分化腺癌,浸入胃壁全层,有近处淋巴转移. 例2: 男,35岁. 胃癌组织类型为中分化腺癌,浸入胃壁全层,有近处淋巴转移. 例3: 女,30岁. 胃癌组织类型为低分化腺癌, 浸入胃壁深肌层,有近处淋巴转移. 例4: 男,63岁. 胃癌组织类型为低分化腺癌,部份黏液癌,浸入胃壁全层,有近处淋巴转移. 经对胃癌术前患者症状进行聚类与主成分分析显示,例1-2为邪热内蕴证中的热毒内蕴兼气虚亚型; 3-4为气滞血瘀证中的气虚夹瘀亚型. 对照组取自发育正常的流产胎胃. 分别于标本切除后立即液氮保存.
总RNA抽提方法参考Chomczynski et al (AnalbiGhein 1987;163:156)提出的步法加以改进: 将液氮保存的胃癌组织和胎胃放在100 mm陶瓷碾钵内,分别彻底碾碎成粉末,加入溶液D和10 g/L巯基乙醇匀浆成溶液,离心后上清液经1:1的酸性酚-氯仿两次抽提后,再经NaAc和5:1酸性酚-氯仿抽提,再经等体积异丙醇沉淀;离心后用Mili-Qii 溶解沉淀,紫外分析,用LiCl沉淀方法纯化后,紫外分析及电泳检测显示获得了高质量的纯净mRNA. 用Oligotex Mrna (Quagen公司)纯化mRNA参照SchenaR 方法转录标记cDNA并纯化,用Cy3-dUTP标记正常组织mRNA,用Cy5-dUTP标记癌组织mRNA. 乙醇沉淀后,溶解在20 ml 5×SSC+2g/L SDS杂交液中. 将cDNA微矩阵和杂交探针分别在95 °C水浴中变性5 min,将探针加在cDNA微矩阵上用玻片封片,置于60 °C杂交15-17 h,然后揭开玻片,分别用2×SSC+2 g/L SDS,1 g/L×SSC+2 g/L SDS,1 g/L×SSC洗涤10 min,室温晾干. 芯片的扫描来自GeneralScanning公司的ScanArray 3000扫描仪,分析软件为Biodoscovery公司的ImaGene3.0和博星公司开发的ArrayGene1.0.
统计学处理 40个管家基因作参照,对原始数据进行标准化处理,剔除Cy3和Cy-5中信号强度均小于400的基因表达数据. 基因显著性差异表达的判定标准为:Ratio大于2或 Ratio小于0.5 ( Ratio =Cy5/Cy3). 同时要求筛选出的基因数据在所有样本中均能重复
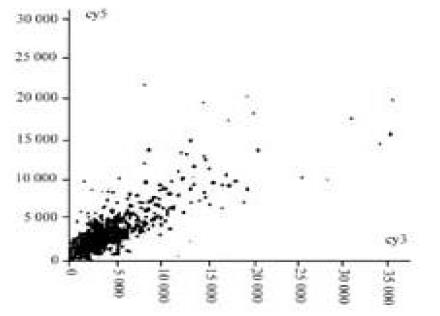
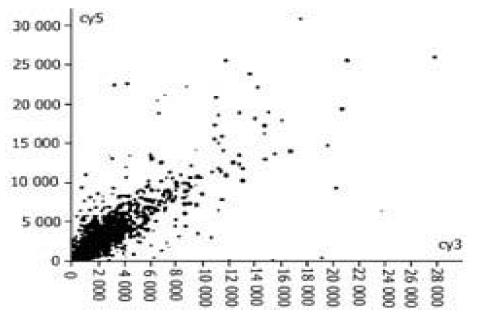
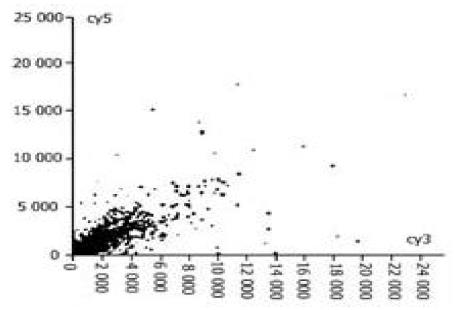
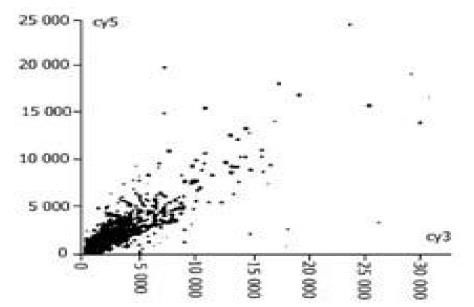
图1-4为基因表达谱的散点图,每一个点都代表一个基因,X轴和Y轴分别以Cy3的荧光强度值(前景值-背景值)和Cy5(1-4)荧光强度值为坐标,每一个数据点代表芯片上一个基因点的杂交信号; 数据若为红色则代表X值与Y值的比值在0.5-2.0之间,基本属非特异表达; 数据若为黄色则代表X值与Y值的比值在0.5-2.0之外,该点很可能就是表达差异基因.
图5-8为表达谱芯片双色荧光扫描图像,分别代表了癌变组织中和正常组织中基因的表达. 对于某一点的两种叠加荧光信号,如果Cy3信号较强,该点显绿色(下调趋势),如果Cy5信号较强,该点显红色(上调趋势); 如果强度相似,即呈黄色.
所选4例原发胃癌标本,以胎胃为正常对照,筛选与胃癌组织中表达改变有差异的基因. 在进入研究的4 096条基因中,发现表达差异相差两倍以上的基因有80条 (1.95 %),其中表达上调的28条,下调的52条,其中包括肿瘤基因及肿瘤相关基因; 为细胞周期蛋白;蛋白转录合成和转录因子; 细胞受体; 免疫因子; 信号传导和传递蛋白; 代谢相关基因; 蛋白翻译合成基因,发育基因.
两证型基因表达,除上述80条基因与正常胃比较表达有显著性差异外,两亚型之间比较,表达有差异的基因有167条,其中热毒内蕴兼气虚亚型中表达差异有71条,上调者35条,下调者36条; 包括了: 4条癌基因或抑癌基因(2升2降); 5条细胞周期蛋类基因(2升3降); 1条离子通道和输蛋白(降); 5条外压反应蛋白(2升3降); 3条DNA结合转录因子(1升2降); 2条细胞受体(降); 9条免疫相关基因(8升1降); 21条细胞信号的传递蛋白(9升12降); 12条代谢相关基因(11升1降); 10条蛋白翻译合成蛋白(5升5降); 1发育相关基因(降); 10条其他基因. 根据已查的文献,上调的基因有: 干扰素相关基因、nm-23、CD24、P18,下调基因的有: 细胞周期素E、IV型胶原酶等. 气虚兼瘀血亚型,表达有差异的基因有96条,上调57条,下调39条,包括了: 6条癌基因或抑癌基因(3升3降); 8条细胞周期蛋类基因(5升3降); 3条离子通道和输蛋白(2升1降); 12条外压反应蛋白(3升9降); 2条细胞凋亡相关基因(升); 1条DNA合成修复重组蛋白(升); 6条DNA结合转录因子(5升1降); 3条细胞受体(1升2降); 5条免疫相关基因(4升1降); 14条细胞信号的传递蛋白(4升10降); 17条代谢相关基因(13升4降); 8条蛋白翻译合成蛋白(升); 4发育相关基因(1降3升); 23条其他基因. 据所查文献有CD53、M15796等增高,下调的有NM-006096等.
我们所选病例中,都有不同程度的气虚和毒邪两因素,因此在胃癌组织中既有代谢相关基因(X51405)的下降,免疫相关因子(如人类免疫G蛋白)的下降表明了胃癌的发生与自身免疫力的下降相关,同时也有肿瘤转录相关基因(M97935)的增高; P21-Ras [6-9]在信号传递中起作用,这种已失调节活性的效应分子的长期剌激,就导致细胞的无限增生而显示癌化现象. 组织中的P21-ras突变,都提示癌基因突变. 这些变化显示了胃癌患者既有脏腑功能下降,又有癌毒内蕴,呈发展趋势.
热毒内蕴兼气虚亚型的基因表达特点: nm23基因增高. nm23 [10-17]是一种与肿瘤转移抑制有关的基因. 其基因编码产物为核苷酸激酶(NDPK),参与体内三磷酸核苷的生成,通过影响微管聚合状态及G蛋白介导的信号转导通路而调节细胞代谢,在肿瘤细胞的增生、分化、侵袭及转移过程起重要作用. 因此检测nm23基因有无异常表达降低对胃癌有无转移及预判断具有重要意义. P18基因表达增高. P18是一种多肿瘤抑制蛋白基因[18-21]. 主要作用CDF4/CDK6两种CDK的蛋白激酶活性,具有特异性的抑制作用,而细胞周期素依赖性蛋白激酶CDF处于细胞周期的中心,有关CDK分子的不同位点的磷酸化修饰决定了CDK蛋白的活性,并决定了一系列与基因表达有关的蛋白的磷酸化修饰状态,从而对细胞周期具有调节机制. 因此P18蛋白也是细胞周期中的一个重要的有抑制作用的蛋白质. 免疫相关基因增高. 有白介素-受体mRNA、干扰素诱导的9-27mRNA和56-ku蛋白质、人类B细胞促进因子增高. 有实验证明这些细胞因子(白介素、干扰素诱导、人类B细胞促进因子)增高能抑制和杀伤肿瘤细胞生长,其机制可能还与促进肿瘤抗原表达,有利于机体某些免疫活性细胞识别、黏附和杀伤有关. 表明本型患者正气未虚,尚有抗邪个出之势. 细胞周期素E (cyclin E)减少[22-30]. 过表达时具有一定的促进细胞进入到S期的作用,而异源性细胞周期素E (cyclin E)足以诱导分裂后处于G1期的细胞进行另一轮的DNA复制以及分裂过程,同时异源性表达的细胞周期素E也足以诱导细胞周期素A 和B 的积累,而这两种细胞周期素又是有丝分裂期所必须的. 细胞周期素E (cyclin E)促进细胞周期素A和B积累的机制,不是促进这两种细胞周期素的转录,可能是抑制了细胞周期素降解机制,使这两种细胞周期素的蛋白更为稳定. 下降则使细胞进入G1期及DNA复制过程受阻. IV型胶原酶下降. IV型胶原酶是其底膜结构中最为重要的组成. 肿瘤细胞要通过其底膜进行转移,必须分泌这种酶,以破坏其底膜的结构,因而推测肿瘤细胞转移与IV型胶原酶表达水平与活性有关. 当IV型胶原酶下降时,肿瘤的转移受阻.
通过对表达有显著差异的基因功能的认识,可以看到,在热毒内蕴兼气虚证中,由于正气未衰,尚有防御功能,因此抑癌基因和有抑癌作用的基因表达增强(nm23基因、P18基因、干扰素相关基因),具有肿瘤生长和转移作用的基因下降(细胞周期素E、IV型胶原酶). 抗癌因素强于癌毒扩散因素. 在临床上所表现的证型以实为主,病变较轻.
气虚兼瘀血型的基因谱表达特点: CD53基因、未成熟瘤克隆转录子、周期蛋白基因、D型细胞周期蛋白互作蛋白1等表达增强. 这些基因在胃癌发生发展过程中的作用机制有待于进一步研究. 但热毒内蕴兼气虚亚型中基因表达特点在本亚型不具备.
总之,胃癌中医证型形成机制与基因表达有关,因此阐明基因与证之间的联系,对认识疾病的发生机制、预测疾病的转归无疑会发挥重要作用. 研究基因表达谱改变与证型多样性之间的联系是一个崭新的领域,也是研究中医证实质的关键所在,应引起我们足够的重视.
| 1. | 余 伯阳, 严 永清. 浅析现代生物学研究方法及与中医药现代化的关系. 世界科学技术-中药现代化思路与方法. 2001;3:45-49. |
| 4. | Yasui W, Oue N, Kuraoka K, Nakayama H. Molecular diagnosis of gastric cancer: present and future. Gastric Cancer. 2001;4:113-121. [DOI] |
| 5. | Golub TR, Slonim DK, Tamayo P, Huard C, Gaasenbeek M, Mesirov JP, Coller H, Loh ML, Downing JR, Caligiuri MA. Molecular classification of cancer:class discovery and class prediction by gene expression monitoring. Science. 1999;2686:531-537. [DOI] |
| 6. | Go JH, Yang WI. Expressions of p53 and p21 in primary gastric lymphomas. J Korean Med Sci. 2001;16:731-735. [DOI] |
| 7. | Noda H, Maehara Y, Irie K, Kakeji Y, Yonemura T, Sugimachi K. Increased proliferative activity caused by loss of p21 (WAF1/CIP1) expression and its clinical significance in patients with early-stage gastric carcinoma. Cancer. 2002;94:2107-2112. |
| 8. | Liu XP, Kawauchi S, Oga A, Suehiro Y, Tsushimi K, Tsushimi M, Sasaki K. Combined examination of p27(Kip1), p21 (Waf1/Cip 1) and p53 expression allows precise estimation of prognosis in patients with gastric carcinoma. Histopathology. 2001;39:603-610. |
| 9. | Liu XP, Kawauchi S, Oga A, Suehiro Y, Tsushimi K, Tsushimi M, Sasaki K. Genomic structure of the human beta-PIX gene and its alteration in gastric cancer. Cancer Lett. 2002;177:203-208. [DOI] |
| 10. | Terada R, Yasutake T, Nakamura S, Hisamatsu T, Sawai T, Yamaguchi H, Nakagoe T, Ayabe H, Tagawa Y. Clinical significance of nm23 expression and chromosome 17 numerical aberrations in primary gastric cancer. Med Oncol. 2002;19:239-248. [DOI] |
| 11. | Ji SQ, Hua YW, Zhuang J, Gao Y, Kong Y, Han SL, Shao YF. Significance of COX-2, p53, proliferating cell nuclear antigen and nm23 expressions in gastric cancer and its behavior. Ai Zheng. 2002;21:619-624. |
| 12. | Nesi G, Palli D, Pernice LM, Saieva C, Paglierani M, Kroning KC, Catarzi S, Rubio CA, Amorosi A. Expression of nm23 gene in gastric cancer is associated with a poor 5-year survival. Anticancer Res. 2001;21:3643-3649. |
| 13. | Wang CS, Lin KH, Hsu YC. Alterations of thyroid hormone receptor alpha gene: frequency and association with Nm23 protein expression and metastasis in gastric cancer. Cancer Lett. 2002;175:121-127. [DOI] |
| 14. | Iizuka N, Tangoku A, Hazama S, Yoshino S, Mori N, Oka M. Nm23-H1 gene as a molecular switch between the free-floating and adherent states of gastric cancer cells. Cancer Lett. 2001;174:65-71. [DOI] |
| 15. | Lee JH, Koh JT, Shin BA, Ahn KY, Roh JH, Kim YJ, Kim KK. Comparative study of angiostatic and anti-invasive gene expressions as prognostic factors in gastric cancer. Int J Oncol. 2001;18:355-361. |
| 16. | Hsu NY, Chow KC, Chen WJ, Lin CC, Chou FF, Chen CL. Expression of nm23 in the primary tumor and the metastatic regional lymph nodes of patients with gastric cardiac cancer. Clin Cancer Res. 1999;5:1752-1757. |
| 17. | Yoo CH, Noh SH, Kim H, Lee HY, Min JS. Prognostic significance of CD44 and nm23 expression in patients with stage II and stage IIIA gastric carcinoma. J Surg Oncol. 1999;71:22-28. [DOI] |
| 18. | Bai F, Pei XH, Godfrey VL, Xiong Y. Haploinsufficiency of p18(INK4c) sensitizes mice to carcinogen-induced tumorigenesis. Mol Cell Biol. 2003;23:1269-1277. |
| 19. | Kim DS, Froelick GJ, Palmiter RD. Dopamine-dependent desensitization of dopaminergic signaling in the developing mouse striatum. J Neurosci. 2002;22:9841-9849. [DOI] |
| 20. | Lasak JM, Welling DB, Akhmametyeva EM, Salloum M, Chang LS. Retinoblastoma-cyclin-dependent kinase pathway deregulation in vestibular schwannomas. Laryngoscope. 2002;112:1555-1561. |
| 21. | Schon A, Fingerhut C, Hess WR. Conserved and variable domains within divergent rnase P RNA gene sequences of Prochlorococcus strains. Int J Syst Evol Microbiol. 2002;52:1383-1389. [DOI] |
| 22. | Chetty R, Sitti CW. Cyclin E immunoexpression in gastric cancer does not correlate with clinicopathological parameters. Histopathology. 2003;42:66-69. |
| 23. | Yao YL, Xu B, Song YG, Zhang WD. Overexpression of cyclin E in Mongolian gerbil with Helicobacter pylori-induced gastric precancerosis. World J Gastroenterol. 2002;8:60-63. [DOI] |
| 24. | Ferreri AJ, Ponzoni M, Pruneri G, Freschi M, Rossi R, Dell扥ro S, Baldini L, Buffa R, Carboni N, Villa E. Immunoreactivity for p27(KIP1) and cyclin E is an independent predictor of survival in primary gastric non-Hodgkin's lymphoma. Int J Cancer. 2001;94:599-604. |
| 25. | Moragoda L, Jaszewski R, Majumdar AP. Curcumin induced modulation of cell cycle and apoptosis in gastric and colon cancer cells. Anticancer Res. 2001;21:873-878. |
| 26. | Lin L, Prescott MS, Zhu Z, Singh P, Chun SY, Kuick RD, Hanash SM, Orringer MB, Glover TW, Beer DG. Identification and characterization of a 19q12 amplicon in esophageal adenocarcinomas reveals cyclin E as the best candidate gene for this amplicon. Cancer Res. 2000;60:7021-7027. |
| 27. | So JB, Samarasinge K, Raju GC, Moochhala SM, Ti TK. Expression of cell-cycle regulators p27 and cyclin E correlates with survival in gastric carcinoma patients. J Surg Res. 2000;94:56-60. [DOI] |
| 28. | Hernandez-Torres J, Yunta M, Lazo PA. Differential cooperation between regulatory sequences required for human CD53 gene expression. J Biol Chem. 2001;276:35405-35413. [DOI] |
| 29. | Ferrer M, Yunta M, Lazo PA. Pattern of expression of tetraspanin antigen genes in Burkitt lymphoma cell lines. Clin Exp Immunol. 1998;113:346-352. [DOI] |
| 30. | Mollinedo F, Fontan G, Barasoain I, Lazo PA. Recurrent infectious diseases in human CD53 deficiency. Clin Diagn Lab Immunol. 1997;4:229-231. |