修回日期: 2002-11-20
接受日期: 2002-12-07
在线出版日期: 2003-09-15
明确乳腺癌雌激素诱导基因PS2/TFF1在胃癌及癌前病变中的表达及其意义.
采用免疫组织化学方法测定121例患者(慢性浅表性胃炎20例、胃溃疡20例、不典型增生20例、不完全肠化生20例、完全肠化生21例及胃癌20例)及20名健康志愿者胃黏膜组织中PS2/TFF1蛋白的表达.
PS2/TFF1在慢性浅表性胃炎、胃溃疡中表达与对照组比较明显增加(慢性胃炎组 vs 正常对照组 P <0.01 q = 7.721; 胃溃疡组vs 正常对照组P <0.01 q = 5.256), 在不典型增生、不完全肠化生及胃癌中表达比对照组明显减低(不典型增生组 vs 正常对照组P <0.01 q = 8.051; 不完全肠化生组 vs 正常对照组P <0.01 q = 11.356; 胃癌组 vs 正常对照组P <0.01 q = 8.238), 在完全肠化生组 PS2/TFF1表达无明显增高(20/21, 95.24%), 与不完全肠化生组表达(11/20, 55%)相比差异显著(P <0.01 x2 =8.994).
(1) PS2/TFF1蛋白在胃黏膜保护中可能起重要作用; (2) PS2/TFF1的表达缺失可能是胃肿瘤恶性转化过程中的早期事件.
引文著录: 李俊美, 罗和生, 姚宏昌. 雌激素诱导基因PS2/TFF1在胃癌及癌前病变中的表达. 世界华人消化杂志 2003; 11(9): 1302-1305
Revised: November 20, 2002
Accepted: December 7, 2002
Published online: September 15, 2003
To determine the significance of PS2/TFF1 protein expression in chronic superficial gastritis (CSG), gastric ulcer (GU),gastric mucosal intestinal metaplasia (IM), gastric mucosal dysplasia and gastric cancer(GC).
Pathologic specimens of 121 patients with gastric mucosal diseases and 20 healthy volunteers were immunostained for PS2/TFF1.
Positive PS2/TFF1 staining was seen throughout all epithelia with normal gastric mucosas, CSG, GU and in complete type of intestinal metaplasia (20/21). On the contrary, 11 of 20 incomplete type of intestinal metaplasia had positive staining (P <0.01). The expressions of PS2/TFF1 protein in CSG and GU were significantly higher than that in control group (P <0.01), while the expressions of PS2/TFF1 protein in IM,gastric mucosal dysplasia and GC were obviously lower than that in control group (P <0.01).
Our results indicate that PS2/TFF1 may play an important role in gastric mucosal protection,and loss of PS2/TFF1 expression may occur as an early event in the malignant transformation process of intestinal-type tumors.
- Citation: Li JM, Luo HS, Yao HC. Expression of estrogen inducing gene PS2/TFF1 in gastric cancer and precancerous lesions. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1302-1305
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1302.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1302
PS2/TFF1基因又称乳腺癌雌激素诱导基因, 于1982年首次从乳腺癌细胞系MCF-7中提取并测序鉴定.其编码的PS2/TFF1蛋白和解痉多肽(TFF2)、肠三叶因子(TFF3)含有相同的三叶草结构域(TFF), 他们共同组成了三叶因子家族. 在人体, PS2/TFF1仅在正常胃组织中表达. 在胃肠道炎症和许多癌组织中也有异常表达[1-4]. 但PS2/TFF1在胃肠道中的作用和意义仍不清楚. 本研究采用免疫组化方法, 旨在探讨PS2/TFF1在胃炎、胃溃疡、胃癌前病变和胃癌中的表达和意义.
收集武汉大学人民医院病理科1998/2000年外科手术及内窥镜下活检组织的石蜡包埋标本141例, 其中正常胃黏膜、慢性浅表性胃炎、胃溃疡、胃黏膜不典型增生、胃黏膜不完全肠化生、胃癌各20例, 胃黏膜完全肠化生21例均经病理确诊. 男85例, 女56例, 平均年龄48岁(31-63岁).
所有标本均经100 mL/L甲醛固定, 常规脱水, 透明, 浸蜡, 制成5 mm厚连续切片, 免疫组化SP法:第一抗体为山羊抗人PS2/TFF1多克隆抗体(Santa Cruz 公司), 脱蜡水化后, 置于柠檬酸缓冲液(pH值6.0)中煮沸20 min, 再保温10 min, 作抗原修复; 按试剂盒(福州迈新公司)说明操作. 阳性显示细胞质内均匀棕黄颗粒, 灶性及散在分布. 每张组织切片取5个高倍镜视野(400倍), 每个视野计数100个细胞计算阳性细胞百分率, 取平均百分率为显色指数, 阳性细胞(10%为阴性 ), 10%为阳性. 对于阳性程度的判定如下: 10-20%为 +, 21-40%为 ++, 41-70%为 +++, 70% 为++++. PBS代替一抗作阴性对照, 已知阳性切片作阳性对照.
统计学处理 采用x2检验和秩和检验.
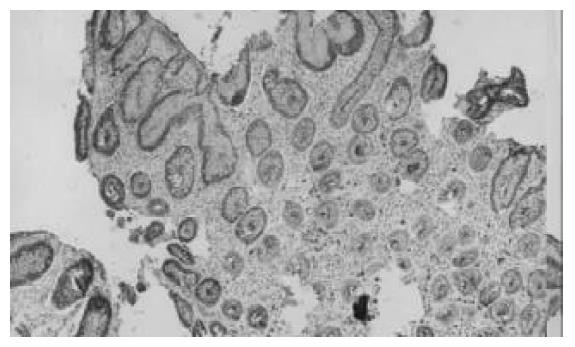
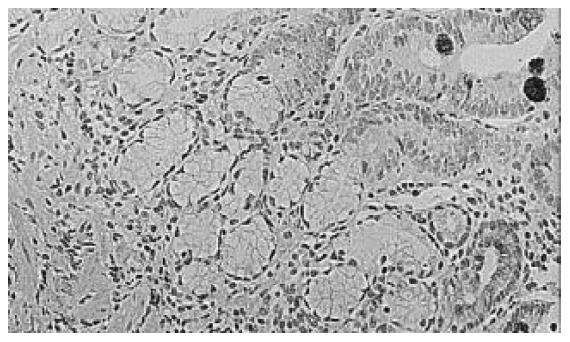
PS2/TFF1在正常胃黏膜、慢性浅表性胃炎、胃溃疡、胃黏膜完全肠化生、胃黏膜不完全肠化生、胃黏膜不典型增生、胃癌中的表达阳性率分别为100%, 100%, 100%, 95.24%, 55%, 60%, 20% (表1). PS2/TFF1在正常胃黏膜的浅层上皮细胞中表达; 在慢性浅表性胃炎、消化性溃疡中不仅浅层上皮细胞中表达, 而且黏膜深部细胞也有细胞质染色(图1), 二者与对照组比较差异显著(慢性胃炎组vs 正常对照组 P <0.01 q = 7.721; 胃溃疡组vs 正常对照组P <0.01 q = 5.256) (表2); 慢性浅表性胃炎组与胃溃疡组比较差异无显著性, (P >0.05 q = 0.163); PS2/TFF1在不完全性肠化生、不典型增生、胃癌中部分胞质染色(图2), 与正常对照组比较有极显著性差异(不典型增生组 vs 正常对照组P <0.01 q = 8.051; 不完全肠化生组 vs 正常对照组 P <0.01 q = 11.356; 胃癌组 vs 正常对照组 P <0.01 q = 8.238)(表2), 不完全性肠化生组与胃癌组比较差异显著(P <0.05 q =3.314)、不典型增生组与胃癌组比较差异显著(P <0.01 q = 4.269), 而不完全肠化生组与不典型增生组比较无显著性差异, (P>0.05 q = 0.692).
| 分组 | n | 阳性率 (%) |
| 对照组 | 20 | 100 (20) |
| 浅表胃炎组 | 20 | 100 (20) |
| 胃溃疡组 | 20 | 100 (20) |
| 不典型增生组 | 20 | 60 (12) |
| 肠化生组 | ||
| 完全肠化生 | 21 | 95.24(20) |
| 不完全肠化生 | 20 | 55(11)a |
| 胃癌组 | 20 | 20 (4) |
本实验观察到, PS2/TFF1表达缺失主要发生在不完全性肠化生的胃黏膜中, 完全性肠化生的胃黏膜中几乎无PS2/TFF1的表达缺失, PS2/TFF1在二者中的表达分别为95.24%, 55%, 二者比较有差异(P <0.01 x2=8.994)(表1).
PS2/TFF1基因又称乳腺癌雌激素诱导基因, 于1982年首次从乳腺癌细胞系MCF-7中提取并测序鉴定. 其编码的pS2蛋白和猪解痉多肽(SP)、小肠三叶因子(ITF)含有相同的三叶草结构域(TFF), 他们共同组成了三叶因子家族. 正常情况下PS2/TFF1仅在成人胃组织中表达, 胃底、胃窦和幽门腺的黏膜内均表达PS2/TFF1, 主要定位于胃小凹上层的表皮细胞内, 该处的细胞分化可以限制腺体的增生和形成具有分泌功能的黏膜. 在病理状态下, 整个胃肠道均有PS2/TFF1的异位表达[2-6], 特别是在溃疡的愈合期的再生组织中, PS2/TFF1的表达明显增加[7]. 但是PS2/TFF1在胃肠疾病以及胃肠肿瘤形成过程中的作用机制和意义目前仍未研究清楚.
本研究发现慢性浅表性胃炎、消化性溃疡组, 胃黏膜PS2/TFF1不仅在浅层上皮细胞中表达, 而且在黏膜深部细胞也有明显表达, 较正常胃黏膜表达明显增高, P <0.01.说明PS2/TFF1在维持胃肠道黏膜的完整及修复损伤中可能起重要作用. Ulaganathan et al [8]在动物试验中发现PS2/TFF1及其mRNA在溃疡后4-28 d可明显被诱导产生, 并且不仅在表层上皮细胞中表达, 而且也在修复黏膜深部的酸性产粘蛋白细胞中表达, 提示PS2/TFF1是黏膜修复过程后期的递质. 有资料表明[9], PS2/TFF1可以使伤口周围的上皮细胞向损伤部位迁移. 因此, PS2/TFF1可能通过引发细胞运动来重建上皮的完整; 另外, PS2/TFF1与黏液素密切相关[10-12], PS2/TFF1结构域有与糖蛋白侧链直接作用的位点, 而黏液素是一种糖蛋白, 在正常和病理情况下, 表达黏液素的细胞优先表达PS2/TFF1; PS2/TFF1基因敲除小鼠胃内缺乏PS2/TFF1, 黏液缺失[13]. 而在胃溃疡的状态下, 溃疡相关细胞系附近的杯状细胞将PS2/TFF1与黏液素共同包被, 可能会被释放到胃腔内, 因此, PS2/TFF1不仅是胃黏膜分泌的胃液成分, 而且, 可能参与黏液的聚合反应和分泌活动, PS2/TFF1在胃内主要以PS2/TFF1复合物的形式存在, 和黏蛋白紧密结合在一起, 形成高黏度的黏液凝胶, 增加黏液的稳定性, 减少H+渗透及有害刺激物对黏膜的损害, 从而增强了胃肠黏膜防御能力.
胃癌是消化道常见肿瘤之一, 至今其发病机制尚未阐明, 多数学者认为与饮食、遗传、幽门螺旋杆菌、癌前情况等有关[14-30] . 上皮细胞的生长发育受癌基因和抑癌基因间的平衡调节, 若平衡失调, 则可能出现癌变. 本研究发现, PS2/TFF1在胃癌前病变及胃癌组织中的表达比正常胃黏膜低, 在正常胃黏膜PS2/TFF1表达阳性率为100%, 在不完全性肠化生、不典型增生分别为55%和60%, 这与国外学者所做的体外实验及动物实验结果基本一致[31] . 现有的研究发现PS2/TFF1在体外可抑制胃腺癌细胞系AGS的生长, PS2/TFF1基因敲除大鼠的胃表层上皮细胞严重增生, 在胃窦部可形成腺瘤, 甚至形成侵袭性的肿瘤, 故推测PS2/TFF1可能为胃特异性肿瘤抑制基因[32-36]. 胃癌组织中PS2/TFF1表达降低可能与PS2/TFF1基因启动子区域的甲基化有关, 且认为启动子区域的甲基化可能是高分化胃癌形成的早期事件[37].
| 1. | Hoffmann W, Jagla W, Wiede A. Molecular medicine of TFF-peptides: from gut to brain. Histol Histopathol. 2001;16:319-334. |
| 2. | Balcer-Kubiczek EK, Harrison GH, Xu JF, Gutierrez PL. Coordinate late expression of trefoil peptide genes (pS2/TFF1 and ITF/TFF3) in human breast, colon, and gastric tumor cells exposed to X-rays. Mol Cancer Ther. 2002;1:405-415. |
| 3. | Dossinger V, Kayademir T, Blin N, Gott P. Down-regulation of TFF expression in gastrointestinal cell lines by cytokines and nuclear factors. Cell Physiol Biochem. 2002;12:197-206. [DOI] |
| 4. | Leung WK, Yu J, Chan FK, To KF, Chan MW, Ebert MP, Ng EK, Chung SC, Malfertheiner P, Sung JJ. Expression of trefoil peptides (TFF1, TFF2, and TFF3) in gastric carcinomas, intestinal metaplasia, and non-neoplastic gastric tissues. J Pathol. 2002;197:582-588. [DOI] |
| 5. | Kirikoshi H, Katoh M. Expression of TFF1, TFF2 and TFF3 in gastric cancer. Int J Oncol. 2002;21:655-659. [DOI] |
| 6. | Nogueira AM, Machado JC, Carneiro F, Reis CA, Gott P, Sobrinho-Simoes M. Patterns of expression of trefoil peptides and mucins in gastric polyps with and without malignant transformation. J Pathol. 1999;187:541-548. [DOI] |
| 7. | Saitoh T, Mochizuki T, Suda T, Aoyagi Y, Tsukada Y, Narisawa R, Asakura H. Elevation of TFF1 gene expression during healing of gastric ulcer at non-ulcerated sites in the stomach: semiquantification using the single tube method of polymerase chain reaction. J Gastroenterol Hepatol. 2000;15:604-609. |
| 8. | Ulaganathan M, Familari M, Yeomans ND, Giraud AS, Cook GA. Spatio-temporal expression of trefoil peptide following severe gastric ulceration in the rat implicates it in late-stage repair processes. J Gastroenterol Hepatol. 2001;16:506-512. |
| 9. | Ribieras S, Tomasetto C, Rio MC. The pS2/TFF1 trefoil factor, from basic research to clinical applications. Biochim Biophys Acta. 1998;1378:F61-77. |
| 10. | Longman RJ, Douthwaite J, Sylvester PA, Poulsom R, Corfield AP, Thomas MG. Coordinated localisation of mucins and trefoil peptides in the ulcer associated cell lineage and the gastrointestinal mucosa. Gut. 2000;47:792-800. |
| 11. | Newton JL, Allen A, Westley BR, May FE. The human trefoil peptide, TFF1, is present in different molecular forms that are intimately associated with mucus in normal stomach. Gut. 2000;46:312-320. [DOI] |
| 12. | Tomasetto C, Masson R, Linares JL, Wendling C, Lefebvre O, Chenard MP, Rio MC. pS2/TFF1 interacts directly with the VWFC cysteine-rich domains of mucins. Gastroenterology. 2000;118:70-80. [DOI] |
| 13. | Lefebvre O, Chenard MP, Masson R, Linares J, Dierich A, LeMeur M, Wendling C, Tomasetto C, Chambon P, Rio MC. Gastric mucosa abnormalities and tumorigenesis in mice lacking the pS2 trefoil protein. Science. 1996;274:204. |
| 14. | Xue YW, Zhang QF, Zhu ZB, Wang Q, Fu SB. Expression of cyclooxygenase-2 and clinicopathologic features in human gastric adenocarcinoma. World J Gastroenterol. 2003;9:250-253. |
| 15. | Guo XL, Wang LE, Du SY, Fan CL, Li L, Wang P, Yuan Y. Association of cyclooxygenase-2 expression with Hp-cagA infection in gastric cancer. World J Gastroenterol. 2003;9:246-249. [DOI] |
| 16. | Zhang H, Wu J, Meng L, Shou CC. Expression of vascular endothelial growth factor and its receptors KDR and Flt-1 in gastric cancer cells. World J Gastroenterol. 2002;8:994-998. [DOI] |
| 17. | Wu J, Shi YQ, Wu KC, Zhang DX, Yang JH, Fan DM. Angiostatin up-regulation in gastric cancer cell SGC7901 inhibits tumorigenesis in nude mice. World J Gastroenterol. 2003;9:59-64. [DOI] |
| 18. | Liu HJ, Guo XL, Dong M, Wang L, Yuan Y. Association between pepsinogen C gene polymorphism and genetic predisposition to gastric cancer. World J Gastroenterol. 2003;9:50-53. |
| 19. | Chen Y, Wu Q, Song SY, Su WJ. Activation of JNK by TPA promotes apoptosis via PKC pathway in gastric cancer cells. World J Gastroenterol. 2002;8:1014-1018. |
| 20. | Guo DL, Dong M, Wang L, Sun LP, Yuan Y. Expression of gastric cancer-associated MG7 antigen in gastric cancer,precancerous lesions and H pylori -associated gastric diseases. World J Gastroenterol. 2002;8:1009-1013. [DOI] |
| 21. | Liu JR, Chen BQ, Yang YM, Wang XL, Xue YB, Zheng YM, Liu RH. Effect of apoptosis on gastric adenocarcinoma cell line SGC-7901 induced by cis-9, trans-11-conjugated linoleic acid. World J Gastroenterol. 2002;8:999-1004. [DOI] |
| 22. | Wu K, Li Y, Zhao Y, Shan YJ, Xia W, Yu WP, Zhao L. Roles of Fas signaling pathway in vitamin E succinate-induced apoptosis in human gastric cancer SGC-7901 cells. World J Gastroenterol. 2002;8:982-986. [DOI] |
| 23. | Fang DC, Luo YH, Yang SM, Li XA, Ling XL, Fang L. Mutation analysis of APC gene in gastric cancer with microsatellite instability. World J Gastroenterol. 2002;8:787-791. |
| 24. | Zhao Y, Wu K, Xia W, Shan YJ, Wu LJ, Yu WP. The effects of vitamin E succinate on the expression of c-jun gene and protein in human gastric cancer SGC-7901 cells. World J Gastroenterol. 2002;8:782-786. |
| 25. | Yao XX, Yin L, Sun ZC. The expression of hTERT mRNA and cellular immunity in gastric cancer and precancerosis. World J Gastroenterol. 2002;8:586-590. [DOI] |
| 26. | Ren J, Dong L, Xu CB, Pan BR. The role of KDR in the interactions between human gastric carcinoma cell and vascular endothelial cell. World J Gastroenterol. 2002;8:596-601. [DOI] |
| 27. | Wang RT, Wang T, Chen K, Wang JY, Zhang JP, Lin SR, Zhu YM, Zhang WM, Cao YX, Zhu CW. Helicobacter pylori infection and gastric cancer: evidence from a retrospective cohort study and nested case-control study in China. World J Gastroenterol. 2002;8:1103-1107. |
| 28. | Liu HF, Liu WW, Fang DC, Wang GA, Teng XC. Relationship between Helicobacter pylori infection and gastric precancerous lesions: a follow-up study. Shijie Huaren Xiaohua Zazhi. 2002;10:912-915. |
| 29. | Lan J, Xiong YY, Lin YX, Wang BC, Gong LL, Xu HS, Guo GS. Helicobacter pylori infection generated gastric cancer through p53-Rb tumor-suppressor system mutation and telomerase reactivation. World J Gastroenterol. 2003;9:54-58. [DOI] |
| 30. | Hao DM, Sun XJ, Zheng ZH, He G, Ma MC, Xu HM, Wang MX, Sun KL. Screening and expression of associated genes in gastric dysplasia. Shijie Huaren Xiaohua Zazhi. 2003;11:6-9. [DOI] |
| 31. | Taupin D, Pedersen J, Familari M, Cook G, Yeomans N, Giraud AS. Augmented intestinal trefoil factor (TFF3) and loss of pS2 (TFF1) expression precedes metaplastic differentiation of gastric epithelium. Lab Invest. 2001;81:397-408. |
| 32. | Bossenmeyer-Pourie C, Kannan R, Ribieras S, Wendling C, Stoll I, Thim L, Tomasetto C, Rio MC. The trefoil factor 1 participates in gastrointestinal cell differentiation by delaying G1-S phase transition and reducing apoptosis. J Cell Biol. 2002;157:761-770. [DOI] |
| 33. | Park WS, Oh RR, Park JY, Lee JH, Shin MS, Kim HS, Lee HK, Kim YS, Kim SY, Lee SH. Somatic mutations of the trefoil factor family 1 gene in gastric cancer. Gastroenterology. 2000;119:691-698. |
| 34. | Park WS, Oh RR, Park JY, Yoo NJ, Lee SH, Shin MS, Kim SY, Kim YS, Lee JH, Kim HS. Mapping of a new target region of allelic loss at 21q22 in primary gastric cancers. Cancer Lett. 2000;159:15-21. [DOI] |
| 35. | Calnan DP, Westley BR, May FE, Floyd DN, Marchbank T, Playford RJ. The trefoil peptide TFF1 inhibits the growth of the human gastric adenocarcinoma cell line AGS. J Pathol. 1999;188:312-317. [DOI] |
| 36. | Carvalho R, Kayademir T, Soares P, Canedo P, Sousa S, Oliveira C, Leistenschneider P, Seruca R, Gott P, Blin N. Loss of heterozygosity and promoter methylation, but not mutation, may underlie loss of TFF1 in gastric carcinoma. Lab Invest. 2002;82:1319-1326. |
| 37. | Fujimoto J, Yasui W, Tahara H, Tahara E, Kudo Y, Yokozaki H, Tahara E. DNA hypermethylation at the pS2 promoter region is associated with early stage of stomach carcinogenesis. Cancer Lett. 2000;149:125-134. [DOI] |