修回日期: 2002-12-10
接受日期: 2002-12-22
在线出版日期: 2003-09-15
研究重组腺病毒携带hENDO-VEGI151融合基因治疗胃癌的可行性.
分别用500 μL滴度为1×1012TCID50/L的粗制重组腺病毒AdCA13-hENDO-VEGI151或AdLacZ皮下注射治疗荷胃癌裸鼠, 隔天1次, 共注射10次. 最后一次注射24 h后处死动物, 检测肿瘤体积、抑瘤率、目的基因的表达、增生细胞核抗原指数(PCNA LI)、肿瘤细胞凋亡指数(AI)、肿瘤微血管密度(MVD).
注射AdCA13-hENDO-VEGI151的治疗组肿瘤体积为328±156 mm3, 注射AdLacZ的对照组肿瘤体积为2 356±1 140 mm3, 差异显著(F =12.42, P =0.0125), 抑瘤率为86.1%; 重组腺病毒携带的目的基因均能在荷胃癌裸鼠肿瘤组织中表达; 治疗组PCNA LI为0.13±0.09%, 对照组为1.40±0.53%, 差异显著(F =22.30, P =0.0033); 治疗组AI为5.09±0.25%, 对照组AI为0.61±0.67%, 差异显著(F =155.13, P =0.0 001); 治疗组MVD为0.06±0.03%, 对照组MVD为1.09±0.76%, 差异明显(F =7.38, P =0.0348).
重组腺病毒携带的融合基因能在荷胃癌裸鼠体内表达出有生物学活性的融合蛋白, 并表现出一定的抑瘤效果.
引文著录: 潘欣, 李喆, 张珉, 王泳, 潘卫, 戚中田. 内皮抑素-血管内皮细胞抑制因子重组腺病毒对荷胃癌裸鼠的治疗. 世界华人消化杂志 2003; 11(9): 1282-1285
Revised: December 10, 2002
Accepted: December 22, 2002
Published online: September 15, 2003
To investigate the effects of recombinant adenoviruses carrying the endostatin-VEGI151 fusion gene AIerapy on gastric carcinoma in nude mice.
Human gastric carcinoma SGC7901 cells (5×106) were injected sc into the dorsal midline of nude mice (3 weeks old), and 500 μL (1012 TCID50/L) of recombinant adenoviruses AdCA13-hENDO-VEGI151 or AdLacZ was given respectively sc every other day for ten times. Twenty-four hours after the last injection, tumor size, inhibition rate, expression of target gene, proliferating cell nuclear antigen label index (PCNA LI), apoptotic index (AI), and intratumoral microvessel density (MVD) were evaluated respectively after the mice were sacrificed.
Compared with the control group AdLacZ (2 356±1 140 mm3), the average tumor size of group AdCA13-hENDO-VEGI151 was reduced in size(328156 mm3, F =12.42, P =0.0125) with an inhibition rate of 86.1%. The adenoviruses carriyring the target gene could be expressed in gastric carcinoma. The PCNA LI of the treated mice (0.13±0.09%) was lower than the contol (1.400.53%, F =22.30, P =0.0 033). The AI was higher in the treated mice (5.09±0.25%) than in the control (0.61±0.67%, F =155.13, P =0.0 001). The MVD was lower in the treated mice (0.06±0.03% ) than in the control (1.09±0.76%, F =7.38, P =0.0 348).
The recombinant adenovirus carrying fusion gene of hENDO-VEGI151 can express the fuion protein in gastric carcinoma in nude mice and inhibit the tumor growth.
- Citation: Pan X, Li Z, Zhang M, Wang Y, Pan W, Qi ZT. Therapeutic effect of endostatin-vascular endothelial growth inhibitor recombinant adenoviruses on gastric carcinoma in nude mice. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1282-1285
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1282.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1282
以新生血管作为肿瘤治疗的"靶点"目前已成为国内外研究的热点[1-6]. 内皮抑素可以引起内皮细胞G1期阻滞, 特异性抑制血管内皮细胞增生, 促进细胞凋亡[7-9]; VEGI151能维持G0/G1期细胞生长阻滞, 诱导进入细胞周期的细胞发生凋亡, 使血管内皮系统处于静止状态[10-13]. 这两种血管生成抑制因子抑制内皮细胞增生的机制可能差异较大, 但将二者的基因进行融合, 表达出的融合蛋白可能可以阻断肿瘤血管生成的不同环节, 提高治疗效果. 我们利用重组腺病毒携带hENDO-VEGI151融合基因治疗荷胃癌裸鼠, 以期为肿瘤的抗血管生成基因治疗提供新的思路.
AdCA13-hENDO-VEGI151重组腺病毒和AdLacZ重组腺病毒为本室包装鉴定, 兔抗人Endostatin多克隆抗体由德国汉若威的Stanker教授惠赠; 由人胚肾上皮细胞经Ad5基因片段转染后转化而成的293细胞、人胃癌SGC7903细胞为本室保存; ♀3周龄Balb/c裸小鼠购于本校动物实验中心; HRP酶标羊抗兔IgG mAb, DAB, X-gal, DMEM等均购于华美生物工程公司; 鼠抗人CD34 mAb试剂盒、PCNA免疫组化试剂盒、细胞凋亡检测试剂盒购于武汉博士德生物工程有限公司.
包装鉴定过的重组腺病毒AdCA13-hENDO-VEGI151或AdCA13-LacZ 50 μL加200 μL完全培养液感染293细胞, 约2d (48 h)分别收集呈CPE表现的细胞及上清, -70~-37 °C反复冻融3次, 经0.45 μm滤膜过滤, 所得滤液为粗制重组腺病毒(混合克隆), -70 °C保存. 两种重组腺病毒的滴度用TCID50法测定.
1.2.1 重组腺病毒治疗荷胃癌裸鼠[14-18] 8只3周龄Balb/c♀裸小鼠, 背部皮下以5×106接种生长良好的SGC7901细胞悬液. 待10 d长出2-3 mm直径的肿瘤后, 随机分成2组, 每组4只, 瘤体内注射AdCA13-hENDO-VEGI151或AdLacZ 500 μL, 隔天注射1次, 共注射10次. 最后1次注射24 h后拉断颈椎, 剥离瘤体, 用游标卡尺测量肿瘤短径(a)、长径(b), 按公式V=πa2b/6计算肿瘤体积, 按下式计算抑瘤率: 抑瘤率=[(对照组肿瘤的平均体积-实验组肿瘤的平均体积)/对照组肿瘤的平均体积]×100%; 称肿瘤质量. 瘤体用40 g/L多聚甲醛固定, 常规病理切片, 行苏木精伊红(HE)染色、免疫组化染色及凋亡染色(TUNEL法)鉴定; 注射AdLacZ的剪下部分瘤体, 直接做冰冻切片进行β-半乳糖苷酶报告基因的检测. 冰冻切片用X-gal染色液染色、伊红衬染, 镜下观察, 计算重组腺病毒AdLacZ感染蓝染细胞面积百分率.
1.2.2 融合蛋白及PCNA在胃癌组织中的表达[19] 石蜡切片常规脱蜡, 水化, 置3 mL/L H2O2 20 min后用柠檬酸-柠檬酸钠缓冲液浸泡组织切片, 微波炉中95 °C, 5 min修复抗原, 更换柠檬酸-柠檬酸钠缓冲液后重复1次; 0.01 mol/L PBS洗3次, 3 min/次; 加入兔抗人Endostatin多抗(1: 200) 4 °C过夜; PBS洗6次, 3 min/次; 加入HRP酶标羊抗兔IgG mAb(1: 500), 37 °C孵育40 min, PBS洗6次, 3 min/次; 然后以DAB显色15 min、苏木精衬染、盐酸乙醇分化、脱水、透明、甘油封片后, 光学显微镜检查. PCNA免疫组化按说明书操作, 阳性表达定位于细胞核, 经免疫组化染色后呈棕黄色. 每组裸鼠观察4张切片(以下同), 在200倍视野下, 每张切片随机选取3个视野, 计算PCNA指数(PCNA Label Index, PCNA LI): PCNA LI=(阳性细胞面积/癌细胞总面积)×100%.
1.2.3 肿瘤组织原位细胞凋亡检测 采用TdT介导的DNA末端原位标记染色法(TUNEL法)检测, 按说明书方法操作, 凋亡细胞的细胞核染呈棕黄色. 在200倍视野下, 每张切片随机选取3个癌区, 计算凋亡细胞在全部癌细胞中所占的比例. 癌细胞凋亡指数(apoptotic index, AI): AI=(凋亡细胞面积/癌细胞总面积)×100%.
1.2.4 肿瘤内微血管密度(microvessel density, MVD)测定 采用鼠抗人CD34 mAb的标记链霉亲和素-生物素免疫组化方法染色, 200倍视野下, 每张切片计数3个血管密度最高区的微血管数并求其均数.
统计学处理 应用KS400图像分析系统(carl zeiss)进行形态定量观察, 每张切片随机取3个中倍视野(10×20, 367 855.85 μm2), 测定每个视野的阳性面积百分比, 以阳性面积百分比X平均灰度作为该视野的染色强度, 3个视野的平均染色强度作为该例的染色强度. 数据用SAS软件做方差分析.
扩增后的两种粗制重组腺病毒用TCID50法测定病毒滴度均为1×1012 TCID50/L. 重组腺病毒AdCA13-hENDO-VEGI151经PCR鉴定证实融合基因存在.
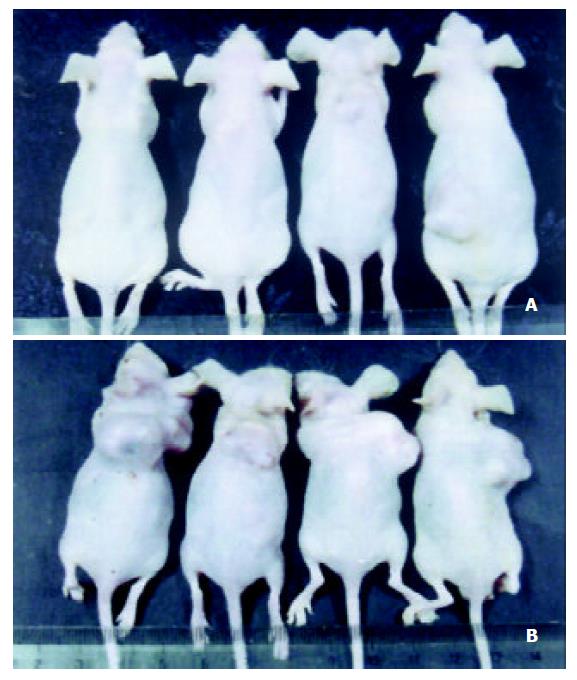
荷胃癌裸鼠经粗制重组腺病毒治疗20 d后, 瘤体积明显小于对照组(图1), 裸鼠其他脏器无肉眼可见的病变.治疗组(注射AdCA13-hENDO-VEGI151)与对照组(注射AdLacZ)间的肿瘤体积差异显著(328±156 mm3 vs 2 355.6±1 140.2 mm3, F =12.42, P =0.0 125), 抑瘤率为86.1%, 治疗组和对照组间肿瘤质量差异显著(0.34±0.09 g vs 2.47±0.31 g, F =177.69, P =0.0 001), 注射AdCA13-hENDO-VEGI151重组腺病毒有较明显的治疗效果. 注射重组腺病毒AdLacZ的胃癌组织冰冻切片, X-gal染色后组织学检查, 可见胃癌细胞蓝染, 经KS400图像分析系统计算, 报告基因LacZ经腺病毒转移到裸鼠胃癌细胞中的转染效率为59.8±1.8% (图2).
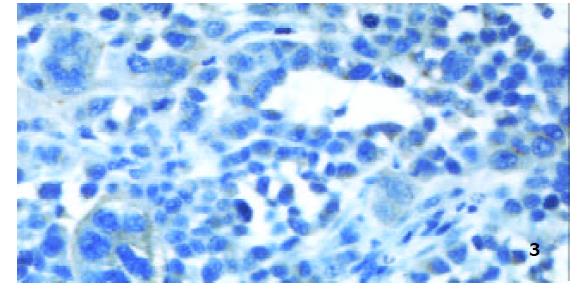
裸鼠胃癌组织切片用兔抗人Endostatin多抗免疫组化检测, 细胞质染呈棕黄色(图3). 裸鼠胃癌组织切片用PC10 mAb免疫组化检测, 细胞核染呈棕黄色, 对照组PCNA LI为1.40±0.53%, 治疗组为0.13±0.09%, 对照组和治疗组间PCNA LI差异显著(F =22.30, P =0.0033).
切片用TUNEL法检测, 细胞核染呈棕黄色, 对照组AI为0.61±0.67%, 治疗组为5.09±0.25%, 对照组和治疗组间AI差异显著(F =155.13, P =0.0 001).
切片用鼠抗人CD34 mAb免疫组化检测, 血管内皮细胞染呈棕黄色.对照组MVD为1.09±0.76%, 治疗组为0.06±0.03%, 对照组和治疗组间MVD差异明显(F =7.38, P =0.0 348).
目前的研究认为, 利用内源性血管生成抑制剂开展基因治疗是较有前途的治疗策略[20,21]. 由于内皮抑素与血管内皮细胞抑制因子均为内源性的蛋白分子, 对肿瘤生长都有较好的抑制作用, 因此我们利用重组腺病毒携带融合的两个强效内源性血管生成抑制基因, 治疗荷胃癌裸鼠, 抑瘤率达到86.1%. 但肿瘤生长只是被抑制, 延缓, 其大小并没有减小, 与直接注射内皮抑素蛋白使肿瘤消退还存在很大差距. 将X-gal染色片与兔抗人Endostatin多抗免疫组化检测结果相比较, LacZ基因的表达效率(阳性面积59.8±1.8%)似乎要高于融合基因的表达效率(阳性面积2.03±0.11%). 我们认为这两种染色方法本身差异很大.
PCNA为酸性蛋白, 仅在增生细胞中合成和表达, 是DNA多聚酶的一种辅助蛋白, 为DNA合成所必需, 在G0早期不表达, G1期开始表达, S期达到高峰, G2/M期减少, 是反应细胞增生活性的常用指标[22-26]. 本结果表明, 治疗组肿瘤的增生细胞核指数(PCNA LI)显著低于对照组, 说明重组腺病毒表达的融合蛋白对肿瘤的增生能力存在明显的抑制作用, 这种抑制作用是直接引起的还是通过其他途径引起的, 还需进一步阐明. 凋亡是正常细胞或病变细胞主动激发的一种以"自杀"机制, 恶性肿瘤具有无限增生能力的重要原因之一就是丧失自发性凋亡的能力. 凋亡细胞的特征是DNA分解, 结果产生DNA单链或双链缺口, 我们采用TUNEL方法[27,28], 即在末端脱氧核糖核酸转移酶的作用下, 用地高辛-核苷酸标记两种缺口3'-OH末端, 再用酶标记地高辛抗体予以显色. 实验结果表明治疗组肿瘤的凋亡指数(AI)明显高于对照组.
虽然新生血管生成是肿瘤发生和发展过程中的早期事件, 与肿瘤细胞的自发性凋亡是两个既相互独立又相互联系的事件, 但肿瘤细胞的凋亡受肿瘤组织新生血管化程度的影响十分显著. 微血管密度实验能较好地反映新生血管的生成状况[29,30], 实验结果显示, 治疗组肿瘤的MVD明显低于对照组, 说明融合蛋白可能通过抑制内皮细胞增生, 降低微血管密度, 从而降低肿瘤细胞的增生速率, 增加细胞凋亡.
总之, 重组腺病毒携带的融合基因能在裸鼠体内表达出有生物学活性的融合蛋白, 并表现出一定的抑瘤效果. 重组腺病毒表达的融合蛋白, 其治疗效果是否能倍增单基因表达蛋白的治疗效果, 还有待深入研究.
| 1. | Tomanek RJ, Schatteman GC. Angiogenesis: new insights and therapeutic potential. Anat Rec. 2000;261:126-135. [DOI] |
| 2. | Sauter BV, Martinet O, Zhang WJ, Mandeli J, Woo SL. Adenovirus-mediated gene transfer of endostatin in vivo results in high level of transgene expression and inhibition of tumor growth and metastases. Proc Natl Acad Sci USA. 2000;97:4802-4807. [DOI] |
| 3. | Kleinman HK, Liau G. Gene Therapy for Antiangiogenesis. J Natl Cancer Inst. 2001;93:965-967. [DOI] |
| 4. | Oehler MK, Bicknell R. The promise of anti-angiogenic cancer therapy. Br J Cancer. 2000;82:749-752. [DOI] |
| 5. | Thompson WD, Li WW, Maragoudakis M. The clinical manipulation of angiogenesis: pathology, side-effects, surprises, and opportunities with novel human therapies. J Pathol. 2000;190:330-337. [DOI] |
| 6. | Vacca A, Ribatti D, Pellegrino A, Dammacco F. Angiogenesis and anti-angiogenesis in human neoplasms. Recent developments and the therapeutic prospects. Ann Ital Med Int. 2000;15:7-19. |
| 7. | Dixelius J, Larsson H, Sasaki T, Holmqvist K, Lu L, Engstrom A, Timpl R, Welsh M, Claesson-Welsh L. Endostatin-induced tyrosine kinase signaling through the Shb adaptor protein regulates endothelial cell apoptosis. Blood. 2000;95:3403-3411. |
| 8. | Eriksson K, Magnusson P, Dixelius J, Claesson-Welsh L, Cross MJ. Angiostatin and endostatin inhibit endothelial cell migration in response to FGF and VEGF without interfering with specific intracellular signal transduction pathways. FEBS Lett. 2003;536:19-24. [DOI] |
| 9. | Nakashima Y, Yano M, Kobayashi Y, Moriyama S, Sasaki H, Toyama T, Yamashita H, Fukai I, Iwase H, Yamakawa Y. Endostatin gene therapy on murine lung metastases model utilizing cationic vector-mediated intravenous gene delivery. Gene Ther. 2003;10:123-130. [DOI] |
| 10. | Yu J, Tian S, Metheny-Barlow L, Chew LJ, Hayes AJ, Pan H, Yu GL, Li LY. Modulation of endothelial cell growth arrest and apoptosis by vascular endothelial growth inhibitor. Circ Res. 2001;89:1161-1167. [DOI] |
| 11. | Zhang M, Wang L, Wang HW, Pan X, Pan W, Qi ZT. Effect of N-terminal deletion on biological activity of vascular endothelial cell growth inhibitor. Shengwu Huaxue Yu Shengwu Wuli Xuebao. 2003;35:133-137. |
| 12. | Wang L, Pan W, Zhu FL, Jiao BH, Lou YH, Xiao Y, Qi ZT. Cloning, Expression and biological activity of VEGI(151), a novel vascular endothelial cell growth inhibitor. Shengwu Hua xue Yu Shengwu Wuli Xuebao. 2000;32:485-489. |
| 13. | Chew LJ, Pan H, Yu J, Tian S, Huang WQ, Zhang JY, Pang S, Li LY. A novel secreted splice variant of vascular endothelial cell growth inhibitor. FASEB J. 2002;16:742-744. [DOI] |
| 14. | Zhang GF, Wang YH, Zhang MA, Wang Q, Luo YB, Wang DS, Han CR. Inhibition of growth and metastases of human colon cancer xenograft in nude mice by angiogenesis inhibitor endostatin. Ai Zheng. 2002;21:50-53. |
| 15. | Zhang X, Liu S, Liang C, Yang H. Adenovirus-mediated Rb gene transfect for head and neck cancer. Huaxi Yike Daxue Xuebao. 2001;32:194-195. |
| 16. | Nicklin SA, Reynolds PN, Brosnan MJ, White SJ, Curiel DT, Dominiczak AF, Baker AH. Analysis of cell-specific promoters for viral gene therapy targeted at the vascular endothelium. Hypertension. 2001;38:65-70. [DOI] |
| 17. | Mahasreshti PJ, Navarro JG, Kataram M, Wang MH, Carey D, Siegal GP, Barnes MN, Nettelbeck DM, Alvarez RD, Hemminki A. Adenovirus-mediated soluble FLT-1 gene therapy for ovarian carcinoma. Clin Cancer Res. 2001;7:2057-2066. |
| 18. | Wu J, Shi YQ, Wu KC, Zhang DX, Yang JH, Fan DM. Angiostatin up-regulation in gastric cancer cell SGC7901 inhibits tumorigenesis in nude mice. World J Gastroenterol. 2003;9:59-64. [DOI] |
| 19. | Reszec J, Sulkowska M, Famulski W, Guzinska-Ustymowicz K, Sulkowski S. The expression of tumorigenesis markers in oral papilloma. Pol J Pathol. 2002;53:195-200. |
| 20. | Matsuda KM, Madoiwa S, Hasumi Y, Kanazawa T, Saga Y, Kume A, Mano H, Ozawa K, Matsuda M. A novel strategy for the tumor angiogenesis-targeted gene therapy: generation of angiostatin from endogenous plasminogen by protease gene transfer. Cancer Gene Ther. 2000;7:589-596. [DOI] |
| 21. | Kuo CJ, Farnebo F, Yu EY, Christofferson R, Swearingen RA, Carter R, von Recum HA, Yuan J, Kamihara J, Flynn E. Comparative evaluation of the antitumor activity of antiangiogenic proteins delivered by gene transfer. Proc Natl Acad Sci USA. 2001;98:4605-4610. [DOI] |
| 22. | Norata GD, Tonti L, Roma P, Catapano AL. Apoptosis and proliferation of endothelial cells in early atherosclerotic lesions: possible role of oxidised LDL. Nutr Metab Cardiovasc Dis. 2002;12:297-305. |
| 23. | Konouchi H, Asaumi J, Yanagi Y, Shigehara H, Hisatomi M, Matsuzaki H, Kishi K. Evaluation of tumor proliferation using dynamic contrast enhanced-MRI of oral cavity and oropharyngeal squamous cell carcinoma. Oral Oncol. 2003;39:290-295. [DOI] |
| 24. | Noguchi N, Kawashiri S, Tanaka A, Kato K, Nakaya H. Effects of fibroblast growth inhibitor on proliferation and metastasis of oral squamous cell carcinoma. Oral Oncol. 2003;39:240-247. [DOI] |
| 25. | Ishikawa T, Chen J, Wang J, Okada F, Sugiyama T, Kobayashi T, Shindo M, Higashino F, Katoh H, Asaka M. Adrenomedullin antagonist suppresses in vivo growth of human pancreatic cancer cells in SCID mice by suppressing angiogenesis. Oncogene. 2003;22:1238-1242. [DOI] |
| 26. | Zorc M, Vraspir-Porenta O, Zorc-Pleskovic R, Radovanovic N, Petrovic D. Apoptosis of myocytes and proliferation markers as prognostic factors in end-stage dilated cardiomyopathy. Cardiovasc Pathol. 2003;12:36-39. [DOI] |
| 27. | Oberhaus SM. TUNEL and immunofluorescence double-labeling assay for apoptotic cells with specific antigen(s). Methods Mol Biol. 2003;218:85-96. |
| 28. | Popescu BO, Oprica M, Sajin M, Stanciu CL, Bajenaru O, Predescu A, Vidulescu C, Popescu LM. Dantrolene protects neurons against kainic acid induced apoptosis in vitro and in vivo. J Cell Mol Med. 2002;6:555-569. [DOI] |
| 29. | Fu QH, Yu H, Wang QQ, Wu QL. Antiangiogenesis effect of linomide in treatment of transplanted human oral carcinoma in nude mice and its relations to regulation on cytokine secretion of macrophage. Zhejiang Daxue Xuebao Yixuebao. 2002;31:273-276. |
| 30. | Olewniczak S, Chosia M, Kwas A, Kram A, Domagala W. Angiogenesis and some prognostic parameters of invasive ductal breast carcinoma in women. Pol J Pathol. 2002;53:183-188. |