修回日期: 2002-12-30
接受日期: 2003-01-14
在线出版日期: 2003-08-15
本实验通过检测肝硬变大鼠肝部分切除术动物模型肝组织内细胞周期蛋白(Cyclin)A、B和D的表达以及癌基因调节蛋白的变化, 研究Cyclin及其癌基因调节蛋白在肝细胞再生中的作用.
采用CCL4制作大鼠肝硬模型, 切除大鼠肝脏的左叶和中叶. 采用免疫组化和原位杂交的方法, 观察大鼠肝脏Cyclin A和Cyclin D及相关因子变化.
术后肝细胞Cyclin A和D mRNA的表达和分布基本相似, 主要在胞质和胞核内. 在中央静脉等静脉血管的周围, 其阳性表达量高且表达出现时间早, 在术后6 h已有明显的表达出现. 在肝细胞再生过程中, Cyclin A和D mRNA的表达明显, 呈局灶样分布. Cyclin B和Rb蛋白主要分布在细胞核和胞质内, 在术后6-24 h, Cyclin B和Rb在肝细胞有较强的阳性表达. P27的表达在术后 24 h开始出现, 术后1 wk点最显著, RB蛋白也呈现较强的阳性表达.
肝细胞再生机制可能是通过多种途径共同作用的结果.
引文著录: 陈平, 李昆, 董家鸿, 韩本立. 肝硬化大鼠肝部分切除后肝细胞生长周期的调控. 世界华人消化杂志 2003; 11(8): 1152-1155
Revised: December 30, 2002
Accepted: January 14, 2003
Published online: August 15, 2003
To investigate the effects of cyclins and oncogene proteins on liver regeneration after partial hepatectomy in cirrhotic rats.
By employing immunohistochemistry and in situ hybridization, we observed the changes of liver cyclin A, D and oncogene proteins in the model of rat liver cirrhosis(CCL4) after partial hepatectomy.
The expressions and distributions of hepatocyte cyclin A and D were similar, which were mainly in the cytoplasm and nuclei of the cells. Around the central veins, the expressions were high and early at about 6 h postoperation. During liver regeneration, the expressions of cyclin A and D mRNA were marked and locally distributed. Cyclin B and Rb proteins were distributed in the cytoplasm and nuclei of the cells. Cyclin B and Rb proteins had stronger expressions in the liver at 6-24 h after operation. P27 expressions occured at 24 h after operation, and were most marked at 1 wk after operation. RB protein also showed stronger expressions.
Liver regeneration is dependent on a muti-pathway mechanism.
- Citation: Chen P, Li K, Dong JH, Han BL. Changes of hepatocyte cell cycle after partial hepatectomy in cirrhotic rat liver. Shijie Huaren Xiaohua Zazhi 2003; 11(8): 1152-1155
- URL: https://www.wjgnet.com/1009-3079/full/v11/i8/1152.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i8.1152
肝硬状态下行肝部分切除术后肝细胞再生的机制, 目前尚不清楚[1-3]. 虽经几十年的努力, 肝细胞再生是如何启动的, 又是如何中止的, 肝细胞再生过程主要受何种因素的影响等问题, 目前尚无很好的答案[4,5]. 我们通过检测肝硬大鼠肝部分切除术后肝组织内细胞周期蛋白(Cyclin)A, B和D的表达以及癌基因调节蛋白的变化, 研究Cyclin及其癌基因调节蛋白在肝细胞再生中的作用.
P27单克隆抗体(兔抗血清)由美国的Sherr教授赠送. Cyclin D cDNA质粒: 由丹麦Tygatrup教授赠送. Cyclin A cDNA质粒: 由法国Patrizia Paterlini教授赠送. Cyclin B 单克隆抗体(兔抗血清): 由美国 Ruderman博士赠送. RB单克隆抗体由北京中山生物技术有限公司提供.
健康、♂Wistar大鼠, 质量220-250 g, 皮下注射 CCL4 油溶液(600 ml/L)加口服乙醇的方法制作肝硬模型, 在动物稳定1 wk后进行实验[6]. 肝部分切除采用乙醚麻醉, 腹部正中切口, 切除大鼠肝脏的左叶和中叶, 切除量占全肝的70%. 手术后大鼠自由进食、饮水. 观察点为术后6, 24, 48, 72 h和术后1 wk. Cyclin A和 D探针的质粒DNA的提取采用Promega公司提供的试剂盒进行. Cyclin A用EcoR I, Cyclin D用Not I酶切, 琼脂糖凝胶电泳, 电泳凝胶中回收DNA片段采用原平公司生产的DNA回收试剂盒, 按使用说明书进行. 于254 nm波长的紫外灯下观察电泳结果. Cyclin A和D探针的标记, 采用Boehringer公司地高辛标记试剂盒, 参照其说明书进行. 原位杂交采用常规的方法进行[7,8]. 从液氮罐内取出冻存的肝组织标本, 在冰冻切片机上切片, 切片厚度为5 μm. 采用福建迈新的免疫组化试剂盒和DAB染剂, 加入抗大鼠Cyclin B, Rb和P27一抗. 凡切片内见细胞或细胞核呈棕黄色颗粒或染色, 视为阳性.
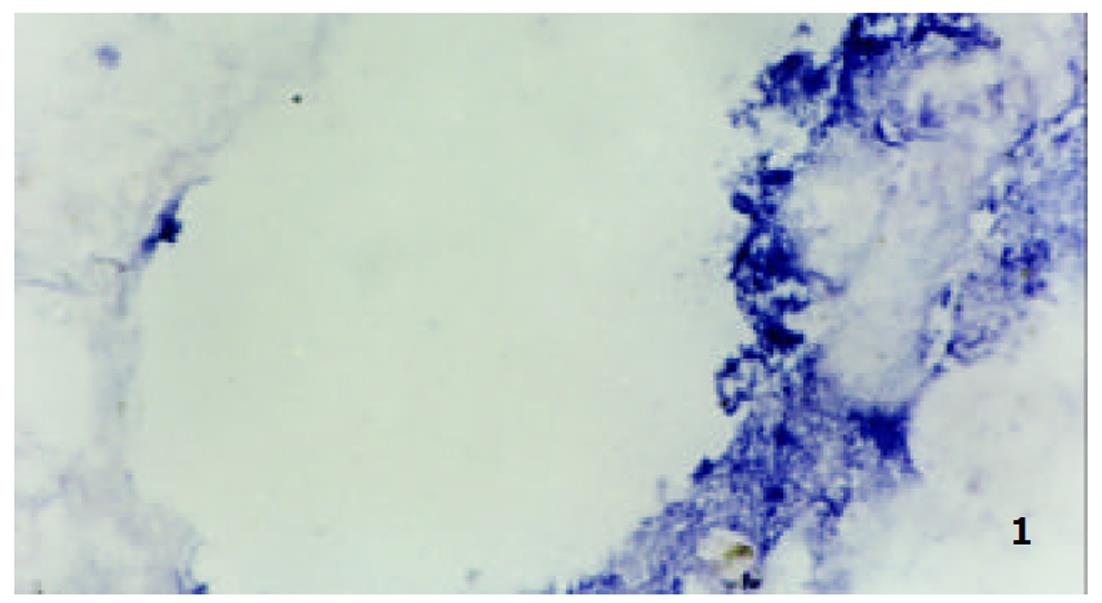
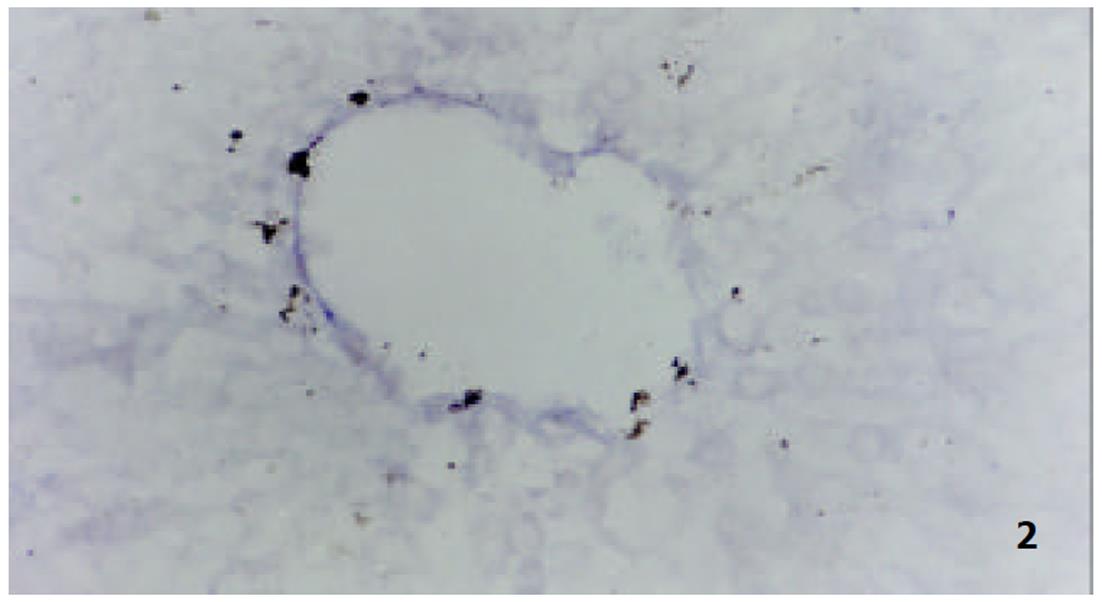
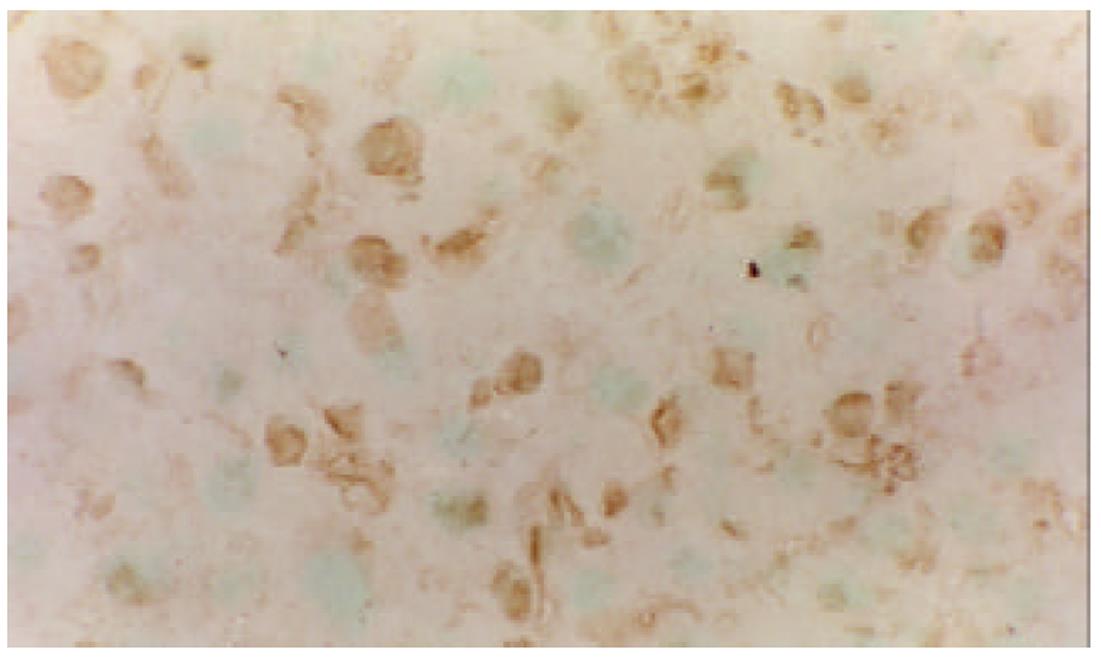
我们应用原位杂交技术观察肝硬变大鼠肝部分切除术后肝细胞Cyclin A和D mRNA的表达和分布基本相似, 主要在细胞的胞质内, 特别在中央静脉等静脉血管的周围, 其阳性表达量高且表达出现时间早, 在术后6h已有明显的表达出现. 正常组肝细胞Cyclin A和D mRNA的表达较低, 阳性反应不明显(图1, 图2, 图3).
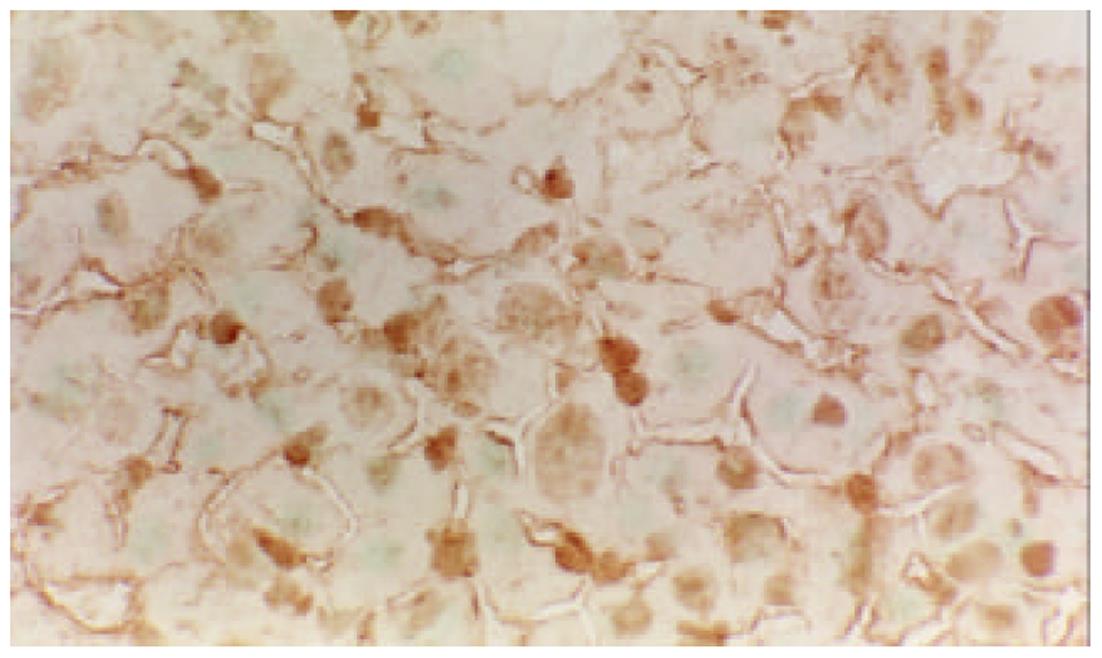
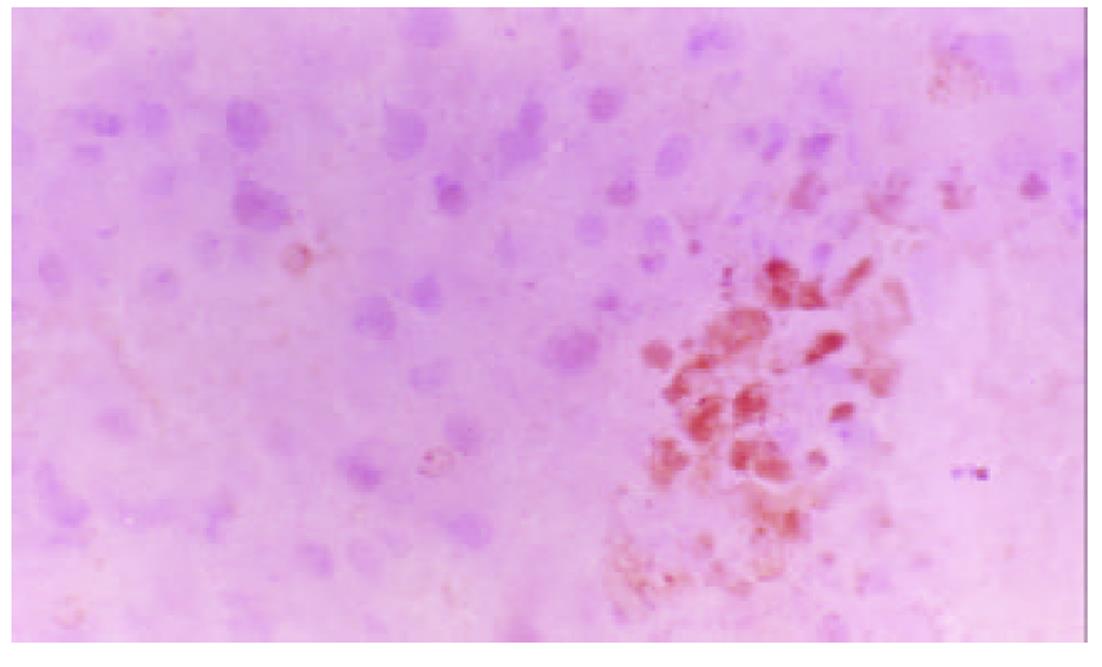
Cyclin B, Rb, P27主要分布在细胞核和细胞质内, 在术后6-24 h, Cyclin B和Rb在肝细胞有较强的阳性表达. 而RB较强的阳性表达一致持续到术后1 wk, 也就是说RB在肝细胞再生过程中一直都有较强的阳性表达. P27的表达出现晚于前二者, 在术后24h点以后开始明显, 术后1 wk点最为显著. 在正常对照组, 肝细胞Cyclin B, Rb, P27未见阳性表达(图4, 图5, 图6).
生长激素、细胞因子和一些癌基因产物在细胞增生过程中发挥重要作用[9-12]. 然而单纯应用细胞生长因子并不能很好促进肝细胞再生, 有时得到自相矛盾的结果[13-15]. 细胞再生有两个最关键的问题是DNA的复制和有丝分裂, 他们由Cyclin依赖激酶(CDKs)、Cyclin调节亚基和CDC-2家族激酶控制[16-19]. 在哺乳类动物的真核细胞中, Cyclin有5种类型, 即A、B、C、D和E 5种类型. 他是细胞分裂周期基因的调节单位, 其含量在细胞的不同时期呈周期性的变化, 激活其相关蛋白激酶, 使之具有特定的蛋白激酶活性[20]. G1期是细胞分裂增生的关键时期. 在哺乳类动物的G1期, Cyclin(C, D和E)表达的量和活性均为最大, 推动着G1期向S期发展, 而其中Cyclin D发挥着更为重要的作用[21-23]. Cyclin A/B分别在细胞周期的S后期和M期起作用, 推动细胞周期的进程[24]. 在70%的肝切除大鼠模型上, Cyclin D的表达高于对照组20倍以上, 且先于DNA合成. 在HGF等细胞因子的刺激下, Cyclin D mRNA 的表达高于对照3-5倍. 细胞因子能刺激Cyclin, 促使其发生变化, 因此Sherr也认为Cyclin D作为细胞因子的效应器[25]. 我们结果显示, 术后肝细胞Cyclin A和D mRNA的表达和分布基本相似, 他们主要分布在细胞的胞质和胞核内. 在中央静脉等静脉血管的周围, 其阳性表达量高且表达出现时间早, 在术后6 h已有明显的表达出现. 在肝细胞再生过程中, 肝细胞Cyclin A和D mRNA的表达明显, 呈局灶样分布. 这些结果表明, Cyclin A和D在肝细胞再生过程中发挥重要作用. 其肝细胞的增生很可能从中央静脉等静脉血管周围开始的. 我们同时观察了肝细胞Cyclin B和Rb蛋白, 主要分布在细胞核和细胞内, 在术后6-24 h, Cyclin B和Rb在肝细胞有较强的阳性表达. 而正常对照组Cyclin B和Rb蛋白肝细胞未见表达. 这些结果都提示Cyclin B和Rb蛋白参与肝细胞再生, 促进细胞周期的进程.
肝细胞再生中止具有相当的精确性, 行肝部分切除术后其肝细胞再生的中止均有其相似性[26]. 当再生到术前肝脏重量的10%的范围内时, 肝细胞生长就停止了, 这提示肝细胞内有一整套系统来管理肝细胞再生. 但目前对肝细胞再生中止的机制远未弄清. 阻止细胞周期进程的因素主要是CKIs, 对哺乳类动物细胞起作用的是P27、P21和P16[27,28]. P27、P21和P16这3种CKIs阻止细胞周期进程的机制不一样, 其中最重要的是P27, P27的功能: 阻止G1期的进程; TGF-β活化和细胞之间的接触抑制; P27通过胞外信号的刺激, 如细胞因子TGF-β的刺激使P27活化. 当然细胞周期内在的变化也可活化P27. TGF-β能抑制肝细胞DNA的合成, 从而阻止肝细胞再生. 同时还发现TGF-β能活化P27. 研究表明, 在肝细胞再生的后期(术后72 h点以后), TGF-β出现较高表达, 在术后1 wk时, 其表达量仍然很高, 明显高于对照, 这样高表达的TGF-β完全有可能和有能力刺激P27, 促使其活化. 我们免疫组化结果显示, P27的表达出现较晚, 在术后24 h以后开始出现, 术后1 wk最为显著. 提示P27很可能是肝细胞再生中止的重要因素之一.
RB蛋白是视网膜母细胞瘤蛋白抑制基因产物, 他的主要作用是中止细胞周期进程, 他能调控细胞周期关键点的基因表达[29,30]. 在细胞从G1期向S期转变时, 其表达水平非常高. Cyclin D可使RB蛋白失活, 从而使细胞进入S期和进行DNA的复制. 也说明Cyclin D和RB的共同作用, 在细胞的增生和分化方面起重要的开关作用. 我们的结果显示, 肝硬变大鼠术后1 wk内肝细胞RB蛋白均呈现较强的阳性表达, 这支持以上的研究, 提示RB蛋白在肝细胞再生过程中起促进或抑制肝细胞增生的作用.
我们认为, 增生细胞在生长因子的刺激之下, 使Cyclin D和A在G1期适当的表达, 从而启动肝细胞再生. Cyclin D同一些癌基因产物, 如RB等, 共同作用, 调节细胞周期的进程. 肝细胞通过RB蛋白的磷酸化和去磷酸化来影响Cyclin功能的活性, 同时肝细胞再生过程中, TGF-β的高表达将促使肝细胞P27的活化, 抑制肝细胞再生. 因此肝细胞再生的中止的机制可能是通过多种途径共同作用的结果.
| 2. | Court FG, Wemyss-Holden SA, Dennison AR, Maddern GJ. The mystery of liver regeneration. Br J Surg. 2002;89:1089-1095. [DOI] |
| 4. | Kountouras J, Boura P, Lygidakis NJ. Liver regeneration after hepatectomy. Hepatogastroentero. 2001;48:556-562. |
| 5. | Tilg H. Cytokines and liver diseases. Can J Gastroenterol. 2001;15:661-668. [DOI] |
| 8. | J萨姆布鲁克, EF弗里奇, T曼尼阿蒂斯. 分子克隆实验指南(第2版). 北京: 科学出版社 1996; 362-371. |
| 9. | Diehl AM. Liver regeneration. Front Biosci. 2002;7:301-314. [DOI] |
| 10. | Moriuchi A, Hirono S, Ido A, Ochiai T, Nakama T, Uto H, Hori T, Hayashi K, Tsubouchi H. Additive and inhibitory effects of simultaneous treatment with growth factors on DNA synthesis through MAPK pathway and G1 cyclins in rat hepatocytes. Biochem Biophys Res Commun. 2001;280:368-373. [PubMed] [DOI] |
| 11. | Trautwein C, Rakemann T, Malek NP, Plumpe J, Tiegs G, Manns MP. Concanavalin A-induced liver injury triggers hepatocyte proliferation. J Clin Invest. 1998;101:1960-1969. [PubMed] [DOI] |
| 12. | Leu JI, Crissey MA, Craig LE, Taub R. Impaired hepatocyte DNA synthetic response posthepatectomy in insulin-like growth factor binding protein 1-deficient mice with defects in C/EBP beta and mitogen-activated protein kinase/extracellular signal-regulated kinase regulation. Mol Cell Biol. 2003;23:1251-1259. [DOI] |
| 13. | Talarmin H, Rescan C, Cariou S, Glaise D, Zanninelli G, Bilodeau M, Loyer P, Guguen-Guillouzo C, Baffet G. The mitogen-activated protein kinase kinase/extracellular signal-regulated kinase cascade activation is a key signalling pathway involved in the regulation of G(1) phase progression in proliferating hepatocytes. Mol Cell Biol. 1999;19:6003-6011. [DOI] |
| 14. | Weglarz TC, Sandgren EP. Timing of hepatocyte entry into DNA synthesis after partial hepatectomy is cell autonomous. Proc Natl Acad Sci USA. 2000;97:12595-12600. [PubMed] [DOI] |
| 15. | Drixler TA, Vogten MJ, Ritchie ED, van Vroonhoven TJ, Gebbink MF, Voest EE, Borel Rinkes IH. Liver regeneration is an angiogenesis- associated phenomenon. Ann Surg. 2002;236:703-711. [DOI] |
| 16. | Albrecht JH, Rieland BM, Nelsen CJ, Ahonen CL. Regulation of G(1) cyclin-dependent kinases in the liver: role of nuclear localization and p27 sequestration. Am J Physiol. 1999;277:G1207-1216. [PubMed] |
| 17. | Sherr CJ, Roberts JM. CDK inhibitors: positive and negative regulators of G1-phase progression. Genes Dev. 1999;13:1501-1512. [PubMed] |
| 18. | Jaumot M, Estanyol JM, Serratosa J, Agell N, Bachs O. Activation of cdk4 and cdk2 during rat liver regeneration is associated with intranuclear rearrangements of cyclin-cdk complexes. Hepatol. 1999;29:385-395. [PubMed] [DOI] |
| 19. | Wang X, Kiyokawa H, Dennewitz MB, Costa RH. The Forkhead Box m1b transcription factor is essential for hepatocyte DNA replication and mitosis during mouse liver regeneration. Proc Natl Acad Sci USA. 2002;99:16881-16886. [PubMed] [DOI] |
| 20. | Nelsen CJ, Hansen LK, Rickheim DG, Chen C, Stanley MW, Krek W, Albrecht JH. Induction of hepatocyte proliferation and liver hyperplasia by the targeted expression of cyclin E and skp2. Oncogene. 2001;20:1825-1831. [PubMed] [DOI] |
| 21. | Rickheim DG, Nelsen CJ, Fassett JT, Timchenko NA, Hansen LK, Albrecht JH. Differential regulation of cyclins D1 and D3 in hepatocyte proliferation. Hepatol. 2002;36:30-38. [PubMed] [DOI] |
| 22. | Nelsen CJ, Rickheim DG, Timchenko NA, Stanley MW, Albrecht JH. Transient expression of cyclin D1 is sufficient to promote hepatocyte replication and liver growth in vivo. Cancer Res. 2001;61:8564-8568. [PubMed] |
| 23. | Hansen LK, Albrecht JH. Regulation of the hepatocyte cell cycle by type I collagen matrix: role of cyclin D1. J Cell Sci. 1999;112:2971-2981. [PubMed] |
| 24. | Greenbaum LE, Li W, Cressman DE, Peng Y, Ciliberto G, Poli V, Taub R. CCAAT enhancer- binding protein beta is required for normal hepatocyte proliferation in mice after partial hepatectomy. J Clin Invest. 1998;102:996-1007. [DOI] |
| 25. | Sherr CJ. Cell cycle control and cancer. Harvey Lect 2000-. 2001;96:73-92. [PubMed] |
| 26. | Nagy P, Bisgaard HC, Schnur J, Thorgeirsson SS. Studies on hepatic gene expression in different liver regenerative models. Biochem Biophys Res Commun. 2000;272:591-595. [PubMed] [DOI] |
| 27. | Albrecht JH, Poon RY, Ahonen CL, Rieland BM, Deng C, Crary GS. Involvement of p21 and p27 in the regulation of CDK activity and cell cycle progression in the regenerating liver. Oncogene. 1998;16:2141-2150. [PubMed] [DOI] |
| 28. | Morita T, Togo S, Kubota T, Kamimukai N, Nishizuka I, Kobayashi T, Ichikawa Y, Ishikawa T, Takahashi S, Matsuo K. Mechanism of postoperative liver failure after excessive hepatectomy investigated using a cDNA microarray. J Hepatobil Pancreat Surg. 2002;9:352-359. [PubMed] [DOI] |
| 29. | Deguchi M, Shiraki K, Inoue H, Okano H, Ito T, Yamanaka T, Sugimoto K, Sakai T, Ohmori S, Murata K. Expression of survivin during liver regeneration. Biochem Biophys Res Commun. 2002;297:59-64. [DOI] |
| 30. | Qu Z, Weiss JN, MacLellan WR. Regulation of the mammalian cell cycle: a model of the G1-to-S transition. Am J Physiol Cell Physiol. 2003;284:C349-364. [PubMed] [DOI] |