修回日期: 2003-02-20
接受日期: 2003-03-21
在线出版日期: 2003-07-15
了解丙型肝炎病毒核心蛋白和细胞周期调节蛋白Wee1基因表达的关系, 研究HCV核心蛋白在HCV致病的分子生物学机制中的作用.
应用聚合酶链反应(PCR)扩增Wee1基因启动子, 命名为Weep. 以T-A克隆法, 将Weep基因片段连入载体pGEM-T. 将获得的质粒pT-Weep, 与报告质粒pCAT3-basic分别用KpnI和XhoI 双酶切后构建Wee1启动子报告载体pCAT3-Weep, 分别以重组报告载体pCAT3-Weep和pcDNA3.1(-)-core瞬时转染HepG2细胞, 以转染pCAT3 basic的HepG2细胞为阴性对照, 48 h后收获细胞. 应用酶联免疫黏附方法(ELISA)检测细胞中氯霉素乙酰转移酶(CAT)的表达活性, 以了解HCV核心蛋白对Wee1基因启动子的反式激活作用.
构建的表达载体pcDNA3.1(-)-core和报告载体pCAT3-Weep经过序列分析和酶切鉴定正确. pCAT3-Weep和pcDNA3.1(-)-core瞬时转染的HepG2细胞的CAT表达活性是CAT3空载体的3.4倍, pCAT3-Weep的2.3倍.
丙型肝炎病毒核心蛋白可反式激活Wee1基因启动子, 进而上调细胞周期调节基因Wee1的表达.
引文著录: 王建军, 刘妍, 成军, 杨倩, 杨艳杰. 丙型肝炎病毒核心蛋白上调细胞周期调节蛋白Wee1基因表达研究. 世界华人消化杂志 2003; 11(7): 947-950
Revised: February 20, 2003
Accepted: March 21, 2003
Published online: July 15, 2003
To investigate the transactivating effect of HCV core protein on Wee1 gene and the molecular biological mechanisms of HCV core protein in HCV pathogenicity.
Polymerase chain reaction (PCR) technique was employed to amplify the sequence of Wee1 promoterfrom HepG2 genomic DNA, and the product was cloned into pGEM-T vector. The Weep gene was cut from T-Weep by KpnI and XhoI, and then cloned into pCAT3 basic, named pCAT3- Weep. pCAT3-Weep was transfected into the hepatoblastoma cell line HepG2 and cotransfected HepG2 cells with pcDNA3.1(-)-core by FuGENE 6 transfection reagents. The HepG2 cells transfected with pCAT3-basic was used as negative control. The activity of CAT in HepG2 cells transfected was detected by an ELISA kit after 48 hours, which reflected the transactivating function of HCV core protein to Wee1 gene promoter.
The expressive vector pcDNA3.1(-)-core and report vector pCAT3-Weep have been constructed and confirmed by restriction enzyme digestion and sequencing.The expression of CAT in Hep G2 cells transfected with pCAT3-Weep and pcDNA3.1(-)-core was 3.4 times as higher as that of pCAT3-basic, and 2.3 times as higher as that of pCAT3-Weep.
It is suggested that HCV core protein can transactivate cell cycle gene Wee1 promoter, and then upregulate the expression of the gene.
- Citation: Wang JJ, Liu Y, Cheng J, Yang Q, Yang YJ. Up-regulating effect of hepatitis C virus core protein on expression of cell cycle gene Wee1. Shijie Huaren Xiaohua Zazhi 2003; 11(7): 947-950
- URL: https://www.wjgnet.com/1009-3079/full/v11/i7/947.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i7.947
丙型肝炎病毒(HCV)基因组含有单一的开放读码框架, 编码3010-3033个氨基酸残基的多肽前体, 两侧是5'-非翻译区及3'-非翻译区. 多肽前体至少被加工为十种结构蛋白和非结构蛋白, 其中核心区(1-573 nt)编码的21 kD HCV核衣壳蛋白(191 aa)是一种多功能蛋白质, 在HCV致病过程中可能起着重要的作用[1-5], 最近研究其与HCV感染后脂肪肝的形成也有一定关系[6-8].本研究采用基因重组技术构建pCAT3-Weep、pcDNA3.1(-)-core报告基因载体, 应用报告基因氯霉素乙酰转移酶(CAT)共转染瞬时表达系统, 测得下游CAT基因的表达增强. 证明HCV核心蛋白可上调Wee1启动子活性, 进而上调Wee1基因的表达, 从而为研究HCV致病的分子生物学机制提供了证据.
菌种及细胞株: 重组表达载体pcDNA3.1(-)-core为本室构建, 人肝母细胞瘤细胞系Hep G2细胞及大肠杆菌JM109菌株为本室保存. 工具酶: Tag DNA 聚合酶、T4 DNA 连接酶及限制性内切酶均购自Takara公司. 试剂盒: 质粒DNA提取试剂盒, 中间载体pGEM-T及报告质粒pCAT3-basic均购自Promega公司; CAT-ELISA检测试剂盒及质粒DNA转染试剂盒购自Roche公司. 其他生化试剂购自Sigma公司.
1.2.1 目的基因的扩增与纯化 以Hep G2细胞基因组DNA为模板, 设计引物. 在上下游引物的5'端分别引入KpnI和XhoI单一酶切位点, 上游引物P1: 5'-GGT ACC TGA GAC CAG CCT GCC AAC AT- 3'. 下游引物P2: 5'-GAA TTC ATG TGC TTA GGC TGG ACA CTG-3', PCR扩增包含Wee1基因启动子全序列的DNA片段, PCR产物经10 g/L琼脂糖凝胶电泳, 切胶, 回收纯化, 命名为Weep.
1.2.2 CAT3报告载体的构建、纯化和DNA测序 以T-A克隆法, 用T4 DNA连接酶将Weep基因片段连入载体pGEM-T. 将获得的质粒pT-Weep 和报告质粒pCAT3-basic分别用KpnI和XhoI 双酶切后用T4 DNA连接酶进行定向连接, 产物转化JM109宿主菌, 筛选抗氨苄青霉素阳性菌落; 提取质粒, 再次双酶切及PCR鉴定正向插入克隆, 命名为pCAT3-Weep.
1.2.3 真核表达载体的鉴定 将pcDNA3.1(-)-core质粒分别进行EcoRI/BamHI双酶切和HindIII单酶切及PCR鉴定. PCR鉴定核心基因的上下游引物分别为: 5'-C GCA GAA TTC ATG AGC ACG AAT CCT AA-3', 5'-AT ATG GAT CCA GGC TGA AGC GGG CAC A-3'.DNA测序由上海博亚公司完成.
1.2.4 细胞转染及Weep活性检测 磁珠法提取质粒pCAT3-Weep以备转染, 以标准方案培养Hep G2细胞. 具体转染方法参照转染说明书进行. 转染48 h后收集细胞, 收集细胞裂解液, 用于CAT活性检测.
1.2.5 pcDNA3.1(-)-core与pCAT3-Weep共转染实验 pcDNA3.1(-)-core与pCAT3-Weep共转染Hep G2细胞, 同时以转染pCAT3-Weep的Hep G2细胞作阴性对照. 转染48 h后, 收集细胞裂解液, 用于CAT活性检测. 所有实验严格平行操作.
1.2.6 CAT含量检测 按照试剂盒说明书进行. 取1.0 ng/mL 的CAT标准品(试剂盒提供)及细胞裂解液200μL加入已包被抗体的96孔板中, 37 °C温育2 h, 再依次加入第一抗体(地高辛标记的抗-CAT)、第二抗体(耦联有过氧化物酶的地高辛抗体抗-DIG-POD)200μL 37 °C温育1 h后, 加入过氧化物酶的底物室温显色10-30 min.用酶标仪检测标本在415 nm波长的吸光度, 其数值反映细胞提取物中的CAT表达水平. 以未作转染的细胞裂解液平行实验作空白对照.
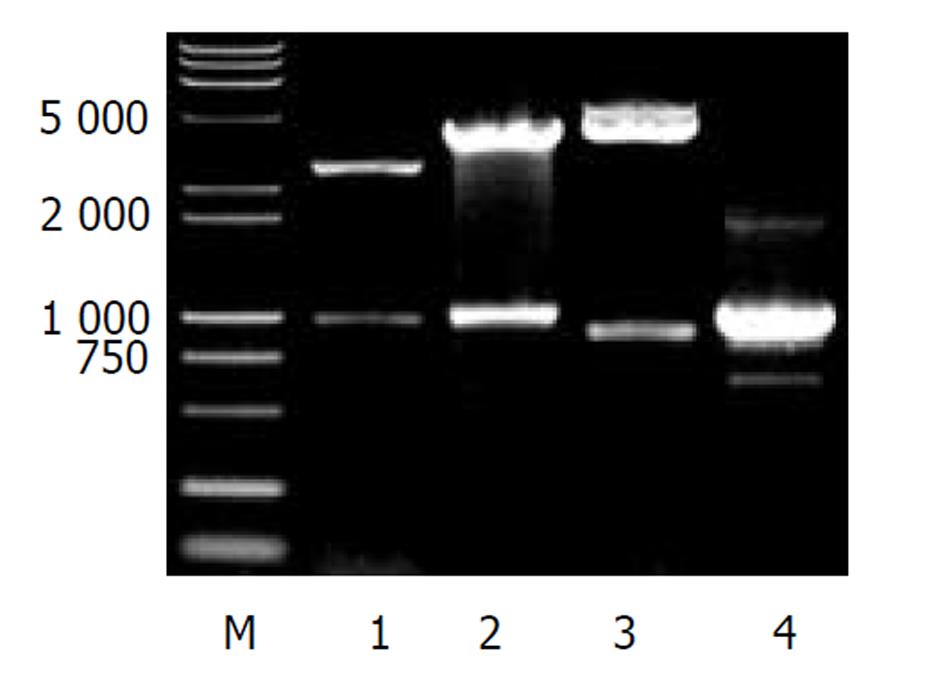
pCAT3-Weep鉴定电泳图谱如图1所示, 构建的中间载体pT-Weep以XhoI/KpnI双酶切电泳图谱为两条带: 988 bp(Weep基因片段)、3015 bp(pGEM-T空载体); DNA测序证实重组质粒含有988 bp的目的基因, 读码框架正确.重组质粒pCAT3-Weep分别以XhoI/KpnI双酶切及PCR鉴定均显示988 bp正向插入条带. 说明重组质粒pCAT3-Weep构建正确.
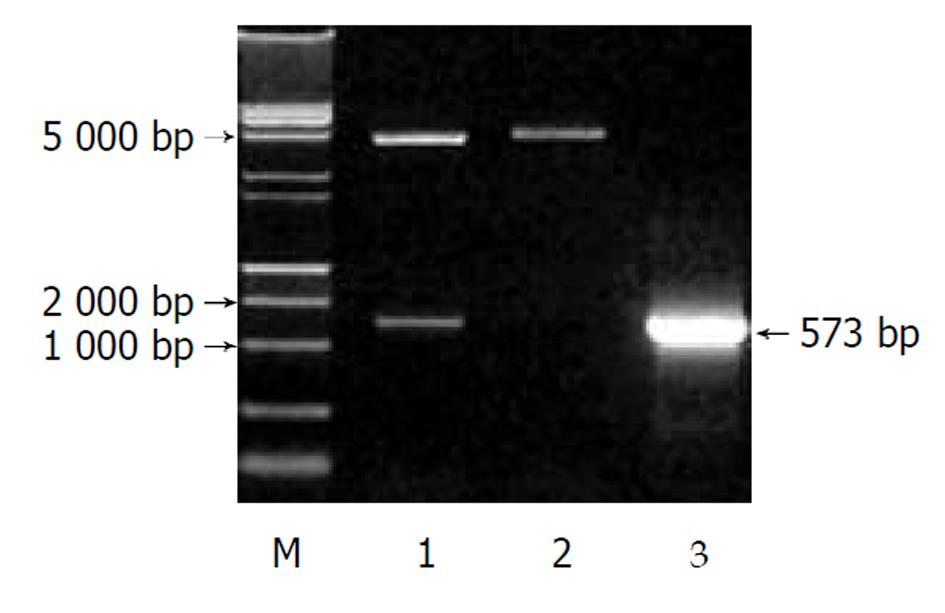
pcDNA3.1(-)-core鉴定电泳图谱如图2所示, 双酶切显示两条带(4900 bp空载体和573 bp HCV core基因片段), 单酶切为约5500 bp一条带(4 900 bp+573 bp). 以pcDNA3.1(-)-core质粒作模板, PCR可见573 bp的产物. 测序证实该重组质粒读码框架正确.
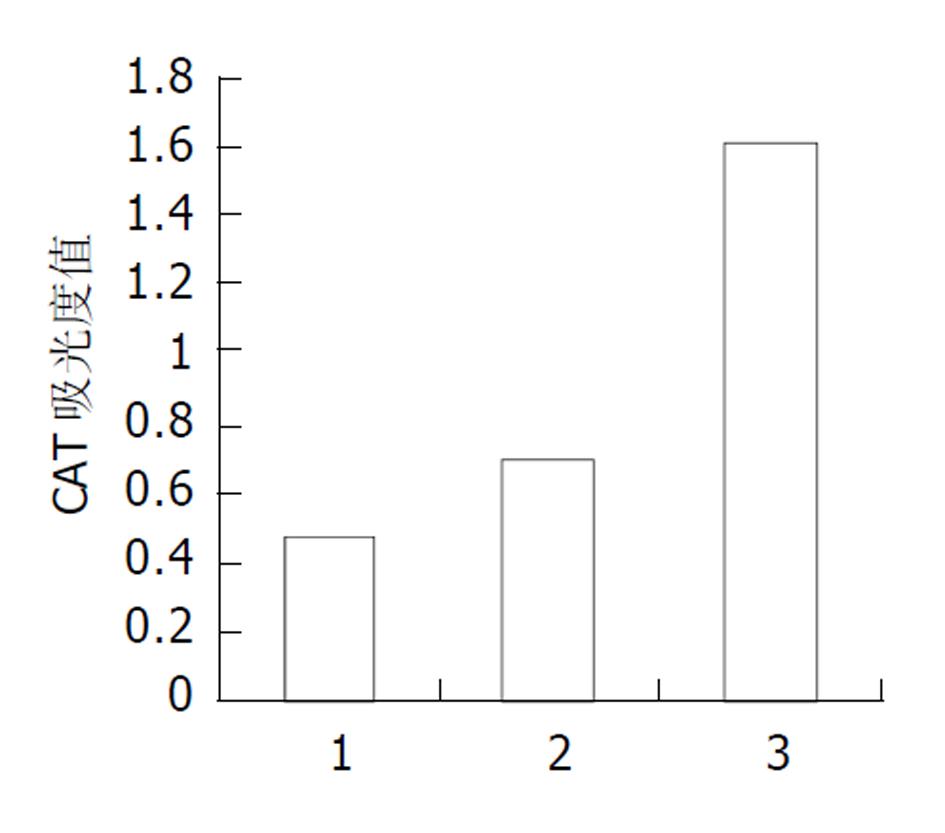
空载体对照组pCAT3 basic的CAT的吸光度值为0.047, pCAT3-Weep的CAT的吸光度值为0.069, 共转染pcDNA3.1(-)-core/pCAT3-Weep的Hep G2细胞CAT的吸光度值为0.160, 共转染pcDNA3.1(-)-core/pCAT3-Weep CAT的表达明显增强, 是CAT3空载体的3.4倍, 是pCAT3-Weep的2.3倍, 说明HCV核心蛋白对Wee1基因启动子有反式激活作用, 转录激活Wee1基因启动子的活性, 使其下游CAT基因的表达增强(图3).
丙肝病毒核心蛋白除了作为核壳蛋白具有病毒颗粒组装功能外, 还具有多种调控细胞、病毒基因表达、细胞生长以及免疫调节等功能. 临床和实验研究显示HCV感染与HCC发生发展过程密切相关[1-5], 其中病毒核心蛋白起到重要的作用. 早期研究认为, HCV属于非整合性RNA病毒, 与产生两种确定作用的反式激活子(X和截短的preS/S)的HBV不同[9], 并不存在直接致癌的病毒蛋白. 后来研究证实核心蛋白也是一种反式激活蛋白, 甚至其作用还要超过X蛋白[10-13]. 核心蛋白对细胞信号转导途径, 尤其是NF-κB、AP-1和SRE相关途径具有明显的增强作用[10]; 在HepG2细胞中, 核心蛋白激活人类c-myc基因、RSV LTR和SV40早期启动子[14]; 核心蛋白还能抑制或增强p53基因启动子功能[15,16], 这些证据表明核心蛋白具有潜在的致癌作用. 核心蛋白转基因小鼠发生HCC病理学特征直接证明了核心蛋白的这种作用[17]. 近来研究还发现HCV核心蛋白可与细胞内的一些细胞凋亡因子作用, 促进细胞凋亡[18-23].
Wee1蛋白为一种细胞周期调节蛋白. Wee1激酶主要通过阻断M期启动因子(MPF), 包括cdc2 激酶和细胞周期蛋白B, 特异性的调控细胞G2/M的转换, 抑制细胞的有丝分裂[24]. 既往研究发现, Wee1激酶的活性和水平在S期均升高, 在细胞进入M期时则很快下降[25,26]. 关于Wee1激酶细胞周期内水平变化的机制, 有人认为: 在M期nim1/cdr1引起Wee1激酶催化区域磷酸化使其活性下降[27-29]. 也有人认为是Wee1激酶合成的减少和降解增加导致Wee1激酶水平下降, 降解增加是由cdc34介导的, 并且Wee1激酶的降解对于细胞有丝分裂的起始十分必要[30]. 在S期Wee1激酶合成增加, 但具体机制不明. 由于当DNA的复制被阻断时, Wee1激酶的降解就被抑制, 在进入DNA复制期间有一种因子可以使Wee1激酶保持持续的高水平直至进入M期, 推测这种因子即c-Fos/AP-1[30].
本研究采用基因重组技术, 自Wee1基因上游自碱基ATG上推976个碱基, 以Hep G2细胞基因组DNA为模板, 设计引物. 在上下游引物的5'端分别引入KpnI和XhoI单一酶切位点, 上游引物P1: 5'-GGT ACC TGA GAC CAG CCT GCC AAC AT- 3'. 下游引物P2: 5'-GAA TTC ATG TGC TTA GGC TGG ACA CTG-3', PCR扩增包含Wee1基因启动子全序列的DNA片段, 命名为Weep. 构建pCAT3-Weep报告基因载体, 应用报告基因氯霉素乙酰转移酶(CAT)共转染瞬时表达系统, 与pcDNA3.1(-)-core共转染Hep G2细胞, 测得共转染pcDNA3.1(-)-core/pCAT3-Weep CAT的表达明显增强, 是CAT3空载体的3.4倍, 是pCAT3-Weep的2.3倍, 说明HCV核心蛋白对Wee1基因启动子有反式激活作用, 转录激活Wee1基因启动子的活性. 证明HCV核心蛋白可上调Wee1启动子活性, 进而上调Wee1基因的表达, 从而为研究HCV致病的分子生物学机制提供了证据.
| 6. | 王 琳, 李 克, 成 军, 陆 荫英, 张 健, 洪 源, 刘 妍, 王 刚, 钟 彦伟, 段 惠娟. 丙型肝炎病毒核心蛋白与载脂蛋白A1结合的研究. 世界华人消化杂志. 2002;10:1018-1021. |
| 7. | 成 军, 任 进余, 李 莉, 陆 志檬, 李 克, 洪 源, 陆 荫英, 王 刚, 刘 妍, 张 玲霞. 丙型肝炎病毒结构基因转基因小鼠引起肝脏脂肪变. 世界华人消化杂志. 2002;10:1022-1026. |
| 11. | 刘 妍, 成 军, 王 刚, 李 克, 段 惠娟, 王 琳, 董 菁, 洪 源, 张 跃新, 李 莉. 应用抑制性消减杂交技术克隆丙型肝炎病毒核心蛋白反式激活基因. 解放军医学杂志. 2001;26:880-883. |
| 12. | 刘 妍, 成 军, 王 刚, 李 克, 段 惠娟, 王 琳, 李 莉, 张 玲霞, 陈 菊梅. HCV核心蛋白与截短型HBV表面抗原中蛋白的协同反式激活功能. 中华肝脏病杂志. 2002;10:354-357. |
| 13. | Kato N, Yoshida H, Ono-Nita SK, Kato J, Goto T, Otsuka M, Lan K, Matsushima K, Shiratori Y, Omata M. Activation of intracellular signaling by hepatitis B and C viruses: C-virus core is the most potent signal inducer. Hepatology. 2000;32:405-412. [PubMed] [DOI] |
| 14. | Chang J, Yang SH, Cho YG, Hwang SB, Hahn YS, Sung YC. Hepatitis C virus core from two different genotypes has an oncogenic potential but is not sufficient for transforming primary rat embryo fibroblasts in cooperation with the H-ras oncogene. J Virol. 1998;72:3060-3065. [PubMed] |
| 15. | Ray RB, Steele R, Meyer K, Ray R. Transcriptional repression of p53 promoter by hepatitis C virus core protein. J Biol Chem. 1997;272:10983-10986. [DOI] |
| 16. | Lu W, Lo SY, Chen M, Wu K, Fung YK, Ou JH. Activation of p53 tumor suppressor by hepatitis C virus core protein. Virology. 1999;264:134-141. [PubMed] [DOI] |
| 17. | Moriya K, Fujie H, Shintani Y, Yotsuyanagi H, Tsutsumi T, Ishibashi K, Matsuura Y, Kimura S, Miyamura T, Koike K. The core protein of hepatitis C virus induces hepatocellular carcinoma in transgenic mice. Nature Med. 1998;4:1065-1067. [PubMed] [DOI] |
| 18. | Hahn CS, Cho YG, Kang BS, Lester IM, Hahn YS. The HCV core protein acts as a positive regulator of fas-mediated apoptosis in a human lymphoblastoid T cell line. Virology. 2000;276:127-137. [PubMed] [DOI] |
| 19. | Honda A, Hatano M, Kohara M, Arai Y, Hartatik T, Moriyama T, Imawari M, Koike K, Yokosuka O, Shimotohno K. HCV-core protein accelerates recovery from the insensitivity of liver cells to Fas-mediated apoptosis induced by an injection of anti-Fas antibody in mice. J Hepatol. 2000;33:440-447. [DOI] |
| 20. | Rubbia-Brandt L, Taylor S, Gindre P, Quadri R, Abid K, Spahr L, Negro F. Lack of in vivo blockade of Fas-and TNFR1-mediated hepatocyte apoptosis by the hepatitis C virus. J Pathol. 2002;197:617-623. [PubMed] |
| 21. | Farooq M, Kim Y, Im S, Chung E, Hwang S, Sohn M, Kim M, Kim J. Cloning of BNIP3h, a member of proapoptotic BNIP3 family genes. Exp Mol Med. 2001;33:169-173. [PubMed] [DOI] |
| 22. | Gross A, McDonnell JM, Korsmeyer SJ. BCL-2 family members and the mitochondria in apoptosis. Genes Dev. 1999;13:1899-1911. [DOI] |
| 23. | Chen G, Cizeau J, Vande Velde C, Park JH, Bozek G, Bolton J, Shi L, Dubik D, Greenberg A. Nix and Nip3 form a subfamily of pro-apoptotic mitochondrial proteins. J Biol Chem. 1999;274:7-10. [PubMed] [DOI] |
| 24. | Nurse P. Universal control mechanism regulating onset of M-phase. Nature. 1990;344:503-508. [PubMed] [DOI] |
| 25. | Watanabe N, Broome M, Hunter T. Regulation of the human WEE1Hu CDK tyrosine 15-kinase during the cell cycle. EMBO J. 1995;14:1878-1891. [PubMed] [DOI] |
| 26. | Michael WM, Newport J. Coupling of mitosis to the completion of S phase through Cdc34-mediated degradation of Wee1. Science. 1998;282:1886-1889. [PubMed] [DOI] |
| 27. | Coleman TR, Tang Z, Dunphy WG. Negative regulation of the Wee1 protein kinase by direct action of the nim1/cdr1 mitotic inducer. Cell. 1993;72:919-929. [DOI] |
| 28. | Parker LL, Walter SA, Young PG, Piwnica-Worms H. Phosphorylation and inactivation of the mitotic inhibitor Wee1 by the nim1/cdr1 kinase. Nature. 1993;363:736-738. [PubMed] [DOI] |