修回日期: 2002-12-25
接受日期: 2002-12-30
在线出版日期: 2003-06-15
动态检测 一氧化氮(nitric oxide, NO)在急性肝损伤中血清浓度变化, 探讨NO在急性肝损伤中的作用.
以刀豆蛋白(concanavalin-A, ConA)诱导小鼠急性肝损伤构建实验动物模型. 用硝酸还原酶法动态检测了40只正常小鼠(对照组)及40只(实验组)小鼠2 h、4 h、8 h及24 h血清中NO的浓度水平. 同时测定血中谷丙转氨酶(ALT)变化.
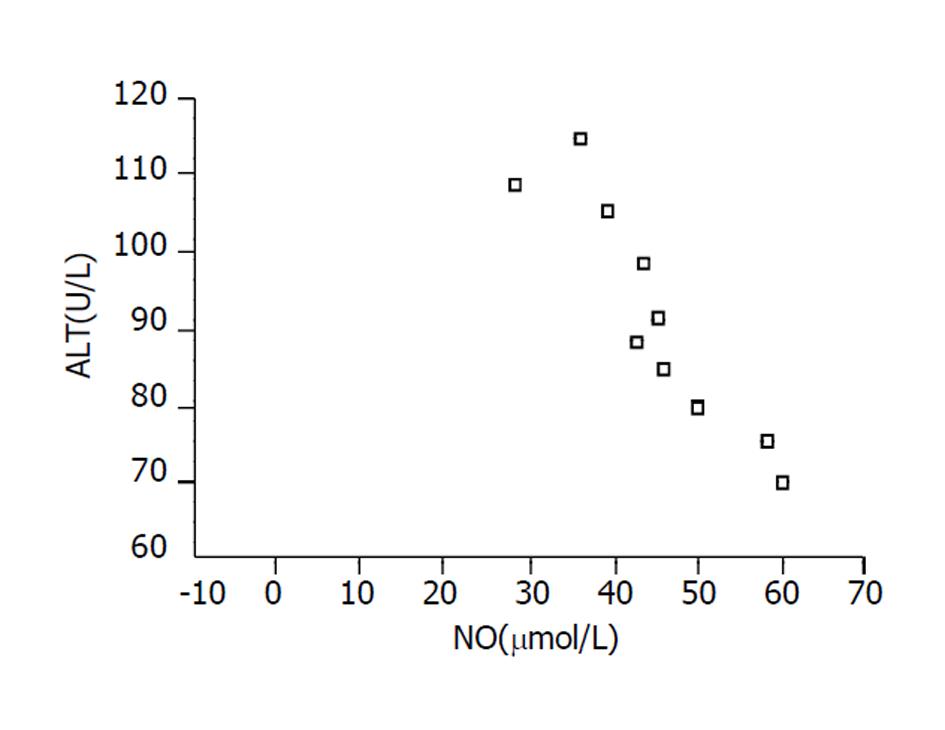
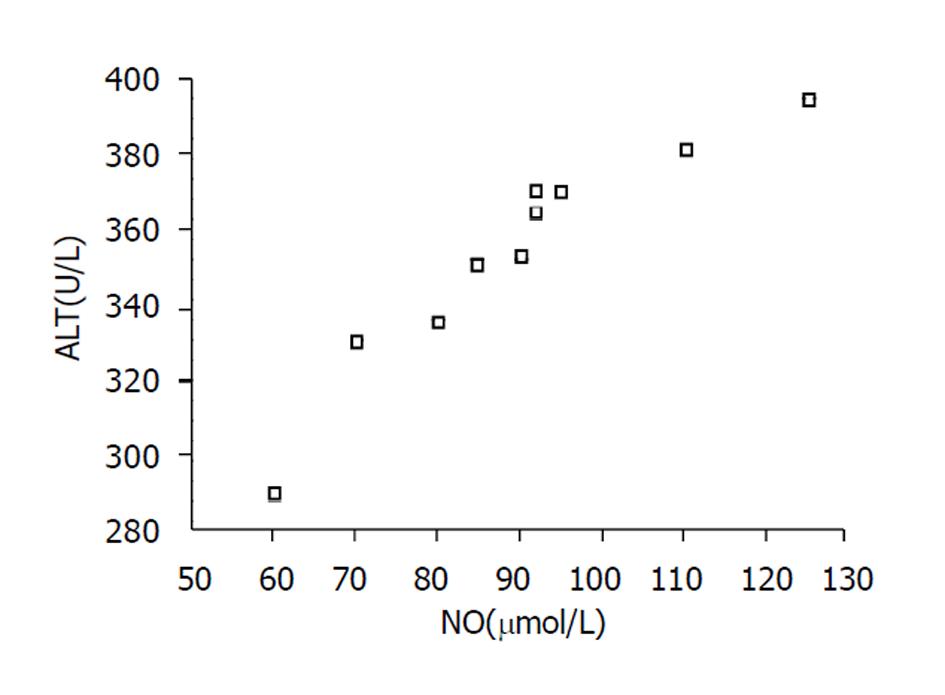
实验组2 h时点NO浓度显著低于对照组且与ALT呈高度负相关(P<0.05). 实验组4 h时点NO浓度显著高于对照组且与ALT呈高度正相关(P<0.01).
NO对肝脏有双重作用, 即既有保护作用又有损害作用.
引文著录: 陈会松, 柳利明, 黄华, 杨晋辉. 小鼠实验性肝损伤中NO的动态检测及意义. 世界华人消化杂志 2003; 11(6): 838-840
Revised: December 25, 2002
Accepted: December 30, 2002
Published online: June 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(6): 838-840
- URL: https://www.wjgnet.com/1009-3079/full/v11/i6/838.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i6.838
一氧化氮(NO)在肝损伤中的作用, 国内外已有大量的相关文献报道, 但是不同的研究有不同的结果[1-4], 且NO在肝损伤中的作用机制至今尚未完全阐明, 说明NO与肝损伤的关系也有必要进一步研究.本实验以刀豆蛋白A(ConA)诱发小鼠急性肝损伤模型, 动态检测NO在血清中的变化, 观察其与ALT之间的关系, 以探讨其在肝损伤中的作用.
♂昆明种小鼠, 体重24-26 g, 6-8 wk, (由昆明医学院动物饲养中心提供), ConA(美国Sigma公司产品), NO试剂盒(由南京建成生物工程研究所提供).
将80只实验小鼠随机分为2组, 每组40只, 对照组小鼠尾静脉注射生理盐水0.3 mL/只, 实验组小鼠尾静脉注射ConA(20 mg/kg, 以等体积的生理盐水溶解), 所有小鼠自由进食水. 各组小鼠均分别于2 h、4 h、8 h及24 h眼球取血并立即分离血清分装于抗凝管中, 于4 °C保存待测. 后立即处死小鼠, 取肝右中叶用100 mL/L甲醛溶液固定, 常规脱水, 石蜡包埋切片, HE染色后, 行光镜观察肝组织病理变化. 应用化学比色硝酸还原酶法检测NO, 按说明书进行操作. 采用生化自动分析仪测定ALT.
统计学处理 采用SPSS10.0统计软件包. 实验数据用mean±SD表示. 两组间比较用t检验, 相关性用直线相关分析(bivariate过程), P<0.05认为差异有显著性.
用ConA成功诱导昆明小鼠急性肝损伤: 实验组小鼠应用ConA 4 h后, 活动明显减少, 精神萎靡, 对外界声光刺激不灵敏, 悬吊觅食不能, 尿黄, 个别小鼠毛发直立, 24 h内无死亡.
对照组大体观见肝脏颜色鲜红, 表面呈细沙粒状, 质地柔软、光滑. 光镜下见肝小叶结构正常, 肝细胞索排列规律、整齐, 肝窦无增宽, 汇管区及中央静脉无异常. ConA实验组8 h组肝细胞损伤程度最重, 后逐渐减轻.大体观肝脏稍肿胀, 颜色暗红, 表面细沙粒状较明显, 组织脆, 钳夹易出血, 镜下见肝细胞索破坏, 肝窦稍增宽, 内有大量瘀血, 肝细胞弥漫性浊肿, 核固缩、溶解甚至消失, 点、灶状及片状坏死多见.汇管区及中央静脉、肝窦内可见大量中性粒细胞和淋巴细胞浸润.
表1.
表2.
| 组别 | n | ALT不同时点值 | |||
| 2 h | 4 h | 8 h | 24 h | ||
| 对照组 | 40 | 45.00±8.00 | 46.01±7.10 | 44.50±6.50 | 47.00±8.00 |
| 实验组 | 40 | 92.02±14.90 | 353.68±43.20 | 868.66±82.341 | 35.56±22.88 |
经Bivariate分析结果显示NO水平与ALT呈显著负相关(r = -769, P<0.05), 即在肝损伤2 h内, NO越低, 肝损伤程度越重(图1).
NO水平与肝损伤程度呈显著正相关(r = 0.860, P<0.01). 即NO值越高, 肝损伤程度越重(图2)
ConA是一种应用广泛的促有丝分裂原物质, 实验证明他在体内可诱导小鼠T淋巴细胞依赖性肝损伤, 因其致肝损伤的病理机制与人类自身免疫性肝病、病毒性肝炎尤其是急性肝炎的病理机制极为相似, 故这一模型的建立和应用可以为我们深入研究各型肝病肝细胞损害的细胞学与分子学机制提供重要的理论依据[5].
NO是体内嗜脂性和有高反应性的气体传递及调节递质, 由NOS(一氧化氮合酶)催化L-精氨酸生成, 属于典型的自由基. 其主要有信息传导功能和细胞毒性因子功能. 信使功能主要参与神经系统的信息传递及使血管扩张, 由结构型NO合成酶合成(cNOS). 细胞毒性因子功能对细菌、真菌和肿瘤细胞产生杀伤作用, 同时也对正常组织产生损伤, 由诱导型NO合成酶(iNOS)合成.
国外学者Sergent et al[6]和Fiorucci et al[7]研究表明, NO在肝损伤过程中可对肝脏起保护作用. 但国内外大多数研究表明, 当NO在肝脏中的浓度远远高于其生理浓度时, 则其可通过以下几种机制造成肝细胞损害、坏死. (1)通过抑制线粒体呼吸使肝细胞因能量缺乏或产生大量的自由基而死亡. (2)通过抑制肝细胞蛋白质的合成从而使肝细胞发生坏死或调亡. (3)通过使肝细胞的DNA断裂或突变使肝细胞发生调亡. (4)通过引起组织细胞脂质过氧化和细胞毒性损伤肝细胞. (5)通过间接改变细胞内的cAMP含量对肝细胞的正常代谢产生影响使肝细胞受损. (6)通过使肝细胞对TNF-α的敏感性提高而加重肝损伤.在本实验中我们对对照组及实验组不同时点及肝匀浆中NO的时值均进行了检测. 经对实验结果分析, 我们发现NO浓度水平变化分两个阶段, 第一阶段是2 h实验组, NO水平同对照组比较不但没有增高反而显著降低, 而ALT(肝损伤程度)却显著增高, 同时NO与肝损伤呈负相关, 提示在肝损伤早期, NO对肝细胞起保护作用. NO浓度下降原因推测在于其通过"自我牺牲"或"保护耗竭"方式, 使肝细胞对损伤的应答产生有益的调节, 从而发挥其对肝脏的保护作用.第二阶段是在2 h后至24 h内, NO水平同对照组相比则明显增高, 同时肝损害程度加重, NO与ALT呈显著正相关. 提示随着大量的NO产生, 其对肝脏的作用由保护转向损害. 说明高浓度的NO对肝脏有损伤作用. 通过本实验, 我们证实了在急性肝损伤中NO对肝脏的双重作用.
总之, 在ConA诱导的急性肝损伤中, NO是一个重要的细胞因子, 在肝损伤不同阶段其作用不同. 他既可对肝脏起破坏作用又对肝脏起保护作用, 为临床进一步研究NO在急性肝炎的发病机制及病理生理变化以及合理应用NO拮抗剂提供理论基础.他在肝损伤中更深层次的作用机制, 有待我们进一步研究.
| 1. | Muriel P. Nitric oxide protection of rat liver from lipid peroxidation, collagen accumulation and liver damage induced by carbon tetrachloride. Biochem pharmacol. 1998;56:773-779. [DOI] |
| 2. | Morikawa A, Kato Y, Sugiyama T, Koide N, Chakravortty D, Yos T, Yokochi T. Role of nitric oxide in lipopolysaccharide-induced hepatic injury in D-galactosamine-sensitized mice as an experimental endotoxic shock model. Infect Immun. 1999;67:1018-1024. [PubMed] |
| 3. | Sass G, Koerber K, Bang R, Guehring H, Tiegs G. Inducible nitric oxide synthase is critical for immune-mediated liver injury in mice. J Clin Invest. 2001;107:439-447. [PubMed] |
| 5. | Fiorucci S, Mencarelli A, Palazzetti B, Del Soldato P, Morel Ignarro LJ. An NO derivative of ursodeoxycholic acid protects against Fas-mediated liver injury by inhibiting caspase activity. Proc Natl Acad Sci USA. 2001;98:2652-2657. [PubMed] [DOI] |
| 6. | Sergent O, Griffon B, Morel I, Chevanne M, Dubos MP, Cillard P, Cillard J. Effect of nitric oxide on iron-mediated oxidative stress in primary rat hepatocyte culture. Hepatology. 1997;25:122-127. [PubMed] [DOI] |
| 7. | Fiorucci S, Santucci L, Antonelli E, Distrutti E, Del Sero G, Morelli O, Romani L, Federici B, Del Soldato P, Morelli A. NO-aspirin protects from T cell-mediated liver injury by inhibiting caspase-dependent processing of Th1-like cytokine. Gastroenterology. 2000;118:404-421. [DOI] |