修回日期: 2002-11-15
接受日期: 2002-11-29
在线出版日期: 2003-04-15
观察大鼠肝卵圆细胞的形态学参数、细胞表型及分化演变等生物学特征.
建立大鼠肝卵圆细胞增生模型, 在肝组织切片上对大鼠肝卵圆细胞进行细胞图像分析及免疫组化染色.
肝卵圆细胞体积小、外形及胞核为椭圆形; 胞质对细胞角蛋白(CK)19, OV6, 甲胎蛋白(AFP)及波形蛋白染色呈阳性, 对白细胞共同抗原(LCA)染色呈阴性, 胞核对增生细胞核抗原(PCNA)染色呈阳性; 在汇管区外周部位可见肝细胞样细胞, CK19及OV6染色呈阳性.
肝卵圆细胞在形态学上明显不同于肝细胞, 同时具有胆管细胞及肝细胞的表型; 肝细胞样细胞为肝卵圆细胞向肝细胞演变的中间过渡细胞.
引文著录: 陈耀凯, 王宇明, 李俊刚, 郎松. 大鼠肝卵圆细胞的生物学特征. 世界华人消化杂志 2003; 11(4): 430-433
Revised: November 15, 2002
Accepted: November 29, 2002
Published online: April 15, 2003
To observe the morphological parameters, phenotypes and evolution of hepatic oval cells in rats.
Rat models for hepatic oval cell proliferation were established, and cell image analysis and immunohistochemical staining of hepatic oval cells were performed on the tissue sections.
Hepatic oval cells were characterized by small size, oval shape and ovoid nuclei. The plasma of the cells was positive for cytokeratin (CK) 19, OV6, alfa-fetal protein (AFP) and vimentin staining, and negative for leucocyte common antigen (LCA) staining. The nuclei were positive for proliferating cell nuclear antigen (PCNA). Some hepatocyte-like cells were discerned around the portal tracts and these cells were positive for CK19 and OV6 staining.
Hepatic oval cells differ from hepatocytes morphologically and express the phenotypes of ductular cells and hepatocytes. Hepatocyte-like cells are most likely the intermediate transition cells between hepatic oval cells and hepatocytes.
- Citation: Chen YK, Wang YM, Li JG, Lang S. Biological characteristics of rat hepatic oval cells. Shijie Huaren Xiaohua Zazhi 2003; 11(4): 430-433
- URL: https://www.wjgnet.com/1009-3079/full/v11/i4/430.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i4.430
肝卵圆细胞(hepatic oval cells)等肝干/祖细胞(liver stem/progenitor cells)有可能借助细胞移植、生物人工肝及肝组织工程技术在肝衰竭及遗传性肝病治疗中发挥重要作用[1-20]. 为进一步了解肝卵圆细胞的主要生物学特征, 我们在已建立的大鼠肝卵圆细胞增生模型基础上[21], 对大鼠肝卵圆细胞的形态学参数、细胞表型及分化演变等生物学特征进行了研究.
小鼠抗大鼠细胞角蛋白CK19抗体为Chemicon公司产品(克隆号E6), 小鼠抗大鼠OV6抗体由美国Brown大学Hixson教授惠赠, 小鼠波形蛋白抗体为Dako公司产品(克隆号V9), 小鼠抗大鼠增生细胞核抗原(PCNA)抗体为Zymed公司产品(克隆号PC10), 小鼠抗大鼠白细胞共同抗原(LCA)抗体及小鼠抗大鼠甲胎蛋白(AFP)抗体购自北京中山生物制品公司.
选择体质量150 g左右的♂Wistar大鼠(第三军医大学动物研究所提供), 2-3月龄, 单只分笼饲养1wk以上, 通过胃管灌喂2-乙酰氨基芴(2-acetaminofluorene, AAF, Sigma公司), 1次/d, 连续4 d, 第5天在戊巴比妥全身麻醉下行2/3肝切除(手术当日不灌喂AAF), 第6天继续灌喂, 连续1 wk. AAF溶于M400的聚乙二醇, 给予20 mg/kg. 手术后10-14 d处死大鼠, 留取肝组织以40 g/L甲醛溶液固定, 常规石蜡包埋, 5 μm连续切片备用. 连续石蜡切片经脱蜡后, 以30 ml/L过氧化氢溶液浸泡10 min灭活内源性过氧化物酶; 抗原热修复后以正常山羊血清封闭, 然后加第一抗体工作液4 ℃过夜; 加生物素标记的第二抗体37 ℃ 45 min; 加结合过氧化物酶链霉亲和素37 ℃ 45 min; 加新鲜配制的DAB, 显微镜下观察5-10 min, 棕黄色染色为阳性信号; 以PBS代替第一抗体作为阴性对照. 肝卵圆细胞图像分析采用Tiger细胞图像分析仪(重庆大学ICT中心研制)在肝组织切片上测定肝卵圆细胞的面积(A)、最大直径(D)及形态因子(Q).
统计学处理u 检验.
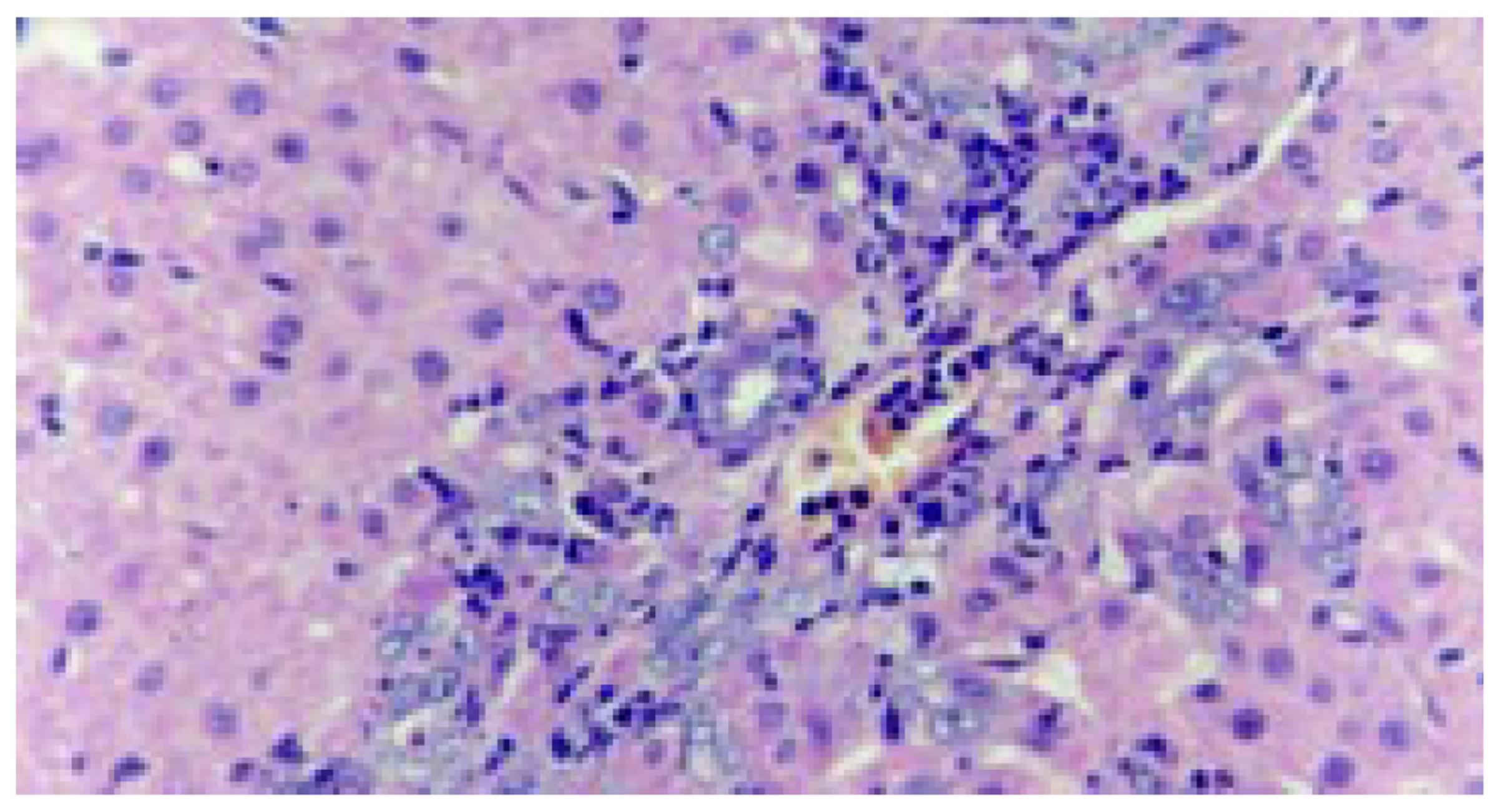
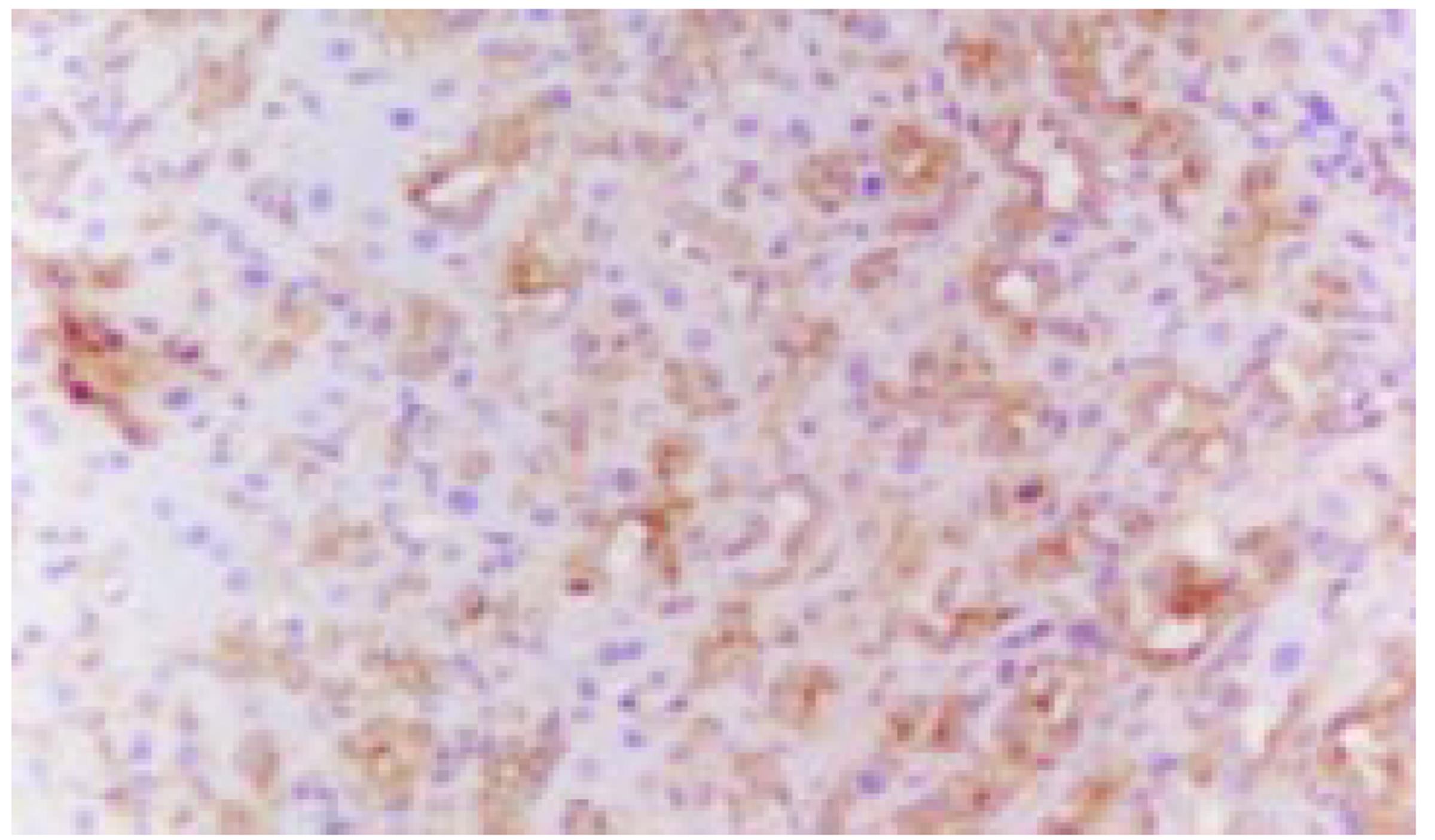
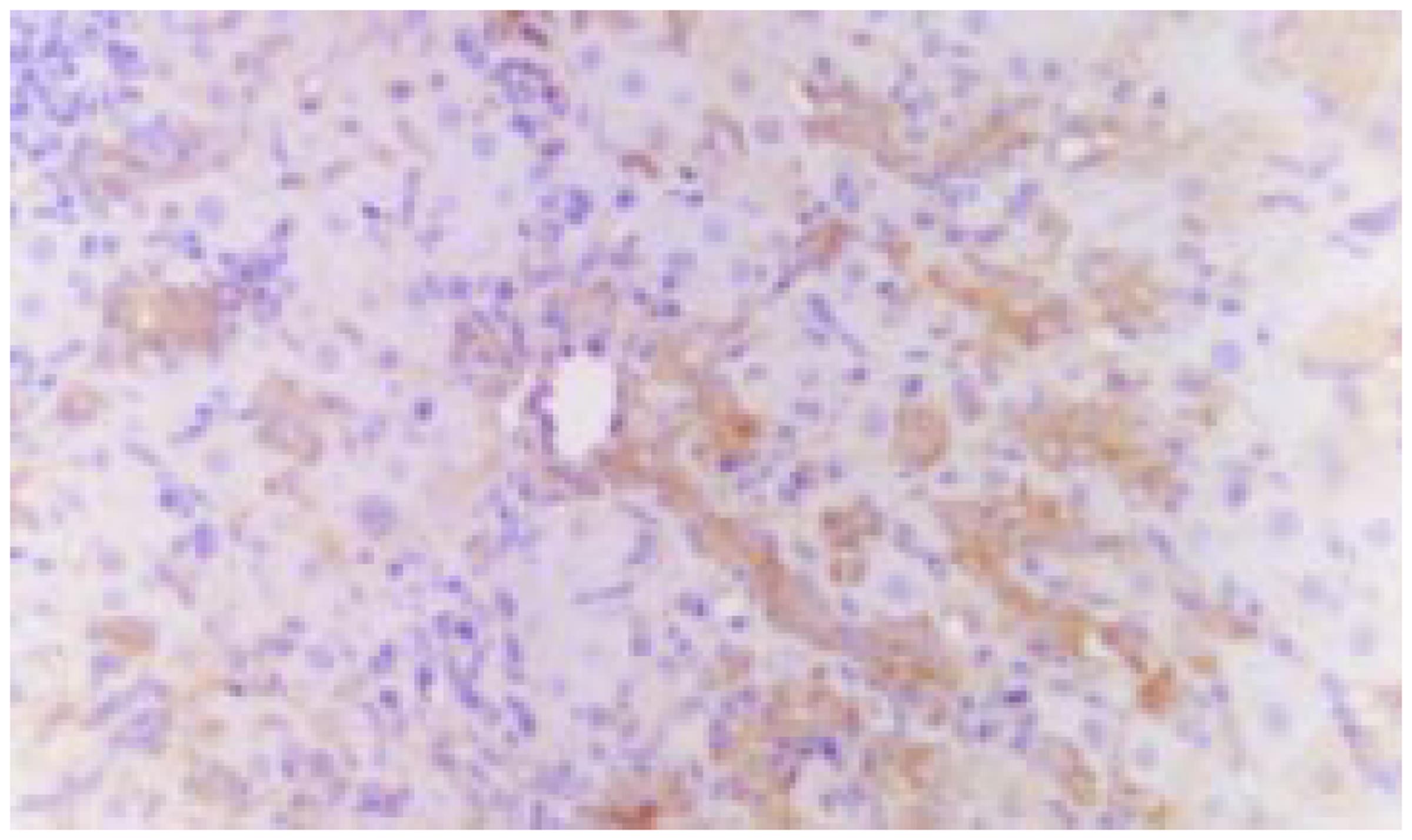
术后10-14 d大鼠肝组织内可见明显的肝卵圆细胞增生反应, 细胞增生部位多位于汇管区及小叶间胆管附近. 所见到的肝卵圆细胞核呈卵圆形, 胞质较少, 细胞体积较小, 约相当于肝细胞体积的1/4-1/6, 细胞直径约8-15 mm. 增生的肝卵圆细胞大小及分布不均匀, 呈簇状分布, 且由汇管区向肝实质内延伸(图1). 采用细胞图像分析仪分别测定肝卵圆细胞及肝细胞的形态学参数, 结果见表1. 选择肝卵圆细胞增生反应明显的6个区域的肝卵圆细胞的形态学参数进行图像分析, 结果见表2. 免疫组化染色结果显示, 肝卵圆细胞胞质CK19, OV6, AFP及波形蛋白染色均呈阳性信号(图2), LCA染色呈阴性, 肝卵圆细胞胞核PCNA染色呈阳性信号.远离汇管区的部位, 存在部分肝细胞样细胞(hepatocyte-like cells), 这类细胞的形态学特征介于肝卵圆细胞与肝细胞之间, 且具细胞肝卵圆细胞表型, CK19及OV6染色呈弱阳性(图3, 图4).
| 区域 | 测定细胞数 | A(μm2) | D(μm) | Q |
| 1 | 67 | 22.1±18.6 | 12.8±5.2 | 1.9±0.6 |
| 2 | 45 | 20.9±12.0 | 14.2±5.9 | 1.9±0.8 |
| 3 | 59 | 19.4±12.6 | 13.7±3.8 | 2.0±0.9 |
| 4 | 91 | 21.4±13.0 | 14.2±4.8 | 1.9±0.7 |
| 5 | 38 | 17.4±15.1 | 9.2±4.9 | 2.3±1.1 |
| 6 | 74 | 19.5±12.3 | 10.4±8.7 | 1.8±0.7 |
1956年Farber在研究大鼠肝细胞癌变机制时, 发现一类体积小、卵圆形核、胞核大、胞质少且浅染的细胞, 常见于肝致癌剂处理的大鼠肝内, 于是首次提出"卵圆细胞"这一名词用来描述、区分此类细胞. 后来的研究发现, 卵圆细胞同时具有胆管细胞与肝细胞的表型, 且可进一步分化为肝细胞及胆管上皮细胞, 因而认为其是一种肝干/祖细胞[22-26]. 我们在以卵圆细胞为关键词查阅Medline时, 发现约1/3的文献并非特指肝脏内的卵圆细胞, 所有外形呈卵圆形的细胞均被称为卵圆细胞, 因此我们提出肝脏内的卵圆细胞应称为肝卵圆细胞更为贴切, 以免引起概念上的混淆. 在新近的国外文献中, 肝卵圆细胞这一名称的使用越来越多[1-31].
本研究结果显示, 肝卵圆细胞具有以下形态学特征: (1)细胞体积明显小于肝细胞; (2)细胞呈卵圆细胞或椭圆形, 与肝细胞差异显著; (3)细胞体积不均一, 大小差异较大; (4)细胞核所占比重大, 核/浆比例较大. 由表1可直观地看出, 肝卵圆细胞与肝细胞在形态学方面有很大的差异, 前者最大直径及细胞截面积均明显小于后者, 肝细胞基本为圆形, 形状因子(最大直径/最小直径)接近1, 而肝卵圆细胞的形状因子明显大于1. 由表2可明显地看出地肝卵圆细胞的不均一性, 6个区域内的细胞形态学参数有一定差异(尽管无统计学意义), 同一区域的细胞形态学参数间有较大的标准差, 这些都说明肝卵圆细胞是个不均一的细胞群体, 这一结果与肝卵圆细胞的异质性是一致的.
肝卵圆细胞表达的多种抗原可经免疫组化方法检测, 但细胞标志物缺乏特异性.目前已筛选出一些肝卵圆细胞高度表达的标志物, 主要有实质中间丝波形蛋白、CK(包括CK7、CK8、K18及CK19等)、OV6, 以及干细胞因子(stem cell factor, SCF)及其受体c-kit等, 其中以CK19及OV6表达最强.特异性较差的标志物主要有: CK14仅见于少数肝卵圆细胞; OC2和OC3见于肝卵圆细胞亚群; BD1仅见于成熟胆管上皮而非肝卵圆细胞, 细胞表面糖蛋白Thy-1、SCF及其受体c-kit以及唾液粘蛋白CD34亦见于血液干细胞; 有多种标志物与骨髓相似, 这可解释为何骨髓外造血常见于肝卵圆细胞活化的肝脏, 当肝卵圆细胞分化成肝细胞后这些标志物亦随之消失. 当肝卵圆细胞侵入肝实质时常表达AFP和白蛋白, 此后随着肝细胞分化AFP不再表达.LCA是炎症细胞的重要标志之一, 本研究中肝卵圆细胞LCA染色呈阴性反应, 也证实本文结果中所见的目标细胞为肝卵圆细胞而非炎症细胞.本研究结果显示, 采用CK19、OV6、AFP、波形蛋白、PCNA及LCA等细胞标志进行免疫组织化学染色取得了较好的效果, 结合细胞的形态学特征, 可很好地了解肝卵圆细胞的增生情况.本研究结果还显示, 肝卵圆细胞对同一细胞标志的染色存在强弱差异, 这种差异可能与细胞的分化状态不同有关, 也是细胞异质性的重要表现形式.
关于肝卵圆细胞向肝细胞的演变过程, 本研究的初步观察结果显示肝卵圆细胞增生反应多开始于汇管区, 并由此向肝小叶内延伸与扩展, 这不仅提示肝卵圆细胞起源于胆管, 而且还提示肝卵圆细胞有向肝细胞分化与演变的趋势. 从细胞表型上看, 随着肝卵圆细胞向肝小叶的延伸, CK19与OV6表达有减弱倾向, 位于汇管区与肝小叶之间的部分肝细胞样细胞CK19及OV6染色呈弱阳性, 再加上其细胞形态介于肝卵圆细胞与肝细胞之间, 因而可以推断这些细胞是肝卵圆细胞向肝细胞分化与演变的中间过渡细胞.
| 1. | Xiao JC, Ruck P, Adam A, Wang TX, Kaiserling E. Small epithelial cells in human liver cirrhosis exhibit features of hepatic stem-like cells: immunohistochemical, electron microscopic and immunoelectron microscopic findings. Histopathology. 2003;42:141-149. [DOI] |
| 2. | Zhang Y, Bai XF, Huang CX. Hepatic stem cells: existence and origin. World J Gastroenterol. 2003;9:201-204. [PubMed] [DOI] |
| 3. | Lowes KN, Croager EJ, Olynyk JK, Abraham LJ, Yeoh GC. Oval cell-mediated liver regeneration: Role of cytokines and growth factors. J Gastroenterol Hepatol. 2003;18:4-12. [DOI] |
| 4. | Braun KM, Thompson AW, Sandgren EP. Hepatic microenvironment affects oval cell localization in albumin-urokinase- type plasminogen activator transgenic mice. Am J Pathol. 2003;162:195-202. [DOI] |
| 5. | Fausto N, Campbell JS. The role of hepatocytes and oval cells in liver regeneration and repopulation. Mech Dev. 2003;120:117-130. [DOI] |
| 6. | Oh SH, Hatch HM, Petersen BE. Hepatic oval 'stem' cell in liver regeneration. Semin Cell Dev Biol. 2002;13:405-409. [DOI] |
| 7. | Crosby HA, Nijjar SS, de Goyet Jde V, Kelly DA, Strain AJ. Progenitor cells of the biliary epithelial cell lineage. Semin Cell Dev Biol. 2002;13:397-403. [DOI] |
| 8. | Libbrecht L, Roskams T. Hepatic progenitor cells in human liver diseases. Semin Cell Dev Biol. 2002;13:389-396. [PubMed] [DOI] |
| 9. | Cao Y, Merling A, Crocker PR, Keller R, Schwartz-Albiez R. Differential expression of beta-galactoside alpha2, 6 sialyltransferase and sialoglycans in normal and cirrhotic liver and hepatocellular carcinoma. Lab Invest. 2002;82:1515-1524. [DOI] |
| 10. | Naves MM, Silveira ER, Dagli ML, Moreno FS. Effects of beta-carotene and vitamin A on oval cell proliferation and connexin 43 expression during hepatic differentiation in the rat(1). J Nutr Biochem. 2001;12:685-692. [DOI] |
| 11. | Yang L, Li S, Hatch H, Ahrens K, Cornelius JG, Petersen BE, Peck AB. In vitro trans-differentiation of adult hepatic stem cells into pancreatic endocrine hormone-producing cells. Proc Natl Acad Sci USA. 2002;99:8078-8083. [PubMed] [DOI] |
| 12. | Gournay J, Auvigne I, Pichard V, Ligeza C, Bralet MP, Ferry N. In vivo cell lineage analysis during chemical hepatocarcinogenesis in rats using retroviral-mediated gene transfer: evidence for dedifferentiation of mature hepatocytes. Lab Invest. 2002;82:781-788. [DOI] |
| 13. | Svetlov SI, Sautin YY, Crawford JM. EDG receptors and hepatic pathophysiology of LPA and S1P: EDG-ology of liver injury. Biochim Biophys Acta. 2002;1582:251-256. [DOI] |
| 14. | Tan J, Hytiroglou P, Wieczorek R, Park YN, Thung SN, Arias B, Theise ND. Immunohistochemical evidence for hepatic progenitor cells in liver diseases. Liver. 2002;22:365-373. [DOI] |
| 15. | Croager EJ, Smith PG, Yeoh GC. Ethanol interactions with a choline-deficient, ethionine-supplemented feeding regime potentiate pre-neoplastic cellular alterations in rat liver. Carcinogenesis. 2002;23:1685-1693. [DOI] |
| 16. | Bisgaard HC, Holmskov U, Santoni-Rugiu E, Nagy P, Nielsen O, Ott P, Hage E, Dalhoff K, Rasmussen LJ, Tygstrup N. Heterogeneity of ductular reactions in adult rat and human liver revealed by novel expression of deleted in malignant brain tumor 1. Am J Pathol. 2002;161:1187-1198. [DOI] |
| 17. | Forbes S, Vig P, Poulsom R, Thomas H, Alison M. Hepatic stem cells. J Pathol. 2002;197:510-518. [PubMed] [DOI] |
| 18. | Sautin YY, Jorgensen M, Petersen BE, Saulnier-Blache JS, Crawford JM, Svetlov SI. Hepatic oval (stem) cell expression of endothelial differentiation gene receptors for lysophosphatidic acid in mouse chronic liver injury. J Hematother Stem Cell Res. 2002;11:643-649. [PubMed] [DOI] |
| 19. | Cassiman D, Libbrecht L, Sinelli N, Desmet V, Denef C, Roskams T. The vagal nerve stimulates activation of the hepatic progenitor cell compartment via muscarinic acetylcholine receptor type 3. Am J Pathol. 2002;161:521-530. [DOI] |
| 20. | Ruck P, Xiao JC. Stem-like cells in hepatoblastoma. Med Pediatr Oncol. 2002;39:504-507. [PubMed] [DOI] |
| 22. | Thami GP, Kaur S, Kanwar AJ. Association of juvenile xanthogranuloma with cafe-au-lait macules. Int J Dermatol. 2001;40:283-285. [DOI] |
| 23. | Faris RA, Konkin T, Halpert G. Liver stem cells: a potential source of hepatocytes for the treatment of human liver disease. Artif Organs. 2001;25:513-521. [DOI] |
| 24. | Petersen BE. Hepatic "stem" cells: coming full circle. Blood Cells Mol Dis. 2001;27:590-600. [PubMed] [DOI] |
| 25. | Libbrecht L, De Vos R, Cassiman D, Desmet V, Aerts R, Roskams T. Hepatic progenitor cells in hepatocellular adenomas. Am J Surg Pathol. 2001;25:1388-1396. [PubMed] [DOI] |
| 26. | Feldmann G. Liver transplantation of hepatic stem cells: potential use for treating liver diseases. Cell Biol Toxicol. 2001;17:77-85. [DOI] |
| 27. | Ma X, Qiu DK, Peng YS. Immunohistochemical study of hepatic oval cells in human chronic viral hepatitis. World J Gastroenterol. 2001;7:238-242. [DOI] |
| 28. | Yin L, Lynch D, Ilic Z, Sell S. Proliferation and differentiation of ductular progenitor cells and littoral cells during the regeneration of the rat liver to CCl4/2-AAF injury. Histol Histopathol. 2002;17:65-81. [PubMed] |
| 29. | Gordon GJ, Butz GM, Grisham JW, Coleman WB. Isolation, short-term culture, and transplantation of small hepatocyte- like progenitor cells from retrorsine-exposed rats. Transplantation. 2002;73:1236-1243. [DOI] |
| 30. | Vessey CJ, de la Hall PM. Hepatic stem cells: a review. Pathology. 2001;33:130-141. [PubMed] [DOI] |
| 31. | Paku S, Schnur J, Nagy P, Thorgeirsson SS. Origin and structural evolution of the early proliferating oval cells in rat liver. Am J Pathol. 2001;158:1313-1323. [DOI] |