修回日期: 2002-11-25
接受日期: 2002-11-28
在线出版日期: 2003-04-15
研究树突状细胞对肝癌等肿瘤细胞的直接作用.
用rhGM-CSF和rhIL-4从健康人外周血诱导树突状细胞, 用ELISA和MTT法分别检测DC培养上清液中IL-12和TNF水平, 用MTT法检测DC对肝癌细胞SMMC-7 721、QGY-7 703、HEPG-2、Alexander, 胃癌细胞SGC-7901, 慢性髓原性白血病细胞K562、Burkitt's淋巴瘤细胞Raji和正常人二倍体细胞的抑制作用, 同时用流式细胞术检测DC表面FasL的表达, 最后用DC进行人肝癌裸鼠皮下抑制瘤的抑制试验.
诱导7 d的DC对4种肝癌细胞和胃癌细胞均有不同程度抑制作用, 随着效靶比的增加, DC对肝癌细胞和胃癌细胞的抑制作用逐渐增加; DC预防人肝癌裸鼠皮下移植瘤, 其抑制率为97%.
DC进入机体后也可以非特异性抑制方式发挥抑癌作用, 本研究丰富和拓展了肝癌DC疫苗的内容, 为今后肝癌DC疫苗的研究奠定了基础.
引文著录: 郭建巍, 秦力维, 蔡美英, 吕同德. 树突状细胞体内外对肝癌细胞的抑制作用. 世界华人消化杂志 2003; 11(4): 408-410
Revised: November 25, 2002
Accepted: November 28, 2002
Published online: April 15, 2003
To estimate the growth inhibition of hepatocellular carcinoma(HCC) cells in vitro and in vivo by human dendritic cells (DCs).
High purity DCs were obtained from cultured plastic-adherent monocytes isolated from healthy human peripheral blood with GM-CSF and IL-4. The levels of IL-12 and TNF were analyzed in liquids of cultured medium by ELISA and MTT reduction assay respectively. Fas-L expression on DC was also detected by flow cytometry. Growth inhibition test of DC against HCC cell lines was also performed. Transplanted human HCC on nude mouse was treated with DCs.
Inhibitory effects on the growth of human HCC lines and other cancer cells were observed by DCs in vitro. DCs prevented the HCC xenograft from growth on nude mouse with a prophylaxis rate of 97%.
CONCLUSION: DCs not only inhibit the growth of human HCC in vitro but also prevent the growth of HC xenograft on nude mouse in vivo.
- Citation: Guo JW, Qin LW, Cai MY, Lu TD. Inhibition of dendritic cells against hepatocellular carcinoma in vitro and in vivo. Shijie Huaren Xiaohua Zazhi 2003; 11(4): 408-410
- URL: https://www.wjgnet.com/1009-3079/full/v11/i4/408.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i4.408
树突状细胞(DC)是体内功能最强的抗原提呈细胞(APC), 也是天然免疫和获得性免疫的重要调节剂[1,2]. 表面具有高密度的抗原呈递分子(MHC-Ⅰ和MHC-Ⅱ)和共刺激分子(CD40, ICAM-1/CD54, ICAM-3/C.D50, IFA-3/CD58, B7-1/CD80, B7-2/CD86)等, 因而成为功能强大的APC. DC激活的T细胞免疫在抗肿瘤过程中起着主导作用[3-8]. 我们研究体外培养的DC对人肝癌裸鼠皮下移植瘤的直接预防作用如下.
重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF PEPRO TECH); 重组人白介素-4(rhIL-4 PEPRO TECH); 鼠抗人DC单克隆抗体[9](镇江医学院许化溪教授馈赠); 兔抗鼠FITC标记二抗(华美生物工程公司); RPMI1 640 (Gibco公司); 淋巴细胞分离液(上海试剂二厂); 生物素化羊抗鼠IgG, HRP标记链亲和素(streptoavidin), 北京中山生物技术有限公司; 内源性生物素封闭试剂(avidin biotin blocking system, 武汉博士德生物有限公司; 鼠抗人肝癌单克隆抗体mcAb18(由本研究室刘小波博士馈赠); 新生小牛血清(杭州四季青生物工程材料研究所); BCG HSP 70和肝癌细胞可溶性抗原(本实验室自己制备); 4周龄Balb/c裸鼠, 雌雄各半(由华西医科大学实验动物中心提供); 正常人外周血源于18-25岁健康志愿者. SPF级动物实验室(华西医科大学实验动物中心提供); SPSS10.0 for Windows 统计软件.
收集6-9d DC[10]培养上清, -20 ℃冻存备用. 待样品收集齐后, 统一进行检测. 在酶标板孔中分别加入样品或不同浓度的IL-12标准品(500-15.625 ng/L)100 mL, 室温(20-25 ℃)反应120 min, PBS洗板4次后分别加入检测剂工作液, 每孔100 mL, 室温孵育60 min, PBS洗板4次, 加入底物, 室温避光显色10-30 min, 2 mol/L H2SO4终止后450 nm测光密度值(A值), 结果用3孔均值表示. 调整对数生长期L929细胞浓度为2×108个/L, 加入96孔细胞培养板, 每孔100 mL, 37 ℃培养24 h后弃上清, 分别加入待测标本及TNF标准品(250 KU/L、125 KU/L、 62.5 KU/L、 31.25 KU/L、15.6 KU/L、7.8 KU/L、0 KU/L), 每份标本3复孔. 最后加入放线菌素D(100 mg/L)10 mL,同时设细胞对照和空白对照. 37 ℃含50 mL/L CO2的培养箱中培养24 h, 离心, 弃上清, 每孔加入MTT(5 g/L)10 uL, 继续孵育4 h. 离心, 弃上清, 加入DMSO 100 mL, 振荡后570 nm比色测A值. 按下式计算各孔细胞死亡百分率, 间接反映TNF生物学活性. 并绘制TNF标准曲线. 细胞死亡率% = [1-(实验组A值-空白组A值)/(对照组A值-空白组A值)]×100%. 常规法诱导DC, 分为2组, 一组于诱导7 d加入LPS 10 μg/L, 一组不加, 37 ℃含50 μL/L CO2的培养箱中培养24 h, PBS洗涤2次, 用40 g/L多聚甲醛4 ℃固定30 min, PBS洗涤2次, 加入兔抗人Fas-L多克隆抗体100 mL, 4 ℃ 120 min, PBS洗涤2次, 加入羊抗兔-FITC二抗100 mL, 以正常人淋巴细胞作阴性对照, 4 ℃ 120 min, PBS洗涤2次, 流式细胞术检测细胞表面Fas-L表达.
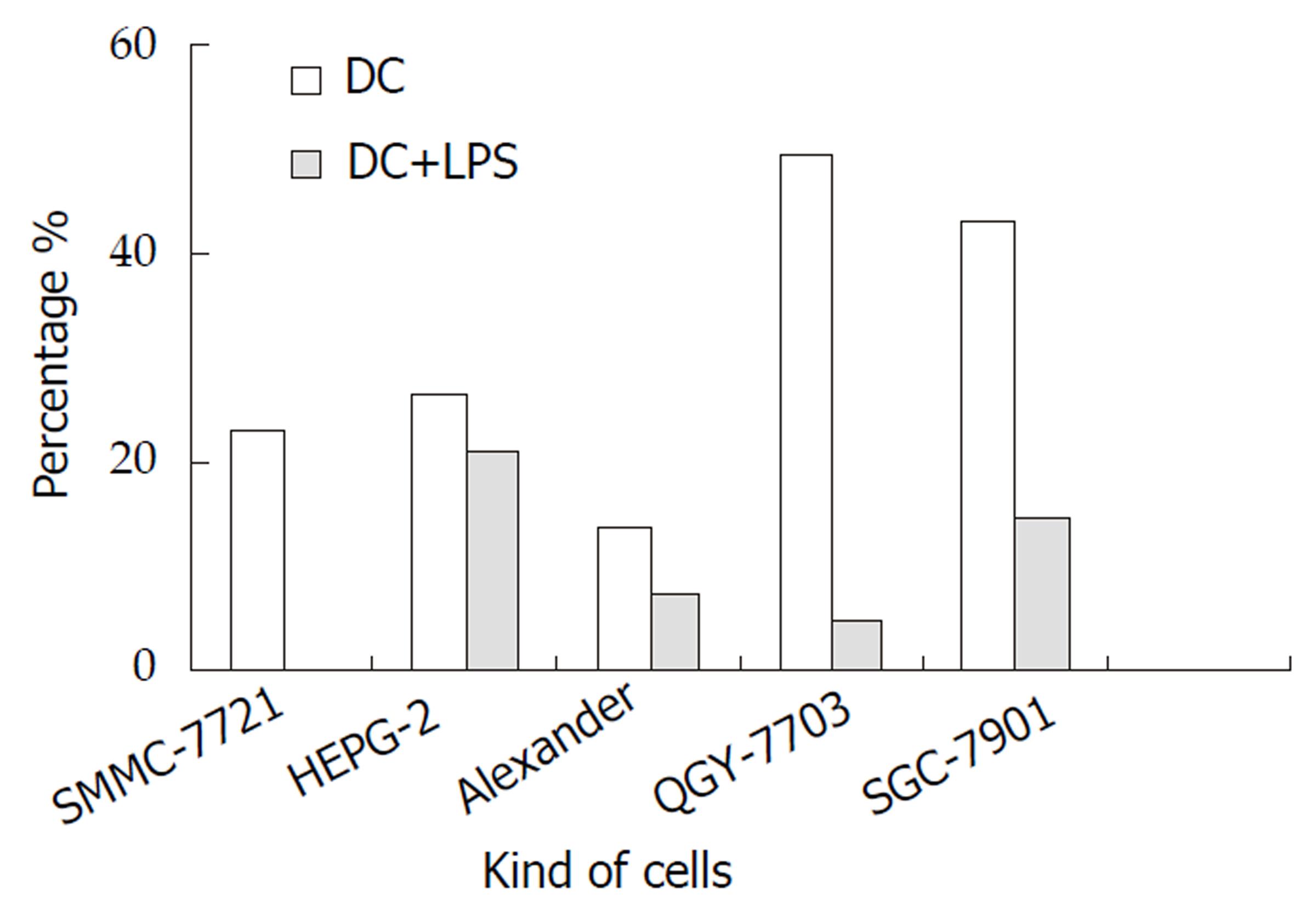
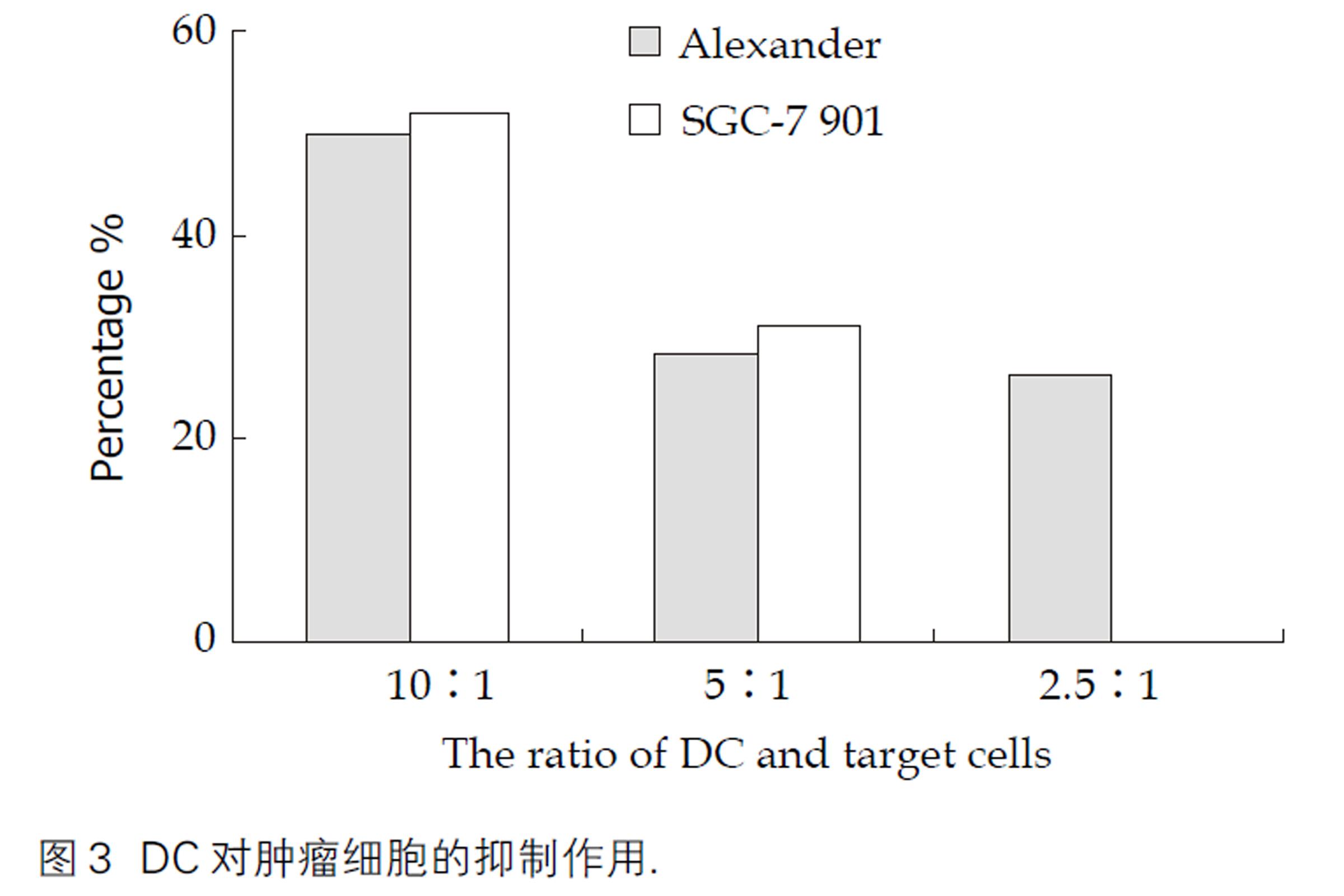
1.2.1 DC 对肝癌细胞的生长抑制试验[11] 收集诱导7 d的DC, 分为2组, 一组直接加入96孔细胞培养板中, 另一组加LPS 10 g/L后再加入96孔细胞培养板, 每一组DC细胞浓度分别为2×105/孔和1×105/孔(效靶比分别为2/1 , 1/1),靶细胞分别为肝癌细胞SMMC-7 721, QGY-7 703,HEPG-2, Alexander, 胃癌细胞SGC-7 901, 慢性髓原性白血病细胞K562, Burkitt's淋巴瘤细胞Raji和正常人二倍体细胞, 靶细胞浓度为1×105/孔, 同时做每种靶细胞和效应细胞对照各3复孔. 效应细胞与靶细胞混合培养16 h, 加入5 g/L MTT 10 μL继续培养8 h. 离心培养板(2 000 r/min, 10 min), 弃去上清, 每孔加DMSO 100 μL, 于570 nm处测定A值. 按抑制率 = [1-(实验孔A值-效应细胞对照孔A均值)/靶细胞对照孔A均值]×100 %计算实验结果; 用肝癌细胞Alexander和胃癌细胞SGC-7 901分别作靶细胞, 以效靶比10/1, 5/1, 2.5/1重复以上实验, 并计算抑制率.
1.2.2 DC预防人肝癌裸鼠皮下移植瘤 收集诱导7 d的DC, PBS洗3次后, 调整细胞浓度为1×109 /L, 于裸鼠左侧背部皮下注射, 每只1 mL, 共6只; 另取6只裸鼠, 每只背部皮下注射1 mL生理盐水作阴性对照. 同时于裸鼠右侧腋窝皮下接种人肝癌SMMC-7721细胞5×106/只, 每只液体总量为0.2 mL, 每3 d观察移植肿瘤生长情况, 共观察30 d. 在无菌条件下取裸鼠移植瘤称重, 按公式: 抑制率 = [(对照组平均瘤质量-实验组平均质量)/对照组平均瘤质量]×100% 计算肿瘤抑制率.
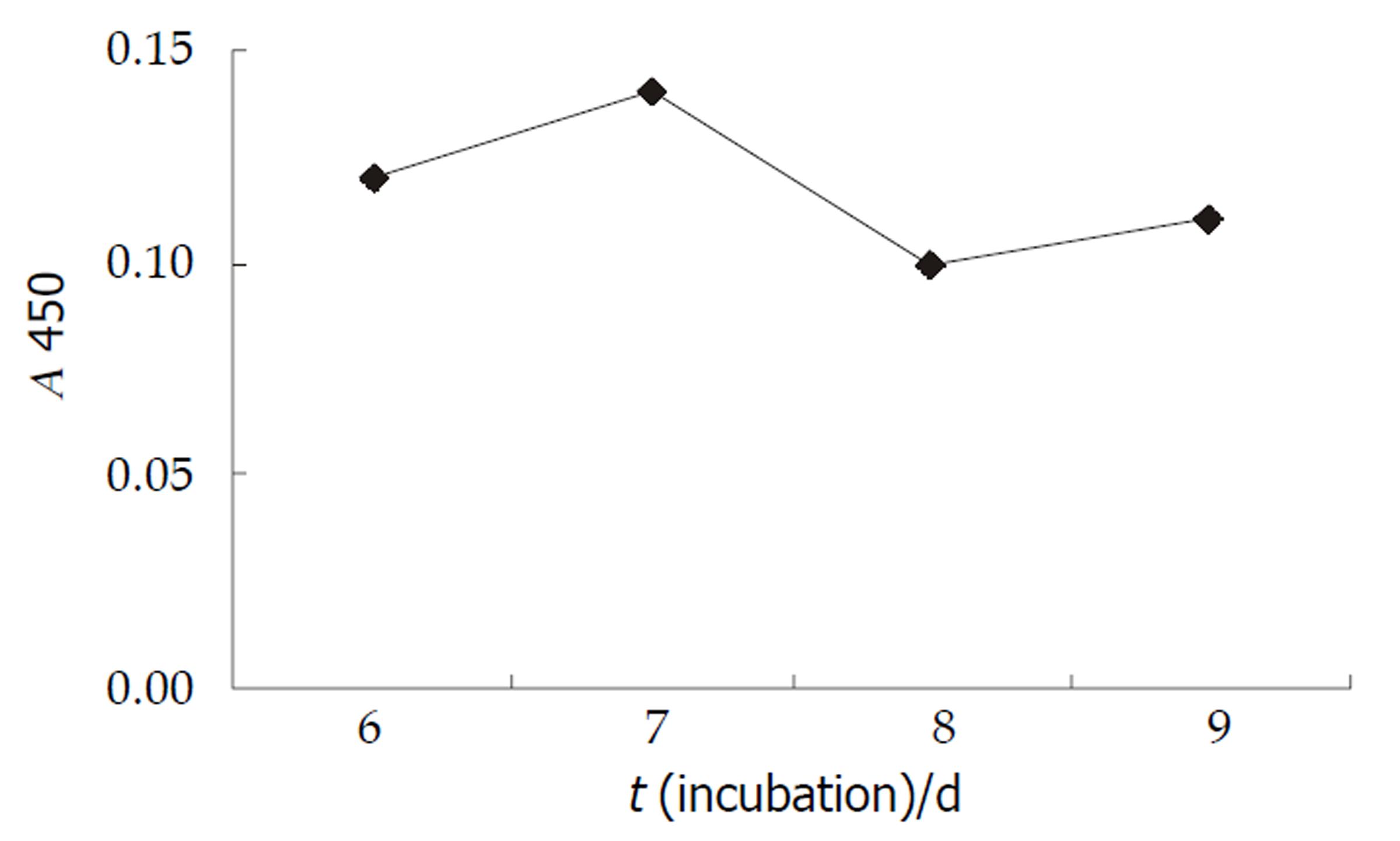
DC培养7d上清中IL-12水平为最高(图1). 正常人DC培养液中基本上无TNF表达. 效靶比为1:1时, 诱导7 d的DC对4种肝癌细胞和胃癌细胞均有不同程度抑制作用(抑制率22.8-49.2%),但不抑制正常人二倍体细胞生长. 加入LPS后, DC对4种肝癌细胞和胃癌细胞的抑制减弱(图2). 随着效靶比增加为2.5:1、5:1和10:1时,诱导7 d的DC对肝癌细胞和胃癌细胞的抑制作用逐渐增加(图3).
DC最初以其独特的形态而得名. 正常情况下, 体内绝大多数DC处于非成熟(immature)状态, 主要位于肠黏膜等易于外来抗原接触的部位, 仅表达低水平的共刺激分子和黏附分子, 不能激活T细胞. 能有效捕捉抗原, 具极强的抗原加工和处理能力. 成熟DC则主要迁移(migration)至外周淋巴器官, 其捕获抗原的能力下降, 但可激发有抗原受体的T细胞[12,13]. DC的两大功能在时相上分开, 这恰与其生物学功能相适应. 在T细胞分化过程中可溶性CK的作用已得到确认, 研究最彻底的CK为IL-12, 他是DC的关键性产物. 无论是从IL-12产生能力, 还是IL-12产生水平上, DC对Th0来说是Th1和Th2型细胞因子的良好诱生剂. IL-12作用于Th0使之分化为Th1, 这在IL-12或STAT4缺陷动物和缺乏IL-12受体的人身上已被证明[14,15]. IL-12主要通过IL-2协同诱导CTL的分化; 刺激活化CD3+T细胞(包括CD4+和CD8+) 增生; 协同IL-2诱导CD56+NK细胞及LAK细胞增生而发挥作用[16-18].
在以往的研究中, 都比较重视DC对淋巴细胞的活化, 以诱导抗原特异性CTL, 这也是DC最重要的功能之一. 既然非成熟DC能有效捕捉抗原, 具极强的抗原加工和处理能力, 而成熟与非成熟之间的界限又不是非常明显, 那么, 外周血单核细胞经细胞因子诱导后分化的DC是否仍保留有这样的功能呢?带着这一有兴趣的问题我们用DC对一系列肿瘤细胞进行了抑制性实验, 结果表明:
DC对四种肝癌细胞及其他肿瘤细胞均有不同程度的抑制作用, 而经LPS处理后的DC对四种肝癌细胞及其他肿瘤细胞的抑制作用明显减弱, 说明DC经LPS诱导使其成熟后其对肿瘤细胞的抑制作用明显减弱. 因为非成熟DC主要通过巨胞饮、受体介导的内吞及吞噬三种方式摄取抗原, 而成熟DC捕捉抗原能力下降, 因此推测DC对四种肝癌细胞及其他肿瘤细胞的抑制作用可能是通过吞噬途径实现的. 肝癌组织中Fas抗原检出率分别为31.7%[19]和52.8%[20]. 我们的研究中, LPS作用前后DC细胞表面FAS-L的表达分别为: 6.04%和3.29%. 因此, 在DC对肝癌细胞的作用中, Fas和Fas配体途径发挥了一定的作用. 至于DC抑制肿瘤细胞的其他因素还有待于以后更深入的研究. 本研究中, DC对人肝癌裸鼠皮下移植瘤的直接抑制率为97%, 表明DC疫苗进入机体后可以非特异性抑制和特异性免疫应答两种方式发挥作用, 丰富了和扩展了肝癌DC疫苗的内容, 为今后肝癌DC疫苗的临床研究及应用奠定了重要基础.
| 1. | Mule JJ. Dendritic cells: at the clinical crossroads. J Clin Invest. 2000;105:707-708. [PubMed] [DOI] |
| 2. | Lipscomb MF, Masten BJ. Dendritic cells: immune regulators in health and disease. Physiol Rev. 2002;82:97-130. [PubMed] [DOI] |
| 3. | Rissoan MC, Soumelis V, Kadowaki N. Dendritic cell subsets: the ultimate T cell differentiation decision Makers? Gut. 1999;45:640-641. [DOI] |
| 4. | Remmel E, Terracciano L, Noppen C, Zajac P, Heberer M, Spagnoli GC, Padovan E. Modulation of dendritic cell phenotype and mobility by tumor cells in vitro. Hum Immunol. 2001;62:39-49. [DOI] |
| 5. | Rawson P, Hermans IF, Huck SP, Roberts JM, Pircher H, Ronchese F. Immunotherapy with dendritic cells and tumor major histocompatibility complex class I -derived peptides requires a high density of antigen on tumor cells. Cancers Res. 2000;60:4493-4498. [PubMed] |
| 6. | Reinhard G, Marten A, Kiske SM, Feil F, Bieber T. Schmidt-Wolf IG.Generation of dendritic cell-based vaccines for cancer therapy. Br J Cancer. 2002;86:1529-1533. [PubMed] [DOI] |
| 7. | Burdin N, Moingeon P. Cancer vaccines based on dendritic cells loaded with tumor-associated antigens. Cell Biol Toxicol. 2001;17:67-75. [PubMed] [DOI] |
| 8. | Meidenbauer N: Andreesen R: Mackensen A. Dendritic cells for specific cancer immunotherapy. Biol Chem. 2001;382:507-520. [PubMed] [DOI] |
| 11. | Chapoval AI, Tamada K, Chen L. In vitro growth inhibition of a broad apectrum of tumor cell lines by activated human dendritic cells. Blood. 2000;95:2346-2351. [PubMed] |
| 12. | Winzler C, Rovere P, Rescigno M, Granucci F, Penna G, Adorini L, Zimmermann VS, Davoust J, Ricciardi-Castagnoli P. Maturation stages of mouse dendritic cells in growth factor dependent long-term cultures. J Exp Med. 1997;185:317-328. [PubMed] [DOI] |
| 13. | Sallusto F, Cella M, Danieli C, Lanzavecchia A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment : downregulation by cytokines and bacterial products. J Exp Med. 1995;182:389-400. [DOI] |
| 15. | Kalinski P, Hilkens CM, Wierenga EA, Kapsenberg ML. T-cell priming by type-1 and type-2 polarized dendritic cells: the concept of a third signal. Immunol Today. 1999;20:561-567. [DOI] |
| 16. | Heath WR, Carbone FR. Cross-presentation, dendritic cells, Tolerance and immunity. Annu Rev Immunol. 2001;19:47-64. [PubMed] [DOI] |
| 17. | Schuhbauer DM, Mitchison NA, Mueller B. Interaction within clusters of dendritic cells and helper T cells during initial Th1/Th2 commitment. Eur J Immunol. 2000;30:1255-1262. [DOI] |
| 18. | Toes RE, Schoenberger SP, van der Voort EI, Offringa R, Melief CJ. CD40-CD40Ligand interactions and their role in cytotoxic T lymphocyte priming and anti-tumor immunity. Semin Immunol. 1998;10:443-448. [PubMed] [DOI] |