修回日期: 2003-02-12
接受日期: 2003-02-19
在线出版日期: 2003-03-15
目的: 检测原发性胃癌组织中18号染色体的杂合性丢失(loss of heterozygosity, LOH)情况.
方法: 联合应用激光捕获显微切割(laser capture microdissection, LCM)-高可信度全基因组扩增(high fidelity-whole genome amplification, HF-WGA)-变性高效液相色谱(denatured high pressure liquid chromatography, DHPLC)方法, 检测胃癌中18号染色体上短插入/缺失多态(short insertion deletion polymorphism, SIDP)标记的LOH.
结果: 在所检测的10例胃癌组织中3例呈现SIDP位点LOH(30%); 9个SIDP位点中3个(MID148、MID150和MID352)发生LOH, 其中MID150位点LOH见于3例胃癌组织. 在1例胃癌组织中3个SIDP位点同时呈现LOH.
结论: 联合应用LCM和HF-WGA, 经DHPLC分析SIDP标记, 可进行肿瘤细胞中LOH检测. 本研究为18号染色体上胃癌相关抑癌基因的研究提供一种新技术策略.
引文著录: 任群, 王振宁, 罗阳, 敖杨, 鲁冲, 姜莉, 徐惠绵, 张学. 胃癌中18号染色体的杂合性丢失研究. 世界华人消化杂志 2003; 11(3): 310-313
Revised: February 12, 2003
Accepted: February 19, 2003
Published online: March 15, 2003
AIM: To detect loss of heterozygosity (LOH) on chromosome 18 in primary gastric carcinomas.
METHODS: Short insertion deletion polymorphism (SIDP) markers on chromosome 18 were analyzed using high fidelity-whole genome amplification (HF-WGA) and denatured high pressure liquid chromotography (DHPLC) to detect LOH in gastric cancer cells purified by laser capture microdissection (LCM).
RESULTS: LOH in 3 (MID148, MID150 and MID352) of 9 SIDP loci was found. Three of 10 samples of gastric cancer showed LOH at the same SIDP locus (MID150) (30%) and one of them also demonstrated LOH at the other 2 SIDP loci (MID148, MID352). No LOH was detected in 6 of 9 SIDP loci.
CONCLUSION: Detection of LOH in cancer cells can be achieved by the combination of LCM, HF-WGA and the analysis of SIDP marker by DHPLC. This study provides an alternative new way to map tumor suppressor genes on chromosome 18.
- Citation: Ren Q, Wang ZN, Luo Y, Ao Y, Lu C, Jiang L, Xu HM, Zhang X. Loss of heterozygosity on chromosome 18 in microdissected gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2003; 11(3): 310-313
- URL: https://www.wjgnet.com/1009-3079/full/v11/i3/310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i3.310
肿瘤是多种基因变化的参与和积累的结果. 揭示这些基因变化的规律, 不仅可以阐明癌变的机制, 更可以协助肿瘤的诊断、治疗和预后判断. 胃癌是严重威胁人类健康的恶性疾病, 是我国发病率和死亡率最高的恶性肿瘤之一, 其发病率呈明显的上升趋势[1-4]. 同其他恶性肿瘤一样, 胃癌的发生也是由多因素参与, 并经历了多阶段的演变过程, 涉及到多种癌基因的激活和抑癌基因的失活[5-26]. 现已明确在胃癌发生发展过程中, c-met, c-may, ras, c-erbB-2等癌基因, p53, p16, Rb, DCC, APC等抑癌基因, 以及肿瘤转移相关基因nm23, CD44, CDH1等有结构或表达的异常. 这些异常或影响细胞的异型增生, 或涉及分化程度与浸润和转移等生物学行为的改变. 虽然有上述众多的相关研究, 但胃癌发生发展的完整的分子机制远未阐明. 因此进一步确定胃癌最常见丢失或失活的抑癌基因, 将其定位、分离, 并研究其生物学功能, 进一步揭示胃癌发生发展的分子机制是当务之急. 胃癌细胞有明显染色体片段丢失, 胃癌杂合性缺失(loss of heterozygosity, LOH)发生率可高达50%[27,28], 染色体18q是最常见的丢失区域, 这表明在18号染色体长臂上可能存在有一种或几种肿瘤抑制基因, 他的丢失与胃癌的发生发展密切相关. 为探讨18号染色体杂合性丢失在胃癌发生发展中的作用, 我们联合应用激光捕获显微切割(laser capture microdissection, LCM)、高可信度全基因组扩增(high fidelity-whole genome amplification, HF-WGA)和变性高效液相色谱(denatured high pressure liquid chromatography, DHPLC)技术对胃癌中18号染色体短插入/缺失多态(short insertion deletion polymorphism, SIDP)标记的杂合性丢失进行分析.
中国医科大学附属第一医院肿瘤科住院患者的手术切取胃癌组织标本10例, 切取原发性胃癌组织和距癌组织1 cm以上的癌旁正常组织. 所有患者术前均未接受放疗和化疗.
按LCM方法提取DNA. 手术切取新鲜胃癌和癌旁正常组织标本, 立即OCT包埋, 放入液氮中保存, 行8 μm厚连续冰冻切片, 常规行HE染色. 第一张封片镜下明确病理诊断, 其余切片不封片, 采用LCM系统, 分别捕获癌细胞和正常胃黏膜细胞, 至覆盖乙烯乙酸乙烯酯薄膜的塑料帽表面, 将塑料帽盖于预先加有50 μL裂解缓冲液(1×PyrobestTM缓冲液, 4 mg/mL蛋白酶K, 5% Tween20)的0.5 mL的 Eppendorf管上. 倒置Eppendorf管, 48℃水浴14 h, 94℃ 10 min终止反应. 以我室自建方法行高可信度全基因组扩增: 取5 mL 上述的DNA样品, 加入10×PyrobestTM缓冲液5 μL, 100 mol/L的核苷酸随机引物(N15)10 mL, 2.5 mmol/L dNTPs 4 μL和Pyrobest TM DNA聚合酶1 mL, 最后加水至反应体积50 μL. PCR扩增50循环: 94℃ 1 min, 37℃ 2 min, 以0.1℃/s速率缓慢升温至55℃, 延伸4 min后, 再升温至68℃ 1 min. 产物DNA于-20℃储存. 18号染色体SIDP标记引物碱基序列来源于网上数据库(表1), 由大连宝生物公司合成. PCR反应体系为20 μL, 含全基因组扩增产物1 μL, 2.5 mmol/L dNTPs 1.6 mL, 10 mmol/L的引物混合物4 μL, Taq DNA聚合酶0.1 ml, 10×PCR缓冲液2 μL (含有MgCl2 1.5 mmol/L, Tris. HCl 10 mmol/L, KCl 50 mmol/L), 95℃预变性2 min, 95℃ 变性30 s, 55℃退火 75 s, 72℃延伸 25 s, 共重复35个循环. 最后在72℃延伸6 min. PCR产物不需纯化处理, 取8 μL PCR产物行DHPLC分析, 以非变性温度进行检测, 流动相为0.1 mol/L三乙酸基乙胺(TEAA, pH 7.0)和25%乙晴, 按不同梯度进行混合, 柱温50℃, 流速0.9 mL/min. 取经DHPLC检测有LOH的标本的PCR产物5 μL, 加入变性缓冲液(95%甲酰胺, 10 mmol/L EDTA, 0.05%溴酚蓝, 0.05%二甲苯蓝)稀释5倍, 98℃变性10 min, 取2-3 mL上样于含7 mol/L尿素的6%变性聚丙烯酰胺凝胶, 室温恒压450V, 电泳2.5 h, 取下凝胶以硝酸银染色后观察结果.
| 名称 | 引物序列(5'-3') | 产物的长度(bp) |
| MID24 | MID24-F: 5'-CAGTGAAAGCCTCATTTCTTAA-3' | 155-159 |
| MID24-R: 5'-TCACAAAGGAAATGTTCTTTTAC-3' | ||
| MID25 | MID25-F: 5'-TCAACAGTTTTGCATATACAAAA-3' | 129-130 |
| MID25-R: 5'-TAAGCCCTTTTATTTTTCCTAAC-3' | ||
| MID148 | MID148-F: 5'-CAAAGCCATTCCAAAGTTAA-3' | 134-138 |
| MID148-R: 5'-TATTTGTCCAGCCTATTGCA-3' | ||
| MID149 | MID149-F: 5'-TTTGAACACATTCTGGAAGG-3' | 115-127 |
| MID149-R: 5'-TTGAAGATAATCGATCCCAA-3' | ||
| MID150 | MID150-F: 5'-GACGAATGCAGAACACTTCT-3' | 106-112 |
| MID150-R: 5'-AATCTGAGGGAGCTGAGTAAC-3' | ||
| MID151 | MID151-F: 5'-AAAATGTGTGTGTTGCACTG-3' | 79-82 |
| MID151-R: 5'-AAACTCATCCAGATTTAAATGC-3' | ||
| MID298 | MID298-F: 5'-AACATTGGCGTTTTCTAGTG-3' | 131-135 |
| MID298-R: 5'-TGTTTGTTTTCAAGCATTTTT-3' | ||
| MID352 | MID352-F: 5'-CATTCACTGTTGTATTGCGA-3' | 98-101 |
| MID352-R: 5'-ATGCTCCTTATGTTGACTGG-3' | ||
| MID487 | MID487-F: 5'-AGTTGTGCACCCAAGAGAG-3' | 74-78 |
| MID487-R: 5'-TATGACGGAAGAAAATGAGC-3' |
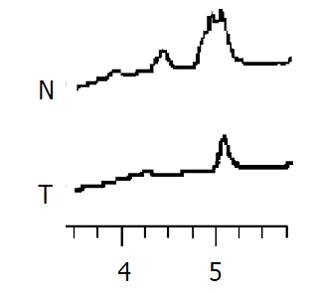
正常组织DNA等位片段为杂合子者(即色谱峰数目为2个或2个以上)可提供判断LOH信息. 共检测10例胃癌组织标本及其相应的正常组织标本, 将肿瘤组织与其相应正常组织相比, DNA的扩增产物的DHPLC色谱峰数目减少或色谱峰相对高度减少50%以上判定为LOH(图1). 结果表明有3例胃癌组织的MID150位点的PCR产物的DHPLC峰型呈现LOH(30%). 其中1例同时在另外2个SIDP位点(MID148、MID352)DHPLC色谱峰型也呈现LOH. 9个位点中有6个位点(MID24, MID25, MID149, MID151, MID298, MID487)的PCR产物的DHPLC色谱峰型未见异常.
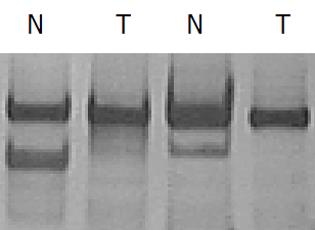
取5对经DHPLC检测峰型表现为LOH的PCR产物, 将肿瘤组织与其相应的正常组织DNA的PCR结果相比较, 若肿瘤样品某一等位基因条带消失或相对密度减少50%以上, 记为LOH(图2). 结果可见5例癌组织PCR产物与其相应正常组织相比, 癌组织DNA的扩增条带消失, 表现为LOH.
近年来肿瘤分子生物学研究表明, 肿瘤的发生发展是个多阶段、多步骤的过程, 涉及多种癌基因的激活和抑癌基因的失活. 抑癌基因是野生型的等位基因, 肿瘤细胞中抑癌基因突变失活常常表现为一个等位基因丢失(allelic loss)和另一个存留等位基因(retained allele)失活性突变. 其中, 等位基因丢失就是由肿瘤细胞中多见的染色体缺失所致, 他同时还会伴有抑癌基因座位相邻区域的杂合性缺失. LOH是指肿瘤基因组中特定染色体上某种DNA多态标记(如RFLP和微卫星多态标记)的等位基因片段由同一患者正常组织基因组的两种变成一种, 即等位基因型由杂合子变成纯合子. LOH是肿瘤细胞中染色体缺失的结果, 提示所检查DNA多态标记附近存在抑癌基因. 因此, 肿瘤组织LOH分析为定位和发现抑癌基因的有效手段.
众所周知, 肿瘤细胞并非孤立存在于组织中, 而是依存于多种不同类型细胞相互构成的三维空间中. 用传统方法从磨碎组织中提取DNA, 因各种细胞成分混杂难免造成检测结果的偏差. 因此, 肿瘤组织中细胞的异质性已成为分子病理学和肿瘤基因组学研究的突出问题. 本实验运用LCM技术, 捕获单个肿瘤细胞, 从而避免了异质细胞对实验结果的干扰. 同时为了克服LCM技术分离目的细胞的数量有限性, 本实验对LCM分选的细胞进行高可信度的全基因组扩增. 因其有简便、精确、高效和可靠等特点, 可广泛应用于肿瘤细胞基因的杂合性丢失的检测.
传统的杂合性丢失的检测方法多为聚丙烯酰胺凝胶电泳加硝酸银染色的方法, 存在费时、费力、有毒操作等许多弊端, 本实验采用DHPLC技术检测LOH, PCR产物不需纯化处理, 可直接行DHPLC分析, 完全自动化检测, 每20 min即可检测一个样品, 满足肿瘤基因组学研究中对高通量检测技术的需求, 其省时省力的同时, 可精确、高效的进行LOH的检测, 可以与传统的聚丙烯酰胺凝胶电泳加硝酸银染色的方法相媲美.
胃癌的发生发展中, 经常发生18号染色体的LOH[29,30], 常见的杂合性丢失为18 q和17 p, 并发现在18 q的杂合性丢失比17 p的杂合性丢失在胃癌的发展过程中更早出现. 目前定位于18 q的侯选抑癌基因主要有3个, 即DCC基因, DPC4基因, JV18-1基因或MADR2基因. DCC基因是在研究大肠癌时发现并命名的, 有研究表明DCC基因LOH是胃癌的晚期改变, 与病情进展相关[31,32]. DPC4基因, 主要是在前列腺癌中检测中发现的, 其在胃癌的发生中也起重要作用[33-35]. JV18-1基因或MADR2基因, 主要是编码一个DPC4相关蛋白的基因, 其与胃癌发生发展的关系尚不明确. 另外, 有报道发现18 q 12.2区域也常常发生胃癌LOH, 其中的抑癌基因尚未被克隆出来.
本实验选用18号染色体上的9个短插入/缺失多态(SIDP)标记, 对10例原发性胃癌进行了LOH的研究, 结果表明在MID150位点处发生LOH的频率最高(3/10), 其次在MID148位点和MID352位点也可见LOH(1/10), 而其他位点在本实验中未检测到LOH. 推测胃癌中18号染色体的MID150位点LOH较常见, 该染色体位点上有可能存在与胃癌发生和发展相关的抑癌基因. 这个抑癌基因是否为胃癌常见缺失基因, 还需要进一步研究, 加以证实.
我们的研究也尝试将LCM、HF-WGA和DHPLC技术相结合, 应用于肿瘤细胞LOH检测, 建立了准确、高效、快速的胃癌相关抑癌基因定位方法, 其应用将有助于肿瘤基因组学和分子病理学中对抑癌基因定位与功能的研究.
编辑: N/A
| 6. | Gao HJ, Yu LZ, Bai JF, Peng YS, Sun G, Zhao HL, Miu K, L XZ, Zhang XY, Zhao ZQ. Multiple genetic alterations and behavior of cellular biology in gastric cancer and other gastric mucosal lesions:H.pylori infection, histological types and staging. World J Gastroenterol. 2000;6:848-854. [PubMed] [DOI] |
| 8. | Wang DX, Fang DC, Liu WW, Luo YF, Lu R. A study on the loss of heterozygosity of multiple tumor suppressor genes in gastrointestinal metaplasia. Zhonghua Binglixue Zazhi. 1999;28:264-267. |
| 11. | Tsugawa K, Yonemura Y, Hirono Y, Fushida S, Kaji M, Miwa K, Miyazaki I, Yamamoto H. Amplification of the c-met, c-erbB-2 and epidermal growth factor receptor gene in human gastric cancers: correlation to clinical features. Oncology. 1998;55:475-481. [PubMed] [DOI] |
| 17. | Chen GY, Wang DR. The expression and clinical significance of CD44v in human gastric cancers. World J Gastroenterol. 2000;6:125-127. [PubMed] [DOI] |
| 19. | 周 永宁, 徐 采朴, 韩 彪, 王 金穗, 房 殿春, 彭 贵勇, 杨 建民, 刘 海峰. 胃癌E -钙粘蛋白表达与临床病理学的关系. 世界华人消化杂志. 2002;10:1121-1124. [DOI] |
| 23. | 崔 大祥, 闫 小君, 张 沥, 赵 景蓉, 江 梅, 郭 晏海, 张 玲霞, 白 西平, 苏 成芝. 胃癌及癌前病变黏膜中呈高表达6个基因片段的筛选及其临床意义. 世界华人消化杂志. 1999;7:770-772. [DOI] |
| 27. | Kawabata K, Yamamoto T, Hara A, Shimizu M, Yamada Y, Matsunaga K, Tanaka T, Mori H. Modifying effects of ferulic acid on azoxymethane-induced colon carcinogenesis in F344 rats. Cancer Lett. 2000;157:15-21. [PubMed] [DOI] |
| 29. | de Manzoni G, Tomezzoli A, Di Leo A, Moore PS, Talamini G, Scarpa A. Clinical significance of mutator phenotype and chromosome 17p and 18q allelic loss in gastric cancer. Br J Surg. 2001;88:419-425. [PubMed] [DOI] |
| 30. | Yustein AS, Harper JC, Petroni GR, Cummings OW, Moskaluk CA, Powell SM. Allelotype of gastric adenocarcinoma. Cancer Res. 1999;59:1437-1441. [PubMed] |
| 31. | Fang DC, Jass JR, Wang DX, Zhou XD, Luo YH, Young J. Infrequent loss of heterozygosity of APC/MCC and DCC genes in gastric cancer showing DNA microsatellite instability. J Clin Pathol. 1999;52:504-508. [PubMed] [DOI] |
| 32. | Fang DC, Jass JR, Wang DX. Loss of heterozygosity and loss of expression of the DCC gene in gastric cancer. J Clin Pathol. 1998;51:593-596. [PubMed] [DOI] |
| 33. | Schwarte-Waldhoff I, Klein S, Blass-Kampmann S, Hintelmann A, Eilert C, Dreschers S, Kalthoff H, Hahn SA, Schmiegel W. DPC4/SMAD4 mediated tumor suppression of colon carcinoma cells is associated with reduced urokinase expression. Oncogene. 1999;18:3152-3158. [PubMed] [DOI] |
| 34. | Iacobuzio-Donahue CA, Wilentz RE, Argani P, Yeo CJ, Cameron JL, Kern SE, Hruban RH. Dpc4 protein in mucinous cystic neoplasms of the pancreas: frequent loss of expression in invasive carcinomas suggests a role in genetic progression. Am J Surg Pathol. 2000;24:1544-1548. [PubMed] [DOI] |