修回日期: 2003-02-10
接受日期: 2003-03-28
在线出版日期: 2003-11-15
研究癌基因mdm2在胃癌中的基因扩增和蛋白表达状况, 揭示mdm2与胃癌发生发展的相关性.
用RT-PCR和Westernblot方法对胃癌细胞在mRNA、蛋白质水平上进行检测.
mdm2的基因扩增阳性率在胃癌组织中较高, 其中低分化12.5%、中分化37.5%、高分化87.5%, 与正常组织比较有显著性差异(P<0.05), 且与病理分级有关(P<0.05). mdm2的蛋白表达阳性率在胃癌组织中较高, 其中低分化25%、中分化37.5%、高分化62.5%, 与正常组织比较有显著性差异(P<0.05), 与病理分级无关(P>0.05).
mdm2的基因扩增和蛋白过表达参与胃癌的发生发展, 检测胃癌mdm2基因扩增对估计该肿瘤的预后可能有所帮助.
引文著录: 孙利平, 李岩, 张宁, 姜乃佳, 付伟, 薛一雪. MDM2基因扩增和蛋白表达与胃癌相关性的研究. 世界华人消化杂志 2003; 11(11): 1800-1801
Revised: February 10, 2003
Accepted: March 28, 2003
Published online: November 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(11): 1800-1801
- URL: https://www.wjgnet.com/1009-3079/full/v11/i11/1800.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i11.1800
胃癌是危害人类健康的主要恶性肿瘤之一, 基因异常表达是肿瘤发生的重要原因. 我们收集不同病理分类的胃癌标本, 检测mdm2在胃癌组织中的基因水平和蛋白表达, 进而分析mdm2与胃癌发生、发展及预后的关系, 为临床治疗胃癌提供分子生物学方面的依据.
标本来源: 中国医科大学附属第二医院胃镜室及一院肿瘤外科手术胃癌标本, 取高分化、中分化、低分化各8例. 取6例正常胃窦组织为对照组. 主要试剂: MDM2抗体为美国Neomarkers公司产品; ECL (enhanced chemiluminescence, ECL)试剂盒为美国Santa Cruz公司产品; RNA提取试剂TRIzol购自Invetrogen公司; PCR试剂盒为TAKARA公司产品; RT-PCR引物由上海生物工程公司合成.
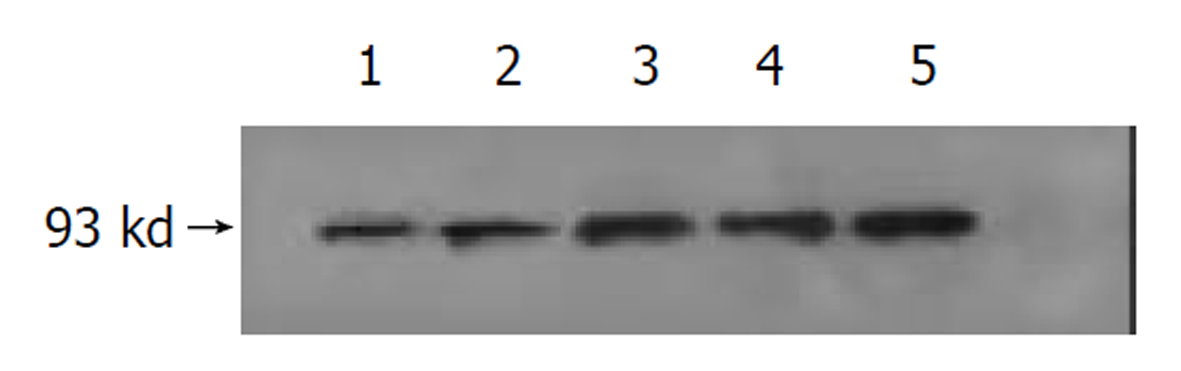
1.2.1 Western印迹杂交 提取组织蛋白, 采用考马斯亮蓝法测定样品中的蛋白质含量. 取等蛋白量的样品, 电泳分离, 转印, 加入抗体室温杂交2 h, 用ECL试剂盒显色, X线片曝光, 并通过相应蛋白带的相对灰度值表示蛋白含量的变化.
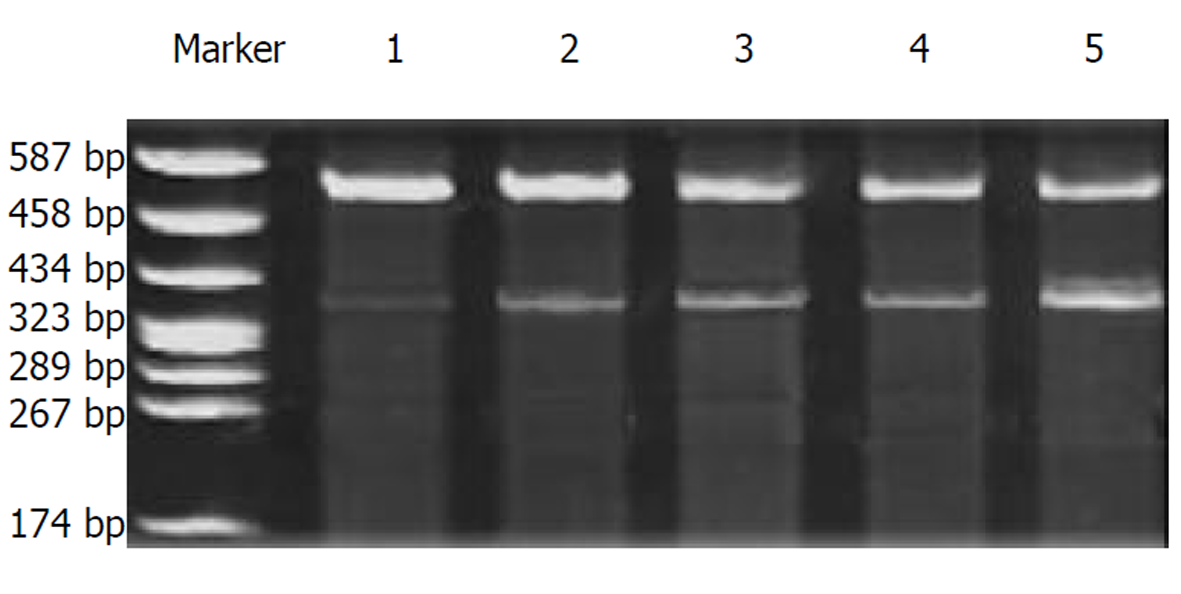
1.2.2 RT-PCR半定量测定 用TRIzol提取胃癌组织的RNA, 合成cDNA第一链. 应用primer Premier5软件设计引物, 取3 μL cDNA 用于PCR 扩增, 扩增条件为: 建立25 μL反应体系, 95 °C预变性90 s, 循环28次, 循环条件为: 94 °C变性30 s , 58 °C退火1 min, 72 °C延伸1 min. 循环结束后72 °C延伸10 min. 取10 μL PCR产物进行电泳, EB染色, 扫描分析. mdm2基因拷贝数 = mdm2电泳带相对灰度值/ β-actin电泳带相对灰度值.
统计学处理 采用x2检验判断统计结果. P<0.05具有统计学意义.
经检测在胃癌中表达的MDM2高于对照组, 二者比较有显著性差异(P<0.05). 基因蛋白的表达与癌组织分化程度有一定关系图1. 高、中分化癌MDM2阳性率较高, 在低分化癌中阳性率较低, 但组间无显著性差异(P>0.05). 表达阳性率见表1.
| 正常 | 低分化胃癌 | 中分化胃癌 | 高分化胃癌 | |
| 阳性 | 0 | 2 | 3 | 5 |
| 阴性 | 6 | 6 | 5 | 3 |
| 阳性率(%) | 0 | 25 | 37.5 | 62.5 |
mdm2是近年来发现的癌基因, 位于染色体12q13-14, mdm2体内最重要的作用是抑制野生型p53的激活转录功能和抗肿瘤活性. 研究发现MDM2蛋白的过度表达导致同时表达的P53蛋白量减少, 突变引起的MDM2作用障碍导致P53的集聚和活化[1]. mdm2可因野生型p53诱导而转录增强, 其表达产物MDM2蛋白又转而可与P53蛋白形成复合物, 封闭其转录活性, 此即所谓P53/MDM2负反馈调节环. 此外, P53蛋白只在核内发挥作用, 其向核外转运可能以MDM2蛋白依赖的方式进行[2], 通过这两种机制, MDM2蛋白将野生型P53蛋白控制较低的无活性水平. Meltzer [3]提出, MDM2蛋白过表达和p53基因突变相似, 均可使p53基因功能丧失. mdm2除抑制抑癌基因p53产生, 其本身也有致癌作用. mdm2在细胞转化过程中起癌基因作用的证据很多[4], 部分肿瘤既有mdm2的过度表达又有p53的突变, 此类患者的预后比仅有两种变化之一的患者差很多, 另外在哺乳期mdm2转基因小鼠的乳房上皮中有其过度表达, 使得细胞癌变也是证据.
有关胃癌相关基因扩增及表达的研究较多[5-13], 而在胃癌中mdm2的表达鲜有报道. 本实验经Westernblot方法检测, MDM2蛋白表达的阳性率在胃癌中较高, 与正常组织相比有统计学意义, 提示MDM2蛋白表达异常在胃癌中的作用也是不容忽视的, 同时也进一步说明MDM2-P53功能异常是肿瘤发生中较为常见的分子机制. 本实验经RT-PCR方法检测表明, mdm2基因的扩增与胃癌组织的分化程度有相关性, 这一现象提示mdm2的基因扩增可能与胃癌的恶性程度及预后有关. 另外, 本实验结果可提示: 通过阻断P53-MDM2二者的相互作用或者降低MDM2含量, 或者将MDM2滞留于核内将会激活P53的肿瘤抑制功能, 同样可以增强P53的功能. 这种假设已在人类肿瘤得到证实, 即恶性胶质瘤、人类颈部肿瘤[14,15], 国内亦有学者在肺癌细胞中得到证实[16], 但胃癌方面的治疗作用还是空白, 有待进一步探索研究.
| 1. | Kubbutat MH, Jones SN, Vousden KH. Regulation of p53 stability by Mdm2. Nature. 1997;387:299-303. [PubMed] [DOI] |
| 2. | Almog N, Rotter V. An insight into the life of p53: a protein coping with many functions. Biochim Biophys Acta. 1998;1378:R43-R54. [PubMed] |
| 3. | Meltzer PS. MDM2 and p53: a question of balance. J Natl Cancer Inst. 1994;86:1265-1266. [DOI] |
| 4. | Freedman DA, Wu L, Levine AJ. Functions of the MDM2 oncoprotein. Cell Mol Life Sci. 1999;55:96-107. [PubMed] [DOI] |
| 14. | Arap W, Knudsen E, Sewell DA, Sidransky D, Wang JY, Huang HJ, Cavenee WK. Functional analysis of wild-type and malignant glioma derived CDKN2Abeta alleles: Evidence for an RB-independent growth suppressive pathway. Oncogene. 1997;15:2013-2020. [PubMed] [DOI] |
| 15. | Liggett WH, Sewell DA, Rocco J, Ahrendt SA, Koch W, Sidransky D. p16 and p16beta are potent growth suppressors of head and neck squamous carcinoma cell in vitro. Cancer Res. 1996;56:4119-4123. [PubMed] |