修回日期: 2002-11-20
接受日期: 2002-11-29
在线出版日期: 2003-11-15
前瞻性评价国产α-2b干扰素治疗CHB的疗效.
32例CHB患者, 每次α-2b干扰素6 MU、皮下注射、3次/wk, 疗程为3 mo, 停药后随访6 mo. 16例患者于治疗前后进行了肝活检.
治疗结束时, 完全应答1例(3.1%), 部分应答12例(37.5%), 无应答19例(59.4%), 总应答率为40.6% (13/32). 随访结束时, 总应答率为50.0% (16/32).
α-干扰素具有后续抗HBV作用. 部分抗病毒无效的患者仍可从α-干扰素的治疗中获益.
引文著录: 熊锦华, 胡大荣, 张成平, 范公忍, 刘勇, 闻炜. α-2b干扰素治疗慢性乙型肝炎的前瞻性研究. 世界华人消化杂志 2003; 11(11): 1723-1726
Revised: November 20, 2002
Accepted: November 29, 2002
Published online: November 15, 2003
To prospectively evaluate the response to interferon α-2b (IFN) in chronic hepatitis B.
We enrolled a total number of 32 patients with CHB for the study. The patients received 6 million units of IFNα-2b subcutaneously thrice a weak for 3 months and also a follow-up for 6 months. Liver biopsies were obtained in 16 patients with CHB before and after treatment.
The complete response rate, partial response rate and non-response rate were 3.1%, 37.5% and 59.4%, respectively. The overall response rate was 40.6% (13/32) at the end of treatment. The overall response rate was 50.0% (16/32) at the end of follow-up.
Interferon-α had lasting antiviral effects in chronic hepatitis B. Some of the patients non-responsive to antiviral therapy acquired benefits from interferon-α treatment.
- Citation: Xiong JH, Hu DR, Zhang CP, Fan GR, Liu Y, Wen W. Prospective study of response to interferon α-2b in chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2003; 11(11): 1723-1726
- URL: https://www.wjgnet.com/1009-3079/full/v11/i11/1723.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i11.1723
α-干扰素治疗慢性乙型肝炎(chronic hepatitis B, CHB)疗效的评价, 国内多限于临床观察, 且以回顾性分析资料居多. 本研究旨在通过治疗前后患者肝活检组织学变化和HBV血清学标志的改变, 前瞻性地评价国产α-2b干扰素治疗CHB的疗效.
32例均为2000年期间在我院就医的CHB患者, 男性21例, 女性11例, 年龄29±6 岁. 临床诊断符合2000年西安会议修订的标准, 并排除了HIV、HCV、HDV、EBV和CMV的混合感染. 患者入组前均有6 mo以上HBeAg和HBV-DNA阳性病史, 入组前半年内均未接受过干扰素和拉米夫定治疗, 治疗前血清ALT水平为118±72 U/L. 注射用重组人α-2b干扰素(批号: 000301)为江苏新宝制药厂生产; 鼠抗人HBsAg单克隆抗体、兔抗人HBcAg多克隆抗体和免疫组织化学染色试剂盒, 分别购自美国Santa Cruz公司和Ezyme Lab公司.
1.2.1治疗方法 注射用重组人α-2b干扰素每次6 MU、皮下注射、3次/wk, 疗程为3 mo, 治疗结束后随访6 mo.
1.2.2 观察指标 (1) HBV血清学指标: 患者治疗前、后及随访结束时HBsAg、anti-HBs、HBeAg、anti-HBe、anti-HBc(ELISA法)和HBV-DNA(PCR法)均采用商品试剂盒检测. (2)肝组织病理学检查: 16例患者于治疗前和治疗结束时进行了肝活检, 在B型超声引导下使用自动组织活检枪(16G)进行, 获得的肝组织长度均在10 mm以上, 组织以4%中性甲醛固定、石蜡包埋, 片厚5 μm. 切片除进行HE染色外, 还进行了网纤和胶原组织染色. (3) 免疫组织化学染色: 操作严格按说明书进行. (4) PCR法检测石蜡切片肝组织HBV-DNA 方法学另文发表, 主要步骤包括石蜡切片二甲苯脱蜡、组织消化、裂解HBV颗粒、抽提DNA和HBV-DNA检测. (5)抗HBV应答评价: (a)完全应答: HBV-DNA和HBeAg转阴, 并实现E系统转换; (b)部分应答: HBV-DNA和HBeAg转阴, 但未实现E系统转换或HBeAg未转阴, 但HBV-DNA由阳性转为弱阳性; (c)无应答: 未发生上述变化. (6) 肝组织学评价所有切片均经二名病理科医师诊断. 肝脏炎症分级(G)和肝纤维化分期(S)按2000年西安会议修订的标准执行.
统计学处理 各组数据均以均数±标准差(mean±SD)表示, 统计分析采用均数t检验.
32例患者全部完成治疗和6 mo的随访. 治疗结束时完全应答1例(3.1%). 部分应答12例(37.5%), 其中5例HBV-DNA和HBeAg转阴, 但未实现E系统转换, 7例HBeAg未转阴, HBV-DNA由阳性(或强阳性)转为弱阳性. 无应答19例(59.4%), 总应答率为40.6% (13/32). 随访结束时, 完全应答者(1例)无变化; 部分应答者(12例)10例维持为部分应答, 1例转为完全应答, 1例转为无应答; 无应答者(19例)15例维持, 1例转为完全应答, 3例转为部分应答. 总应答率为50.0%(16/32), 较治疗结束时(40.6%)提高了9.4个百分点. 整个观察期间无1例血清HBsAg转阴.
结果见表1.
| 患者 | 血清 | 肝组织 | 免疫组化 | |||||
| HBV-DNA | HBV-DNA | HBsAg | HBcAg | |||||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | |
| 1 | + | + | - | - | + | - | - | - |
| 2 | + | + | + | + | + | - | + | +~++ |
| 3 | + | - | + | - | ++ | + | - | - |
| 4 | + | - | + | - | + | - | - | - |
| 5 | + | + | + | + | ++ | - | ++ | ++~+++ |
| 6 | + | + | - | - | + | + | - | + |
| 7 | + | + | + | + | ++~+++ | + | ++~+++ | ++ |
| 8 | + | + | + | + | ++~+++ | - | ++ | ++ |
| 9 | + | - | + | - | +++ | + | + | - |
| 10 | + | - | + | - | + | - | + | - |
| 11 | + | + | + | + | + | + | + | + |
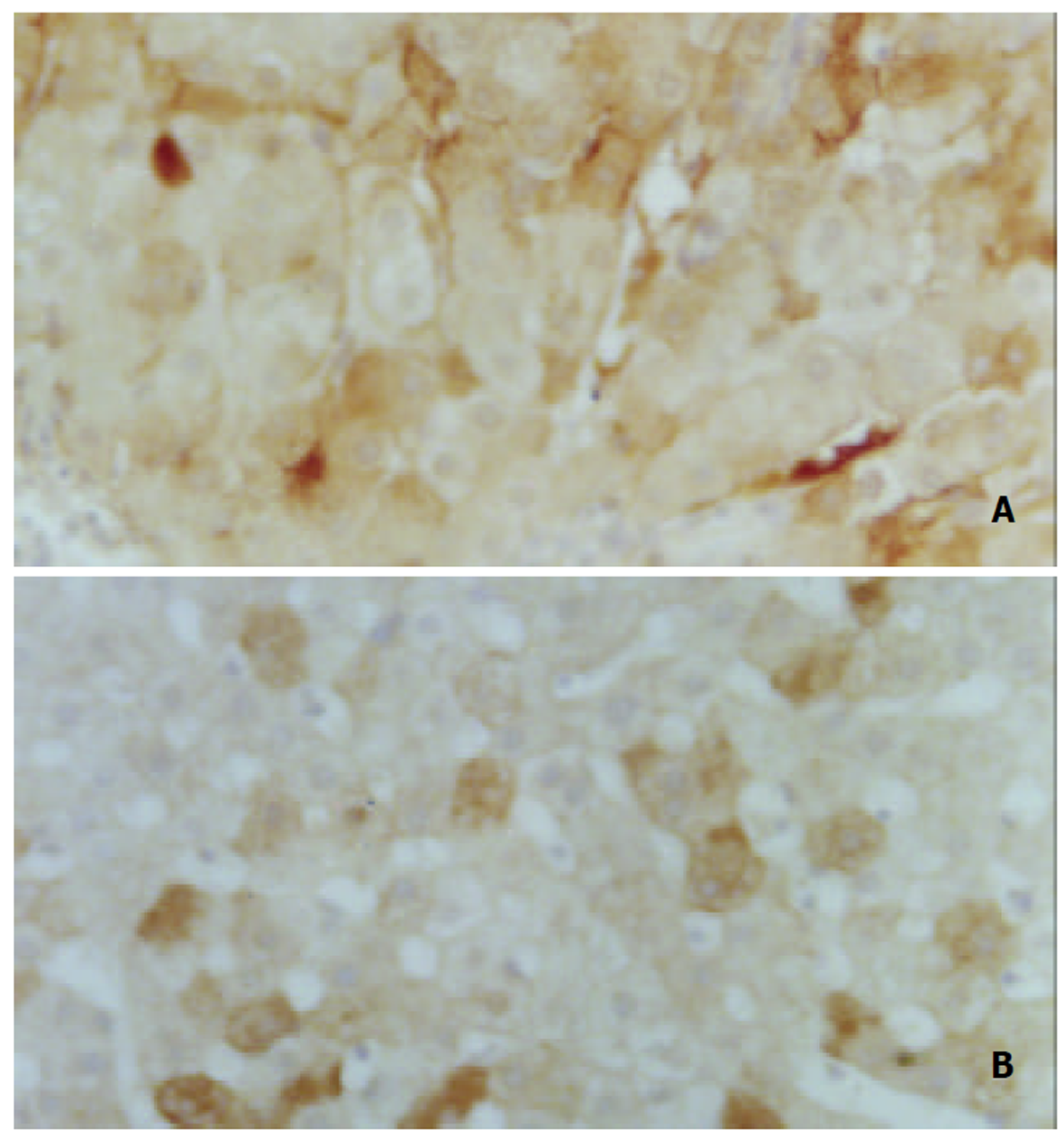
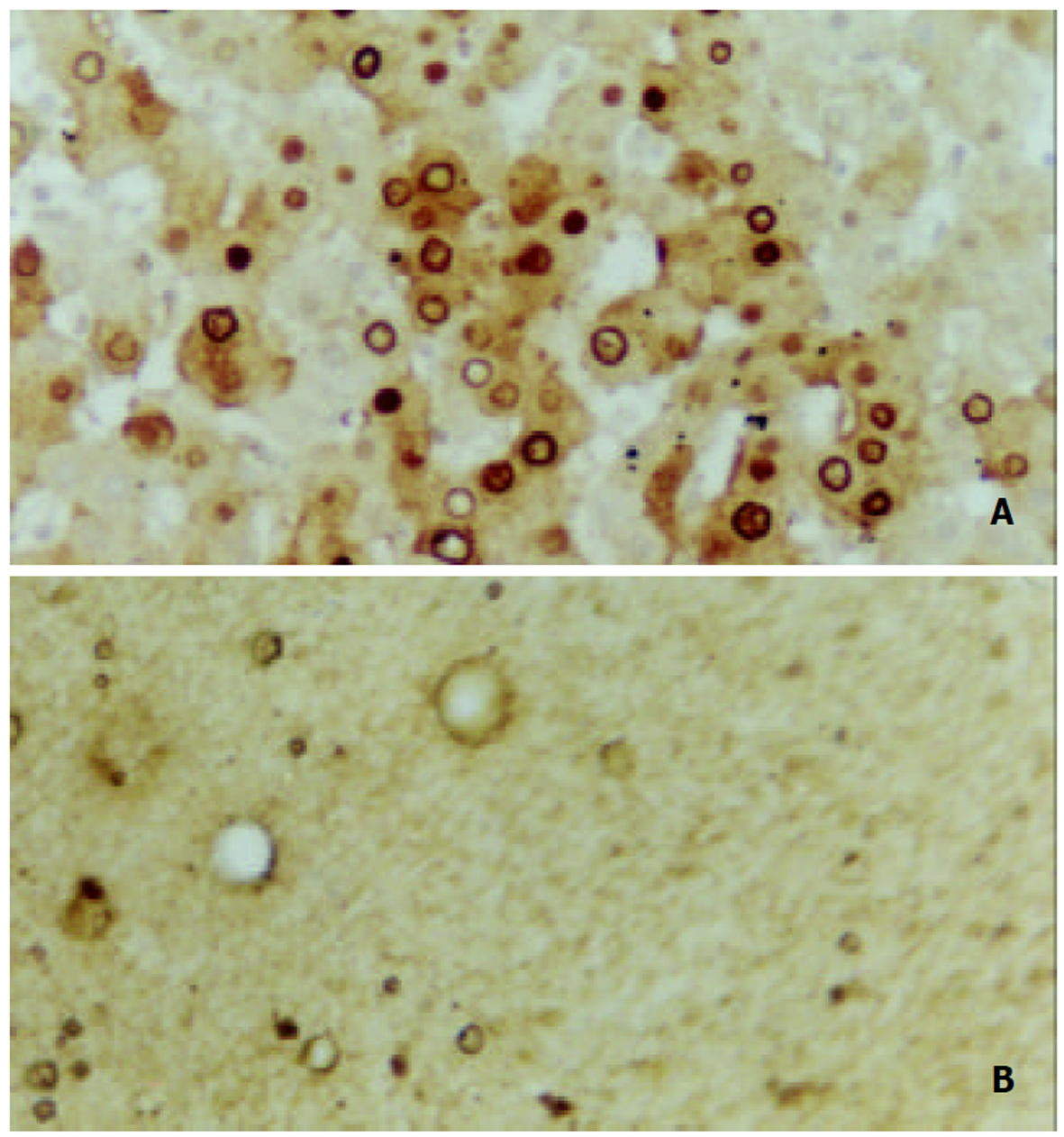
由上表可见, 治疗前后患者血清和肝组织中HBV-DNA的检出情况并不完全一致, 但多数患者随着血清中HBV-DNA的清除, 肝组织中HBV-DNA也随之转阴. 血清和肝组织中HBV-DNA清除与否, 与肝组织中HBsAg和HBcAg的表达缺乏规律性变化, 但部分病例随着HBV-DNA的转阴, HBsAg和HbcAg的表达消失或减弱, 见图1、图2.
16例患者治疗前后的肝组织切片比较结果显示, 多数患者有不同程度的好转, 分级分期结果见表2.
| 患者 | 炎症分级(G) | 纤维化程度(S) | ||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | |
| 1 | 2 | 1 | 2 | 2 |
| 2 | 3 | 2 | 2 | 1 |
| 3 | 1 | 2 | 2 | 2 |
| 4 | 2 | 2 | 3 | 3 |
| 5 | 3 | 2 | 3 | 2 |
| 6 | 3 | 2 | 2 | 1 |
| 7 | 3 | 3 | 2 | 2 |
| 8 | 2 | 3 | 2 | 2 |
| 9 | 2 | 1 | 2 | 2 |
| 10 | 2 | 2 | 2 | 2 |
| 11 | 3 | 2 | 2 | 1 |
| 12 | 2 | 1 | 3 | 2 |
| 13 | 2 | 2 | 3 | 3 |
| 14 | 1 | 1 | 1 | 1 |
| 15 | 3 | 3 | 2 | 2 |
| 16 | 2 | 3 | 3 | 3 |
治疗后炎症活动度3例由G2降为G1, 4例由G3降为G2, 其余9例镜下虽可见炎性细胞浸润减少、肝细胞坏死程度减轻, 但不足以达到降1级的标准. 纤维化程度3例由S2降为S1, 2例由S3降为S2, 其余11例虽然镜下可见纤维隔减少、变薄、变短, 但不足以达到降1期的标准. 患者治疗前后肝组织学的改变与其血清和肝组织的HBV感染标志检测结果并无明显一致性. 在治疗无应答的8例患者中, 有3例G达到降1级标准, 其中1例S还同时达到降1期标准.
治疗前血清ALT水平为118±72U/L(其中正常2例, 升高2倍以内8例, 2-4倍16例, 大于4倍6例), 治疗结束时ALT水平明显降低(65±39 U/L)P<0.05.
虽然α-干扰素抗HBV的疗效远不尽人意, 但迄今仍被认为是惟一具有后续治疗作用(lasting beneficial effect)、而列入抗HBV的首选药物[1-6]. 在慢性乙型肝炎, α-干扰素持续应答率为25-40%, 其作用与其抗病毒蛋白产生和激活CTL细胞功能有关[7-9]. 本研究的前瞻性观察结果显示, α-2b干扰素每次600万单位、皮下注射、3次/wk, 治疗3 mo结束时, 32例患者中, 完全应答1例(3.1%), 部分应答12例(37.5%), 无应答19例(59.4%), 总应答率为40.6% (13/32), 与文献报道的结果相近. 随访期间, 新增完全应答2例、部分应答3例, 总应答率为50.0% (16/32), 较治疗结束时提高了9.4个百分点, 提示α-干扰素的确具有后续抗HBV作用, 若疗程延长至6 mo, 应答率可能还会有所提高.
一般认为, α-干扰素治疗有效的病例, 血循环中HBV-DNA的清除先于肝细胞中的清除[10-14]. 本系列中4例肝组织HBV-DNA随着血清HBV-DNA转阴而清除. 血清和肝组织中HBV-DNA清除如否, 与肝组织中HBsAg和HBcAg的表达缺乏规律性, 这可能与个体是否发生病毒基因整合于宿主基因组有关[15-18].
α-干扰素的抗肝纤维化作用与其抑制星状细胞活化、减少细胞外基质产生有关[19-21]. 本系列中3例由S2降为S1, 2例由S3降为S2. 值得指出的是, 在治疗无应答的8例患者中, 有3例G达到降1级标准, 其中1例还同时达到S降1期的标准, 提示部分抗病毒无效的患者仍可从α-干扰素的使用中获益.
HBV-DNA转阴已不再是治疗的惟一终极目标, 而应追求E系统的血清转换、肝功能和肝组织学的全面改善. 为进一步提高疗效, 在无更理想抗病毒药物推向临床之前, 联合治疗已开始受到重视[22-27]. α-干扰素与拉米呋定联合应用可能是目前最常见的选择[28-30], 但也不乏应谨慎推荐和客观评价联合治疗效果的报道.
| 1. | Yuen MF, Lai CL. Treatment of chronic hepatitis B. Lancet Infect Dis. 2001;1:232-241. [DOI] |
| 2. | Merle P, Trepo C, Zoulim F. Current management strategies for hepatitis B in the elderly. Drugs Aging. 2001;18:725-735. [PubMed] [DOI] |
| 3. | Terrault NA. Chronic hepatitis B. Current Treat Options Gastroenterol. 2001;4:493-502. [DOI] |
| 4. | Treatment of chronic hepatitis B: interferon alfa first. Prescrire Int. 2001;10:17-21. [PubMed] |
| 5. | Delaney WE 4th, Locarnini S, Shaw T. Resistance of hepatitis B virus to antiviral drugs: current aspects and directions for future investigation. Antivir Chem Chemother. 2001;12:1-35. [DOI] |
| 6. | Gervais A, Boyer N, Marcellin P. Tolerability of treatments for viral hepatitis. Drug Saf. 2001;24:375-384. [DOI] |
| 7. | Martin-Vivaldi R, Nogueras F, Vignote ML, Salmeron J, Aguilar J, Romero M, Andrade R, De la Mata M, Moreno JM, Perez J, Garcia G, Lopez de Hierro M, Gomez F, Palacios A, Otero S, Suarez E, Poyatos A, Quintero D. Multicenter retrospective study of response to interferon in chronic hepatitis B. Rev Esp Enferm Dig. 2000;92:561-572. [PubMed] |
| 9. | Sprengers D, Janssen HL, Kwekkeboom J, Niesters HG, de Man RA, Schalam SW. In vivo immunization following virus suppression: a novel approach for inducing immune control in chronic hepatitis B. J Viral Hepat. 2003;10:7-9. [DOI] |
| 10. | Wai CT, Chu CJ, Hussain M, Lok AS. HBV genotype B is associated with better response to interferon therapy in HBeAg (+) chronic hepatitis than genotype C. Hepatology. 2002;36:1425-1430. [DOI] |
| 11. | Wai CT, Lok AS. Treatment of hepatitis B. J Gastroenterol. 2002;37:771-778. [DOI] |
| 12. | Davis GL. Update on the management of chronic hepatitis B. Rev Gastroenterol Disord. 2002;2:106-115. [PubMed] |
| 13. | Berraondo P, Garcia-Navarro R, Gonzalez-Aseguinolaza G, Vales A, Blanco-Vrgoiti B, Larrea E, Riezu-Boj JI, Prieto J, Ruiz J. The woodchuck interferon-alpha system: Cloning, family description, and biologic activity. J Med Virol. 2002;68:424-432. [DOI] |
| 14. | Hadziyannis SJ, Papatheodoridis GV, Vassilopoulos D. Treatment of HBeAg-negative chronic hepatitis B. Semin Liver Dis. 2003;23:81-88. [DOI] |
| 15. | Heathcote J. Treatment of HBe antigen-positive chronic hepatitis B. Semin Liver Dis. 2003;23:69-80. [DOI] |
| 16. | van Nunen AB, Hansen BE, Suh DJ, Lohr HF, Chemello L, Fontaine H, Heathcote J, Song BC, Janssen HL, de Man RA, Schalm SW. Durability of HBeAg seroconversion following antiviral therapy for chronic hepatitis B: relation to type of therapy and pretreatment serum hepatitis B virus DNA and alanine aminotransferase. Gut. 2003;52:420-424. [DOI] |
| 17. | Liaw YF. Therapy of chronic hepatitis B: current challenges and opportunities. J Viral Hepat. 2002;9:393-399. [DOI] |
| 18. | Ninomiya T, Yoon S, Nagano H, Kumon Y, Seo Y, Kasuga M, Yano Y, Nakaji M, Hayashi Y. Significance of serum matrix metalloproteinases and their inhibitors on the antifibrogenetic effect of interferon-alfa in chronic hepatitis C patients. Intervirology. 2001;44:227-231. [DOI] |
| 19. | Alri L, Duffaut M, Selves J, Sandre K, Mularczyck M, Izopet J, Desmorat H, Bureau C, Chaouche N, Dalbergue B, Vinel JP. Maintenance therapy with gradual reduction of the interferon dose over one year improves histological response in patients with chronic hepatitis C with biochemical response: results of a randomized trial. J Hepatol. 2001;35:272-278. [DOI] |
| 20. | Boucher E, Guyader D, Jacquelinet S, Andre P, Mendler MH, Turlin B, Canva V, Nousbaum JB, Bernard PH, Nouel O, Raabe JJ, Dao T, Gasser P, Verger P, Boutin J, Bergerault P, Joram F, Colmar P, Messner M, Brissot P, Deugnier Y. Interferon and ursodeoxycholic acid combined therapy in chronic viral C hepatitis: controlled randomized trial in 203 patients. Dig Liver Dis. 2000;32:29-33. [DOI] |
| 21. | Schalm S, De Man R, Janssen H. Combination and newer therapies for chronic hepatitis B. J Gastroenterol Hepatol. 2002;17:S338-S341. [DOI] |
| 22. | Lewin S, Walters T, Locarnini S. Hepatitis B treatment: rational combination chemotherapy based on viral kinetic and animal model studies. Antiviral Res. 2002;55:381-396. [DOI] |
| 23. | Sangfelt P, Uhnoo I, Hollander A, Lindh G, Weiland O. Lamivudine and famciclovir combination therapy with or without addition of interferon-alpha-2b for HBeAg-positive chronic hepatitis B: a pilot study. Scand J Infect Dis. 2002;34:505-511. [DOI] |
| 24. | Pramoolsinsup C. Management of viral hepatitis B. J Gastroenterol Hepatol. 2002;S125-145. [DOI] |
| 25. | Leung N. Treatment of chronic hepatitis B: case selection and duration of therapy. J Gastroenterol Hepatol. 2002;17:409-414. [DOI] |
| 26. | Liaw YF. Management of patients with chronic hepatitis B. J Gastroenterol Hepatol. 2002;17:406-408. [DOI] |
| 28. | Mutimer D, Dowling D, Cane P, Ratcliffe D, Tang H, O'Donnell K, Shaw J, Elias E, Pillay D. Additive antiviral effects of lamivudine and alpha-interferon in chronic hepatitis B infection. Antivir Ther. 2000;5:273-277. [PubMed] |
| 29. | van Nunen AB, Janssen HL, Wolters LM, Niesters HG, de Man RA, Schalm SW. Is combination therapy with lamivudine and interferon-alpha superior to monotherapy with either drug? Antiviral Res. 2001;52:139-146. |
| 30. | Farrell G. Hepatitis Be antigen seroconversion: effects of lamivudine alone or in combination with interferon alpha. J Med Virol. 2000;61:374-379. [DOI] |