修回日期: 2002-10-20
接受日期: 2003-01-01
在线出版日期: 2003-11-15
通过大肠癌细胞的原代培养和大肠癌细胞株的培养, 探讨大肠癌细胞能否产生趋化因子, 产生趋化因子的条件及其产生的动力学情况.
分别用α-TNF, γ-IFN及IL-1刺激培养原代细胞及细胞株. 采用RT-PCR方法检测培养细胞趋化因子IP-10mRNA的表达.
大肠癌细胞在原代培养下经α-TNF、γ-IFN、IL-1的刺激可表达IP-10 mRNA. 大肠癌细胞株Colo320经α-TNF, γ-IFN或IL-1的刺激可表达IP-10 mRNA. Colo320的IP-10 mRNA表达依刺激因子浓度和时间的改变而改变.
大肠癌细胞在一定的条件下能够表达趋化因子如IP-10mRNA等.
引文著录: 杨春康, 陈道达, 田源, 张景辉. 大肠癌细胞可产生趋化因子IP-10. 世界华人消化杂志 2003; 11(11): 1703-1705
Revised: October 20, 2002
Accepted: January 1, 2003
Published online: November 15, 2003
To study whether colorectal carcinoma cells can produce chemokines, the production condition and the kinetics of chemokine mRNA expression in colonic carcinoma cell line.
Freshly isolated human colon adenocarcinomas from surgical specimens and the cell line - Colo320 were used for cell culture. α-TNF, γ-IFN and IL-1 were used as agonist stimulation of the cultured cells. The expression of IP-10 mRNA was assessed in cultured cells by reverse transcription polymerase chain reaction(RT-PCR).
The freshly isolated human colon adenocarcinoma cells and Colo320 could express IP-10 mRNA with the stimulation of α-TNF, γ-IFN and IL-1. The expression of IP-10 mRNA in Colo320 varied with different concentrations of the stimulating factors and at different time points of the stimulation.
Colorectal carcinoma cells can produce chemokines such as IP-10.
- Citation: Yang CK, Chen DD, Tian Y, Zhang JH. Chemokine IP-10 produced by colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2003; 11(11): 1703-1705
- URL: https://www.wjgnet.com/1009-3079/full/v11/i11/1703.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i11.1703
趋化因子能选择性地引导白细胞亚群的定向游走和组织内集聚[1]. 根据趋化因子的氨基数序列而将趋化因子分为4个亚家族, 即CXC, CC, C和CX3C亚家族[2]. IP-10即干扰素诱生蛋白10, 他属于趋化因子家族中的CXC家族. 许多不同的细胞包括白细胞, 内皮细胞, 纤维细胞, 上皮细胞及一些肿瘤细胞等均可表达趋化因子[3,4]. 大肠黏膜已被证明在炎症状态下能产生和分泌趋化因子[5], 我们研究大肠癌细胞能否产生趋化因子IP-10及其产生的条件.
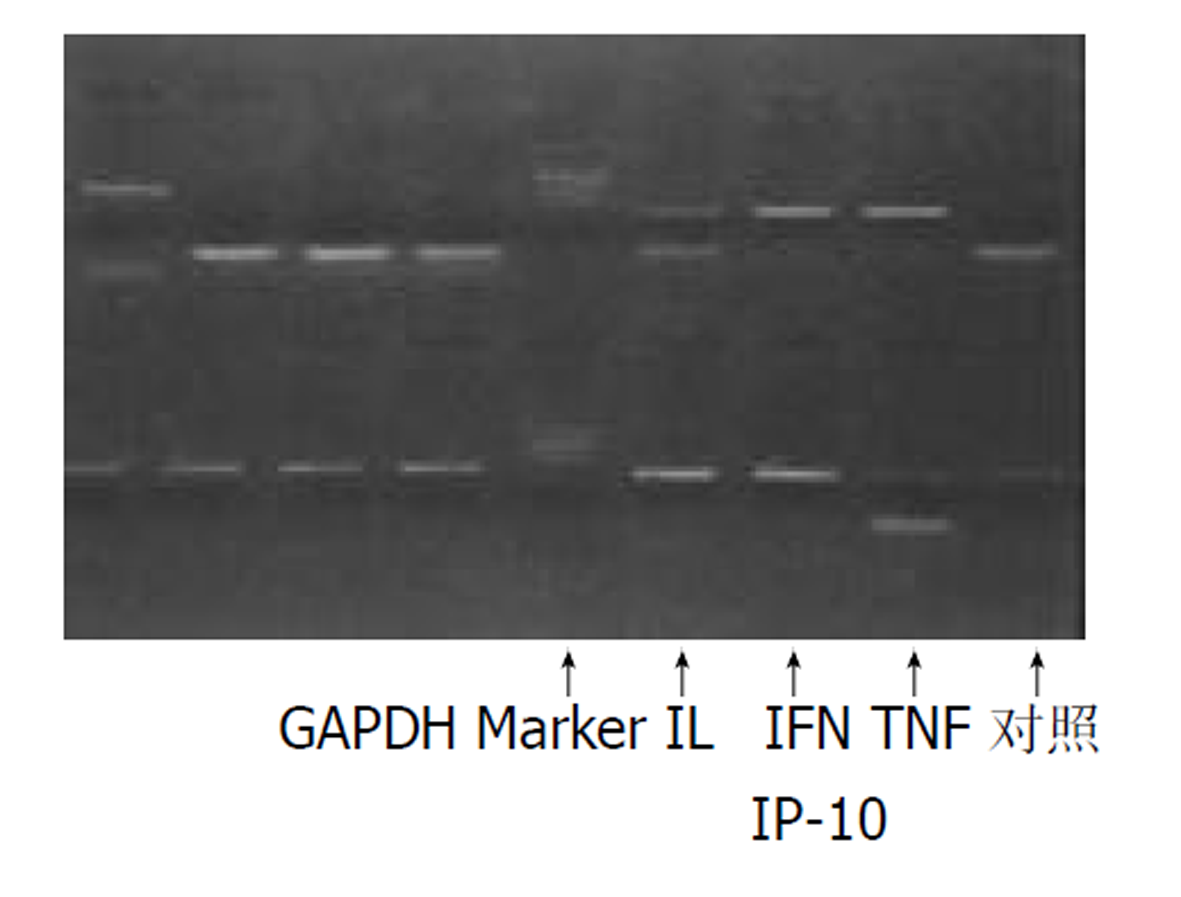
标本取自一乙状结肠肠管状腺癌患者. 术中待肿瘤标本切除后, 即刻挑选活力较好的部位, 切取1 cm3大小的肿瘤组织块, 尽量避免用退变组织或坏死组织. 标本制成细胞悬液后, 分成4份接种于6孔培养板上, 按常规方法培养 3-5 d, 观察到细胞黏附于板壁后, 补加原培养液量1/2的新培养液, 继续培养2-5 d后观察细胞近完全长满板壁时, 于3份标本中分别加入α-TNF (400KU/L), γ-IFN (1000KU/L)及IL-1(20KU/L). 另一份标本不加任何东西作为对照组. 继续培养24 h后中止培养. 所培养的贴壁细胞进行趋化因子的RT-PCR检测.
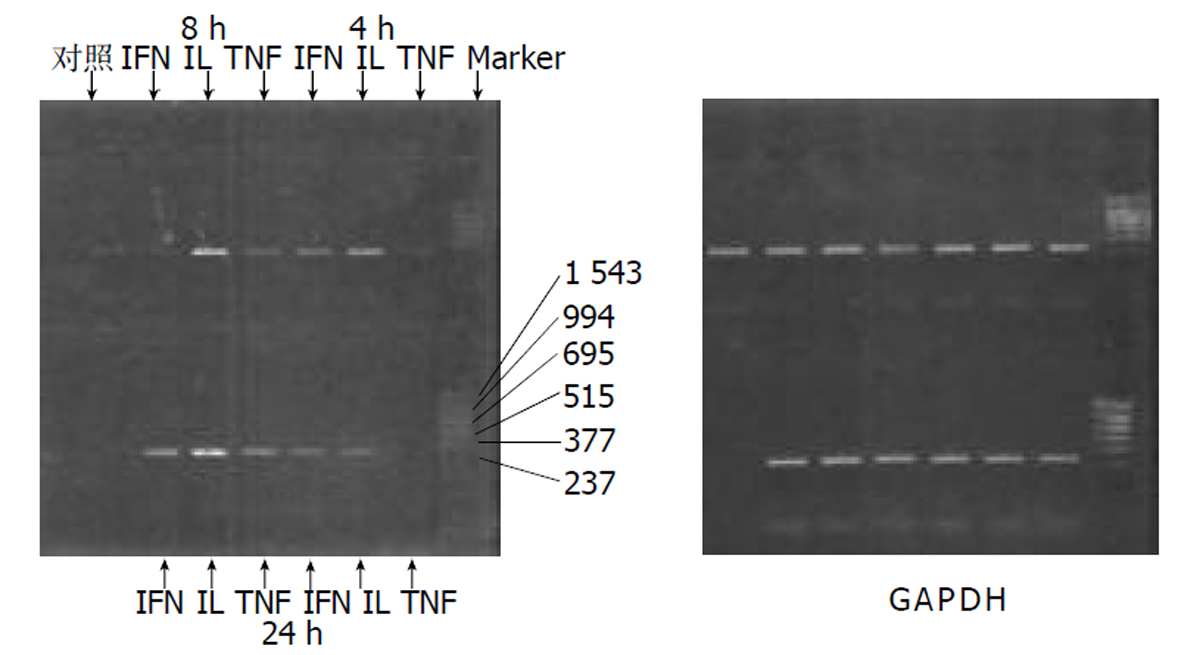
将Colo320细胞株(购自ATCC)按1: 2分装传代成功后, 分别接种于3个6孔培养板中的13个孔内, 培养观察待细胞近长满整个孔壁时, 更换培养液, 按培养液同一体积4 mL内分别加入不同浓度的γ-IFN (200和800KU/L), α-TNF(500和2000KU/L), IL-1 (10和40KU/L)刺激培养24 h或分别同一浓度的γ-IFN (800 KU/L), α-INF (12 000 KU/L), IL-1 (40 KU/L)分别刺激4、8、24 h, 其中一孔为空白对照. 将以上细胞培养至符合时段后, 吸尽上清, 培养细胞进行RT-PCR检测. 按常规方法进行, PCR反应条件为: 先90 °C变性5min, 后设置95 °C变性1 min, 60 °C退火及引物延伸2.5 min, 循环35轮. 趋化因子IP-10的引物序列: 5'primer: 5'-AGT GGC ATT CAA GGA GTA CC-3'; 3'primer: 5'-ATC CTT GGA AGC ACT GCA TC-3'; Standard RNA: 388; Target RNA: 289.
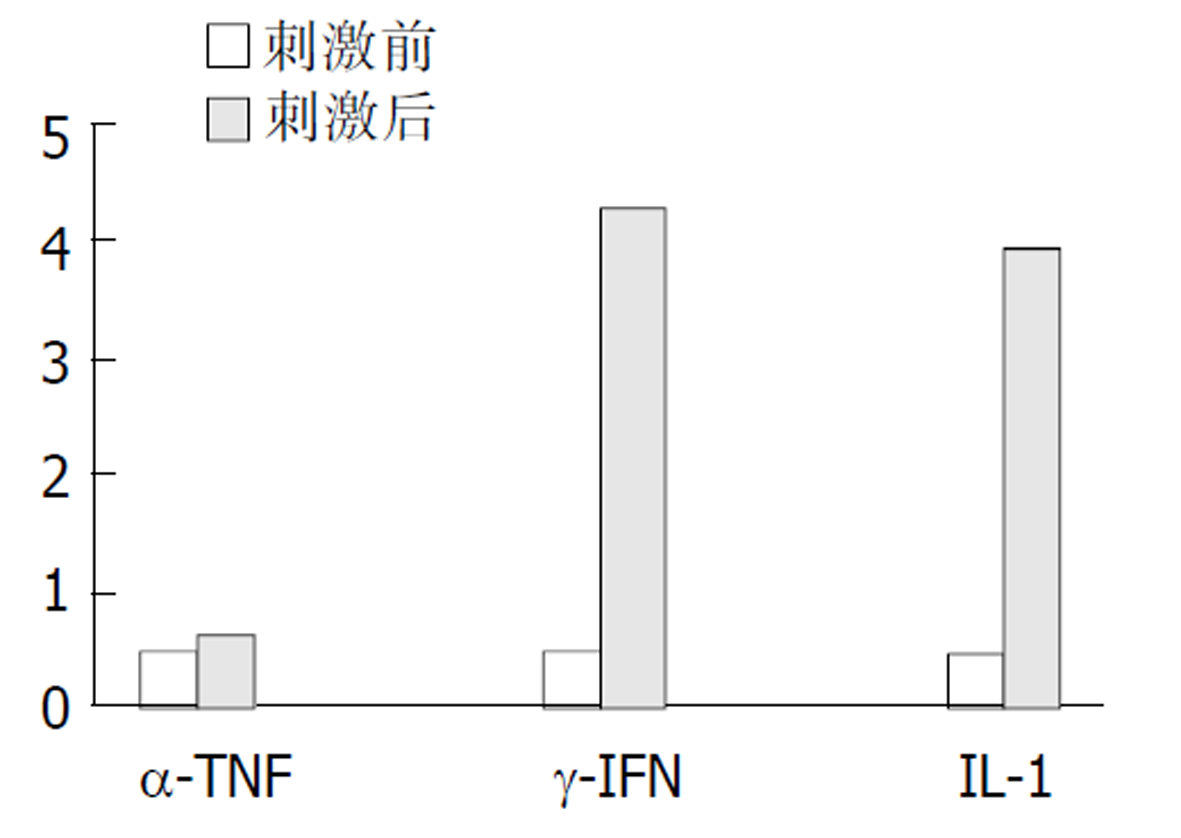
原代大肠癌细胞在非刺激条件下培养, RT-PCR检测趋化因子IP-10 mRNA有弱表达(图1). 在分别加入α-TNF、γ-IFN或IL-1后, IP-10的表达程度有较明显的升高(图1, 图2), 大肠癌细胞对3种刺激因子的刺激均可表达IP-10 mRNA, 表达对γ -IFN和IL-1的刺激较敏感.
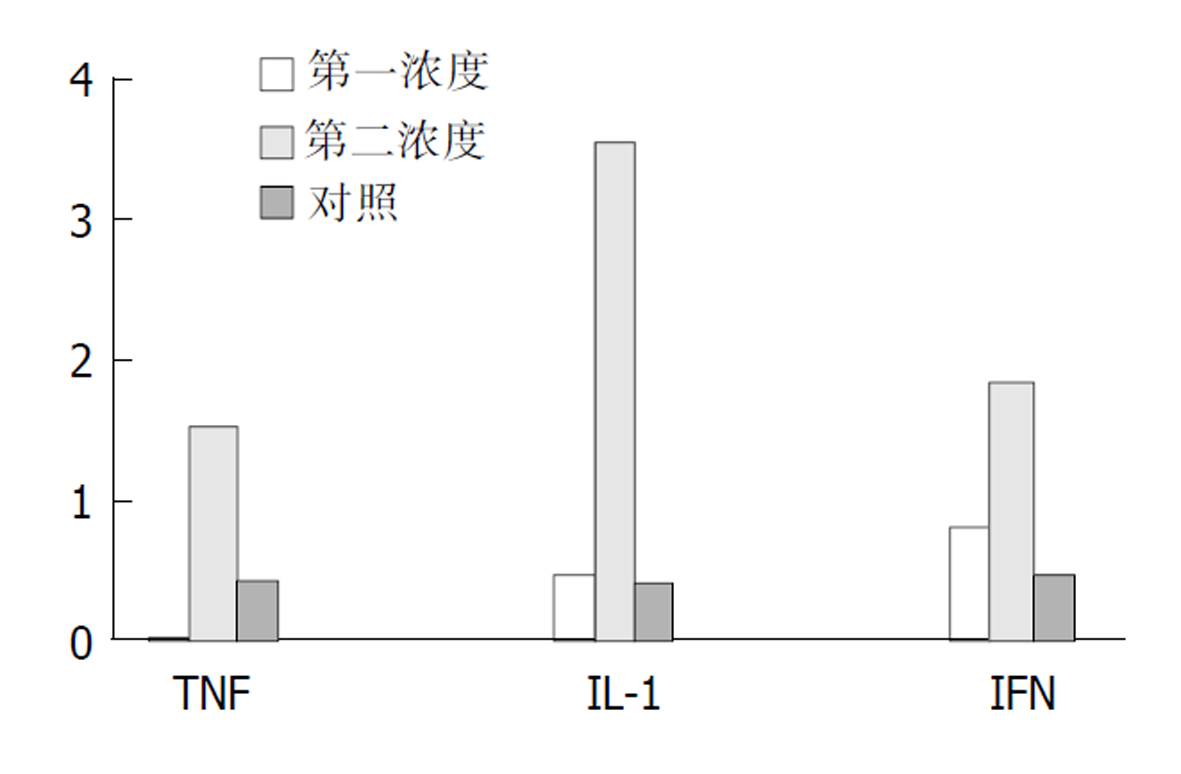
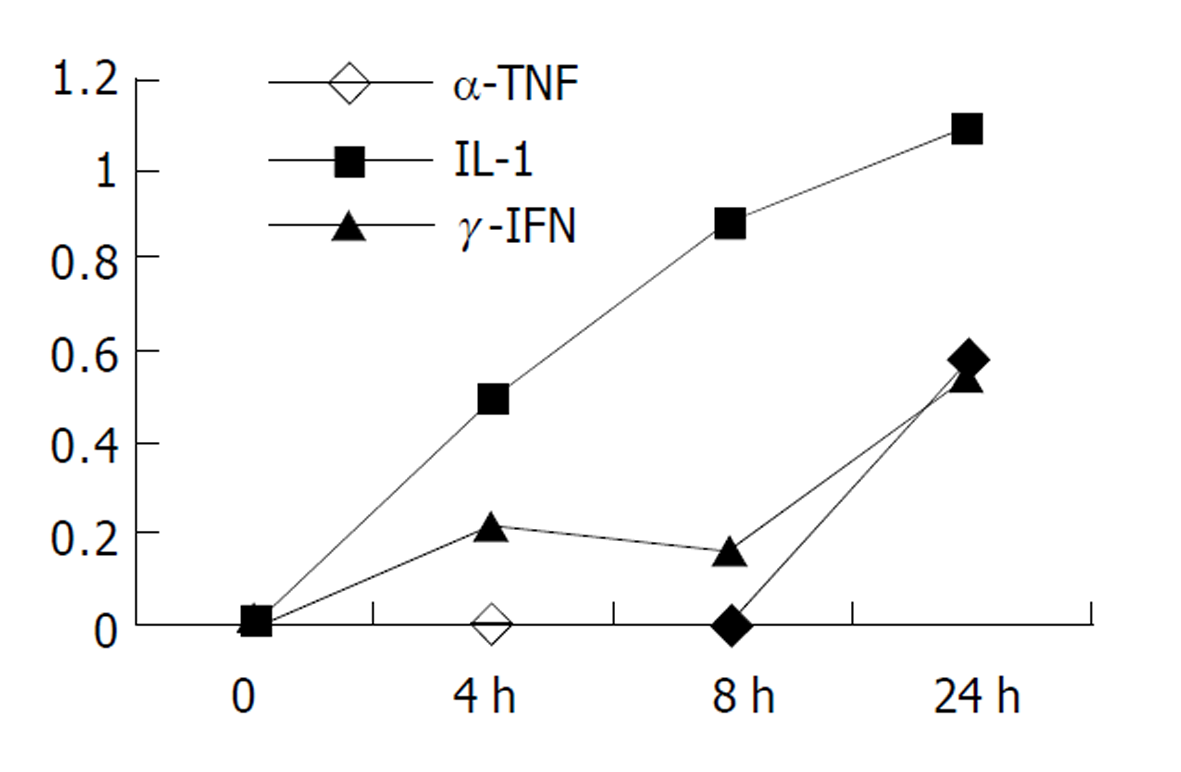
2.2 细胞株培养检测结果 Colo320经α-TNF, γ-IFN, IL-1在不同浓度和不同时间的刺激下可表达IP-10mRNA (图3), 且其mRNA的表达随刺激的浓度和时间的不同而改变, 对照组Colo320在无任何刺激下, 不表达IP-10 mRNA. 同一时间(24 h)不同浓度的刺激下, Colo320细胞株都能随着刺激物α-TNF, IL-1及γ-IFN浓度的增加, IP-10 mRNA的表达量也增加(图4). Colo320细胞株经同一种刺激物在同一浓度不同时间的刺激下能随着刺激时间的延长, IP-10mRNA的表达量也增加(图5).
肠道黏膜上皮不仅成为机体与外界的屏障, 而且是一免疫器官, 大肠黏膜细胞在炎症状态下可产生趋化因子如IL-8, MCP-1等[5]. 本结果表明, 大肠癌细胞在一定的条件下可产生趋化因子IP-10. 原代大肠癌细胞在无任何刺激下, 可自发微弱表达IP-10 mRNA. 在刺激状态下, 从结果可以看出三种刺激因子对大肠癌细胞的刺激均可产生IP-10 mRNA, IP-10 mRNA的表达对IL-1和r-IFN的刺激较敏感. 这种不同的刺激因素对大肠癌细胞趋化因子表达结果影响的不一样, 与其基因调节有关. Roebuck et al [6]等研究认为: 趋化因子表达的调节主要是通过转录因子起作用的, 涉及此方面转录因子有: NF-κB, NF-IL-6, AP-1等, 由于不同转录因子的活化或转录因子在趋化因子(IL-8)基因启动子位置上的不同, 其所起的调节结果就不一样, 因此刺激因素诱导趋化因子的产生表现出细胞类型的选择性或只有特定的刺激剂才能起作用, 故本研究表明对于大肠癌细胞, α-TNF、IL-1, γ-IFN均为其有效的刺激因子, 但产生的趋化因子的量是不同的.
由于原代细胞无法进行较长时间及稳定的研究, 也为了排除原代细胞准备过程中一些间质细胞的存在而影响结果. 本研究采用大肠癌细胞株Colo320进一步研究. 虽然在细胞株的传代过程中可能丢失一些特性, 但本研究显示在γ-IFN等的刺激下仍能表达IP-10 mRNA, 表明其存在表达趋化因子的能力, 因此仍可用于趋化因子IP-10 mRNA表达调节的研究. 研究表明在一定刺激时间和刺激浓度内, 大肠癌细胞株Colo320可表达趋化因子IP-10 mRNA. 表达IP-10 mRNA的能力随刺激时间的延长和刺激浓度的增加而增强, 从而进一步说明了大肠癌细胞存在表达趋化因子的能力并能随外界环境刺激因子的变化而变化.
肿瘤组织中存在着巨噬细胞, T细胞及NK细胞等免疫细胞的浸润, 虽然其起始因素目前还不十分明朗, 但显而易见, 这些浸润的免疫细胞能分泌γ-IFN, α-TNF及IL-1等等, 这些刺激因素的存在必然影响大肠癌细胞或其间质细胞的分泌活动. 即刺激了大肠癌细胞或间质细胞趋化因子的表达, 而趋化因子的表达又吸引了免疫细胞到肿瘤局部, 增加了局部γ-IFN, α-TNF或IL-1的浓度, 从而形成循环, 扩大了γ-IFN等刺激因子和趋化因子的表达, 增加其生物活性, 也增加了其对肿瘤生物学行为的影响.
| 1. | Kunkel EJ, Butcher EC. Chemokines and the tissue-specific migration of lymphocytes. Immunity. 2002;16:1-4. [DOI] |
| 2. | Baggiolini M. Chemokines in pathology and medicine. J Intern Med. 2001;250:91-104. [DOI] |
| 3. | Pellegrino A, Vacca A, Scavelli C, Dammacco F. Chemokines and tumors. Recenti Prog Med. 2002;93:642-654. [PubMed] |
| 4. | Borish LC, Steinke JW. Cytokines and chemokines. J Allergy Clin Immunol. 2003;111:s460-475. [DOI] |
| 5. | Stadnyk AW. Intestinal epithelial cells as a source of inflammatory cytokines and chemokines. Can J Gastroenterol. 2002;16:241-246. [DOI] |
| 6. | Roebuck KA, Carpenter LR, Lakshminarayanan V, Page SM, Moy JN, Thomas LL. Stimulus-specific regulation of chemokine expression involves differential activation of the redox-responsive transcription factors AP-1 and NF-kappaB. J Leukoc Biol. 1999;65:291-298. [DOI] |