修回日期: 2002-07-10
接受日期: 2002-08-16
在线出版日期: 2003-11-15
研究PTTG和c-myc基因表达在原发性肝细胞癌(HCC)发生发展中的作用.
应用原位杂交(DNA-RNA)技术与免疫组化SP法分别检测61例原发性肝细胞癌及癌旁肝组织中PTTG mRNA和PTTG蛋白及c-myc mRNA和c-myc蛋白的表达.
在原发性肝细胞癌(HCC)中, PTTG mRNA和PTTG蛋白阳性细胞呈弥漫性、小巢状或散在分布, 在胞质内呈全浆型、膜下型表达. PTTG mRNA 和PTTG蛋白在HCC中表达率分别为72.1% (44/61)和78.7% (48/61), 在癌旁肝组织中分别为93.4% (57/61)和91.8% (56/61), 在HCC中表达明显低于癌旁肝组织(P<0.005, P<0.05). 相关性检验显示癌及癌旁PTTG基因表达与c-myc基因表达呈正相关(P<0.005).
PTTG基因过度表达参与了肝细胞癌发生发展, 过度表达的 PTTG可能通过激活癌基因c-myc来参与肝细胞恶性转化和肝细胞癌的发生发展过程.
引文著录: 金中元, 程瑞雪, 郑长黎, 郑晖. 原发性肝细胞癌中PTTG和c-myc基因表达的研究. 世界华人消化杂志 2003; 11(11): 1677-1681
Revised: July 10, 2002
Accepted: August 16, 2002
Published online: November 15, 2003
To investigate the relationship between expressions of PTTG and c-myc genes and oncogenesis in human hepatocellular carcinomas(HCC).
In situ hybridization (DNA-RNA) and immunohistochemistry (SP method) methods were used to detect the expressions of PTTG and c-myc genes in 61 cases of human hepatocellular carcinomas.
The distributions of positive cells of PTTG mRNA and PTTG protein in HCC were diffuse, aggregate or scattered. The positive stainings of PTTG mRNA and PTTG protein were plasma and submembrane types. The positive rates of PTTG mRNA and PTTG protein were 72.1% (44/61) and 78.7% (48/61) in HCC, and 93.4% (57/61) and 91.8% (56/61) in pericarcinomatous liver tissues. The expressions of PTTG mRNA and PTTG protein in HCC were significantly lower than those in paracancerous tissues (P<0.005, P<0.05). The expression of PTTG gene was significantly correlated with that of c-myc gene (P<0.005).
Overexpression of PTTG is related to human hepatocellular carcinogenesis. C-myc gene activated by PTTG protein may play an important role in hepatocellular transformation and carcinogenesis.
- Citation: Jin ZY, Cheng RX, Zheng CL, Zheng H. Expression of PTTG and c-myc gene in human primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2003; 11(11): 1677-1681
- URL: https://www.wjgnet.com/1009-3079/full/v11/i11/1677.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i11.1677
癌基因异常激活和表达在HCC发生发展中的作用越来越受到人们的重视. 近年来已先后发现在人肝细胞癌(HCC)中, 有c-myc等多种原癌基因的激活及p53等抑癌基因的失活. 新近报道的新型癌基因垂体肿瘤转化基因(PTTG), 其高表达在促进细胞增生, 转化及肿瘤发生中有十分重要的作用[1-15], 且确定c-myc为PTTG下游的一个主要靶基因[16], 而c-myc基因过度表达与包括HCC在内的多种肿瘤的发生有关[17-26].
目前有关肝细胞癌中PTTG基因表达, 及其与c-myc基因表达相关性的研究, 在国内外尚未见文献报道. 本文利用连续切片免疫组化及原位杂交技术同步检测PTTG和c-myc基因在HCC与癌旁肝组织中的表达, 旨在探讨PTTG 和c-myc基因表达与HCC发生发展的关系.
61例原发性肝细胞癌及相应癌旁肝组织均为1998-2001年中南大学湘雅医院外科手术切除标本, 常规石蜡包埋, 切片, 病理诊断为原发性HCC, 均附癌旁肝组织. 病理分级根据Edmondson标准: 其中I级6例, II级28例, III级19例, IV级8例. 61例癌旁肝组织中, 合并肝硬变48例, 不典型增生24例. 山羊抗PTTG多克隆抗体及小鼠抗c-myc单克隆抗体购自美国Santa Cruz公司, SP试剂盒购自北京中山生物技术有限公司. PTTG mRNA及c-myc mRNA原位杂交试剂盒均为武汉博士德生物工程有限公司产品.
免疫组织化学SP法: 石蜡切片常规脱蜡至水, 3% H2O2甲醇阻断30 min, 微波抗原修复, 然后按SP试剂说明书进行, 用已知阳性标本和PBS分别作阳性、阴性对照, 用意外死亡(生前体健)经HE染色切片诊断证实无病变的成人肝脏标本作正常对照; DNA-RNA原位杂交方法: 步骤按原位杂交试剂说明书进行, 用已知阳性标本和预杂交液分别作阳性、阴性对照, 用意外死亡(生前体健)经HE染色切片诊断证实无病变的成人肝脏标本作正常对照. 免疫组化和原位杂交结果均以细胞质和/或核内出现棕黄色颗粒为阳性, 随机观察5个高倍视野, 每个视野计数100个细胞, 各视野中阳性细胞数的平均百分数作为该切片的阳性细胞百分比进行计分; 染色强度以多数阳性细胞呈现的染色特征为标准计分. 最后以阳性细胞的百分比和染色强度计分之和所得的总分进行结果判定, 分为4级(-, +, ++, +++).
统计学处理 采用x2检验及相关分析. 数据用SPSS 11.0统计软件包进行处理. 以P<0.05确定为有统计学意义.
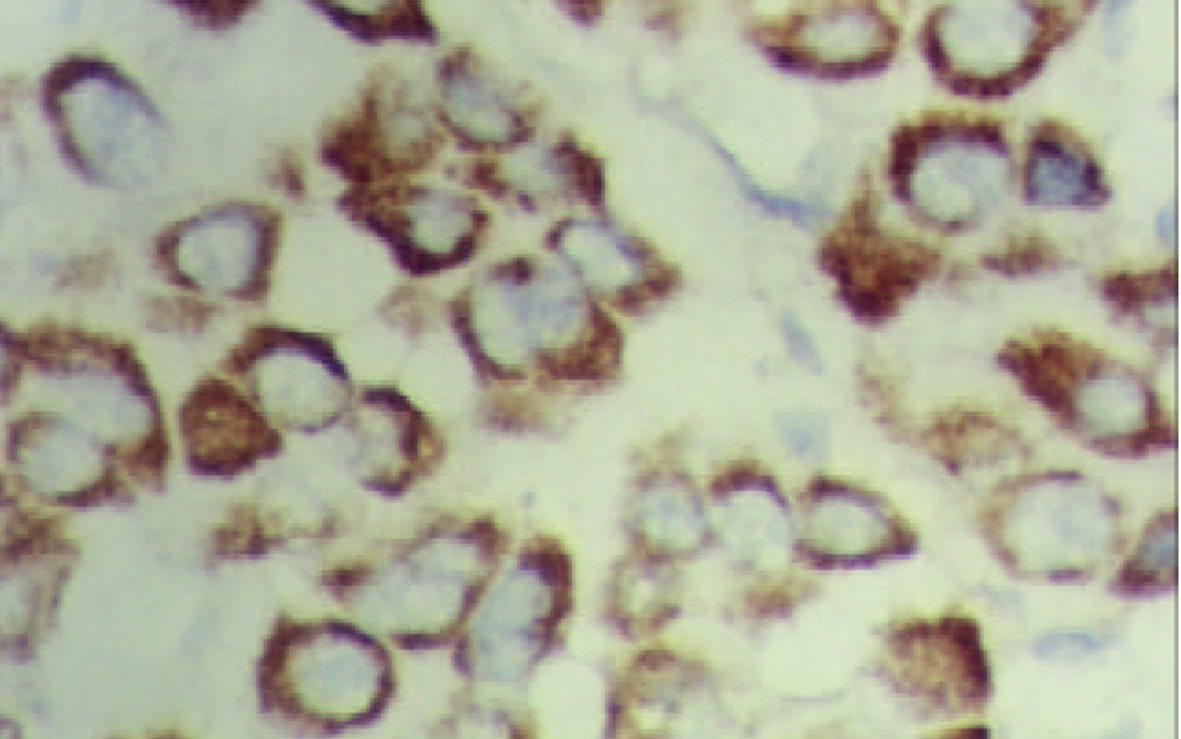
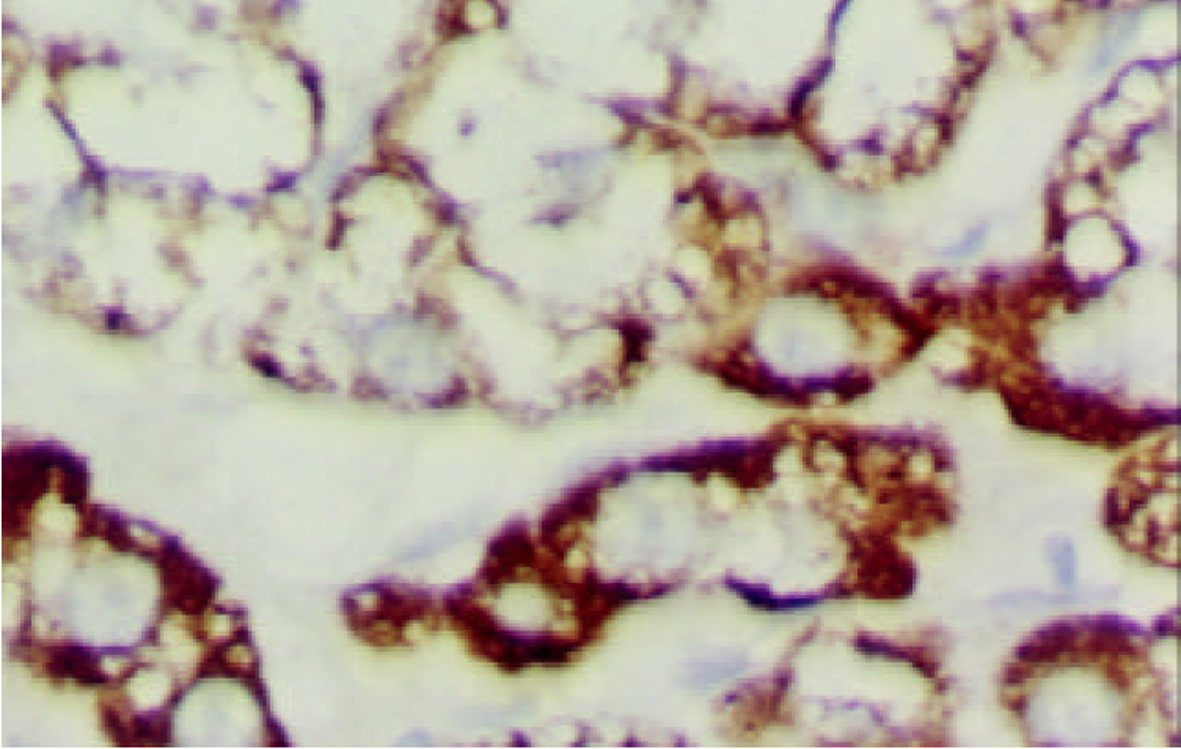
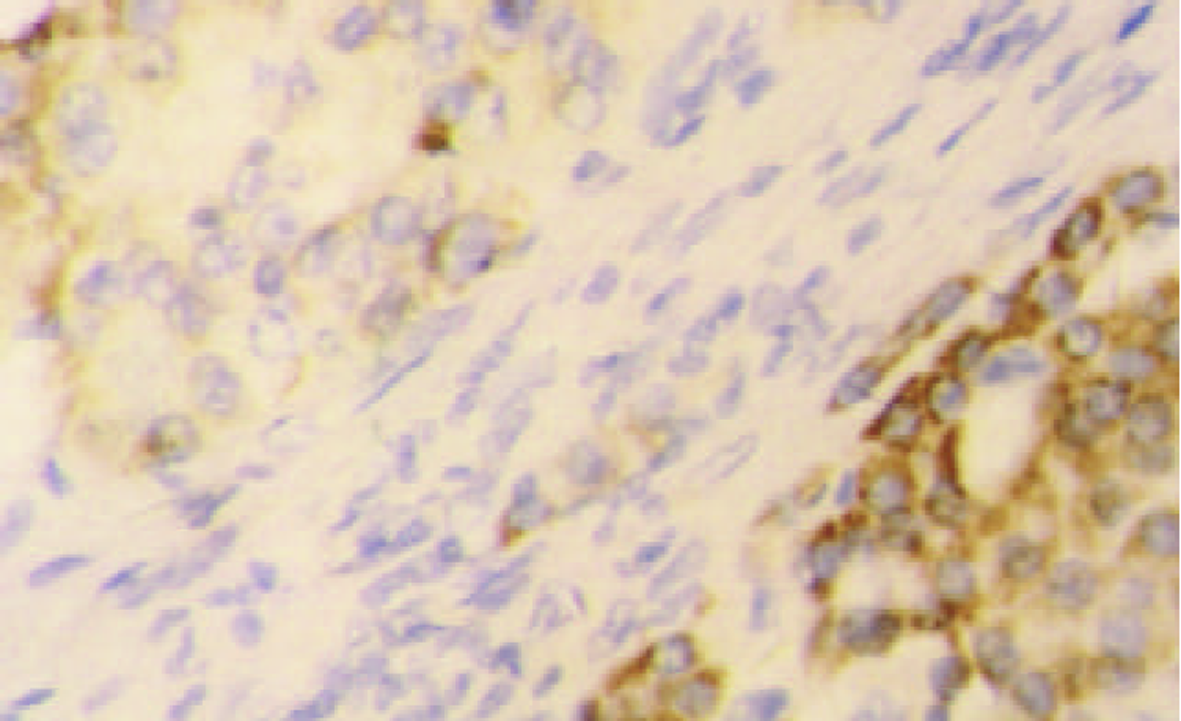
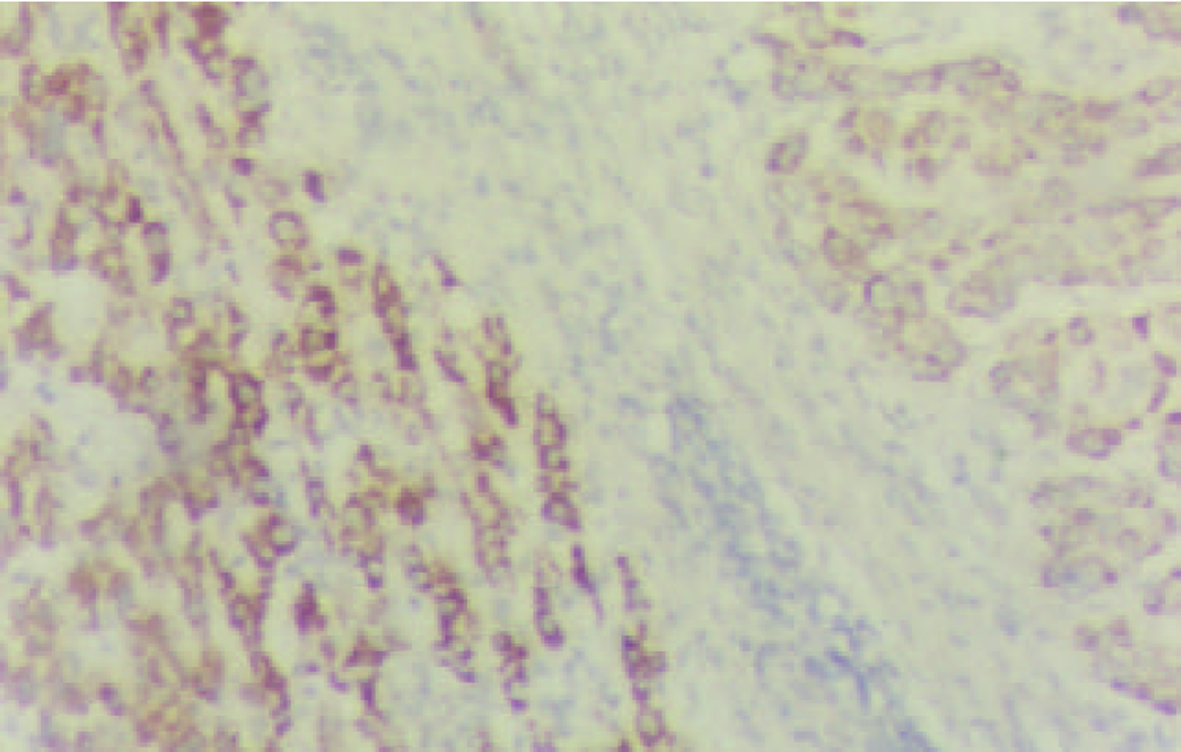
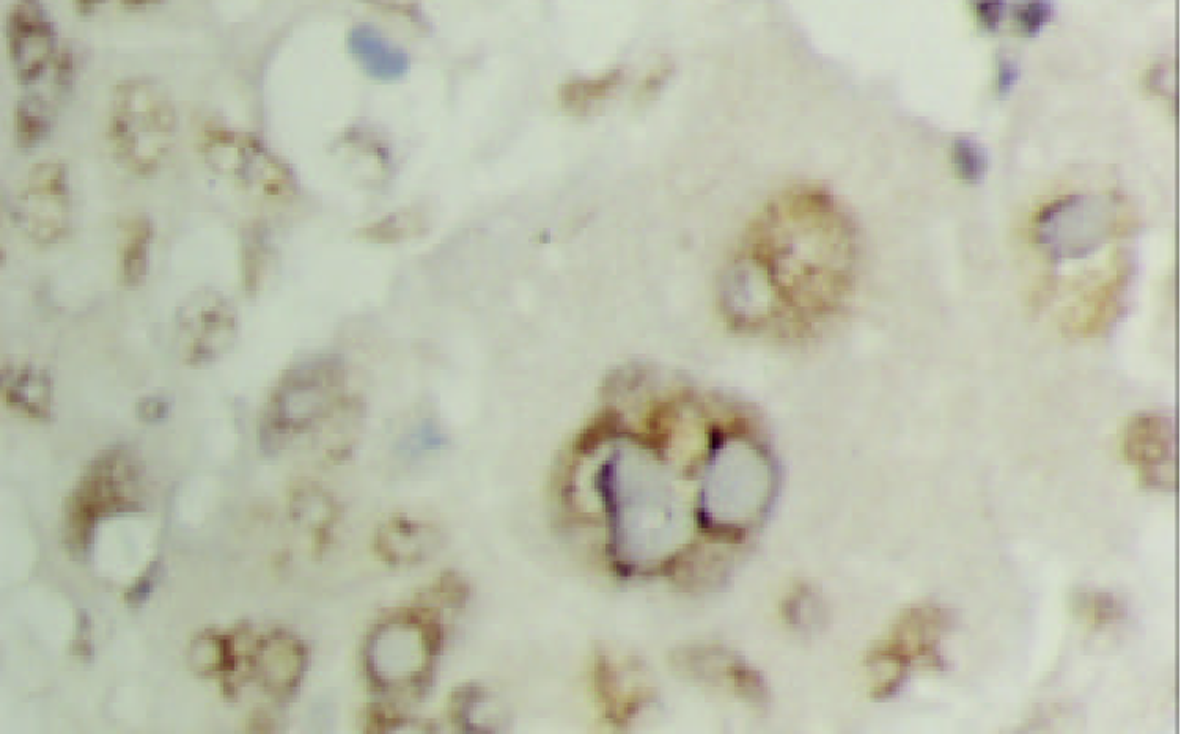
PTTG mRNA阳性信号以胞质型为主, 罕见核阳性. 癌组织中阳性细胞呈弥漫性、小巢状或散在分布. 在胞质内PTTG mRNA主要呈弥漫性全浆分布, 有的呈包涵体状, 透明细胞性肝癌细胞中分布于胞膜下(图1, 图2, 图3); 癌旁组织中PTTG mRNA主要呈弥漫性全浆分布. 61例HCC癌组织PTTG mRNA阳性44例, 阳性率为72.1%, 癌旁组织中阳性57例, 阳性率为93.4%, 后者显著高于前者(P<0.005). 癌旁肝组织中PTTG mRNA表达强度明显高于癌组织(表1, 图4), (P<0.005). 9例正常对照PTTG mRNA呈阴性表达. PTTG 蛋白表达形式似PTTG mRNA, 在癌组织中以胞质型为主, 阳性细胞的分布呈弥漫性、小巢状或散在分布, 在胞质内也呈全浆型、膜下型表达(图5); 癌旁肝组织中PTTG 蛋白呈弥漫性全浆表达. 61例HCC癌组织PTTG 蛋白阳性48例, 阳性率为78.7%, 癌旁组织中阳性56例, 阳性率为91.8%, 后者显著高于前者(P<0.05). 癌旁肝组织中PTTG蛋白阳性强度明显高于癌组织(表1, 图6), (P<0.005). 9例正常对照阴性. 进一步做相关性分析发现在HCC中, PTTG mRNA和PTTG蛋白表达呈明显正相关(r = 0.569, P<0.005).
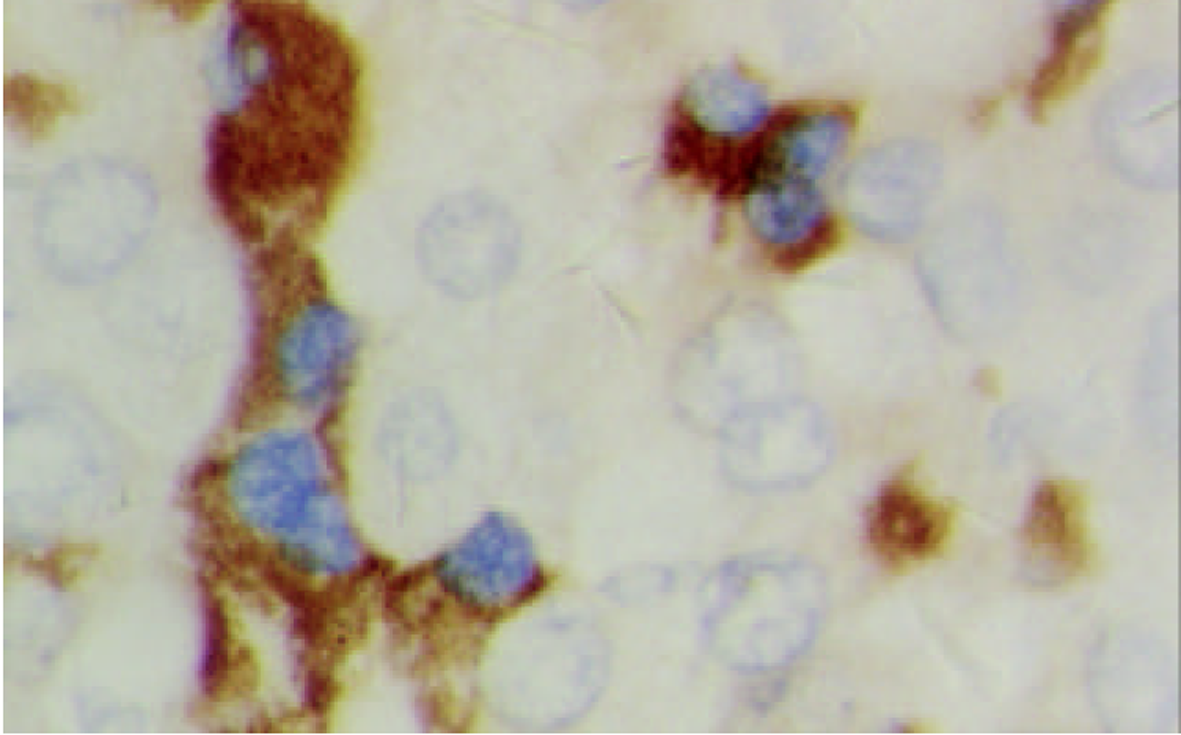
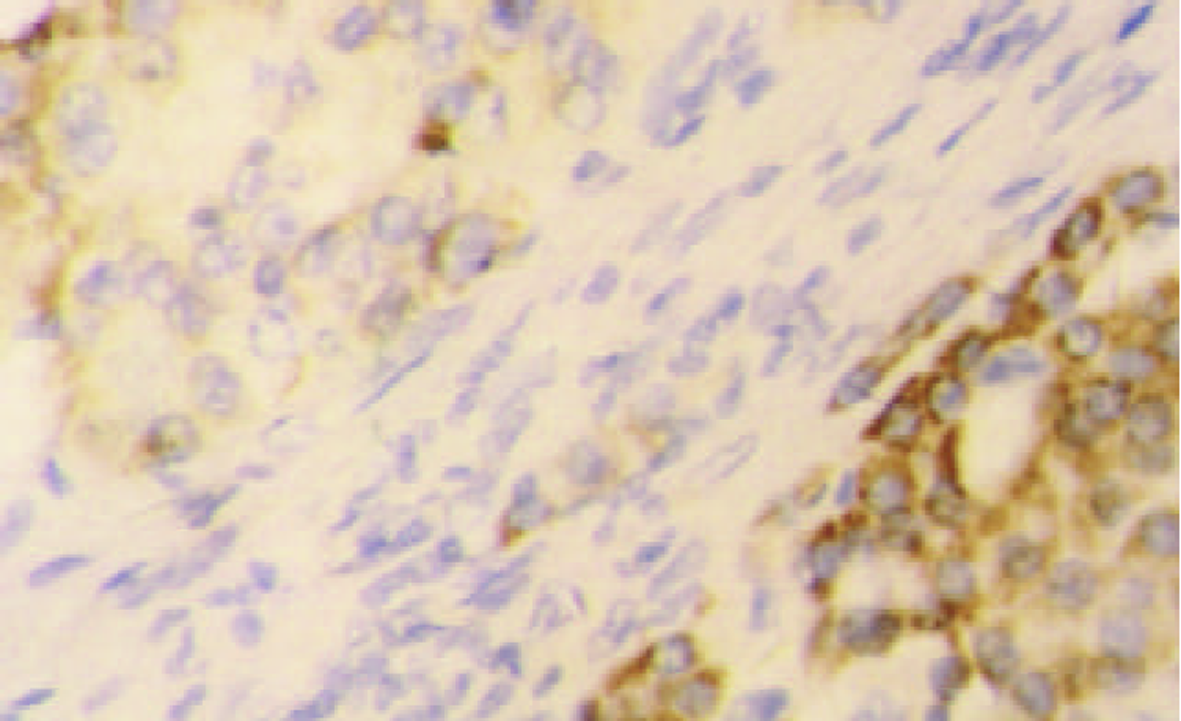
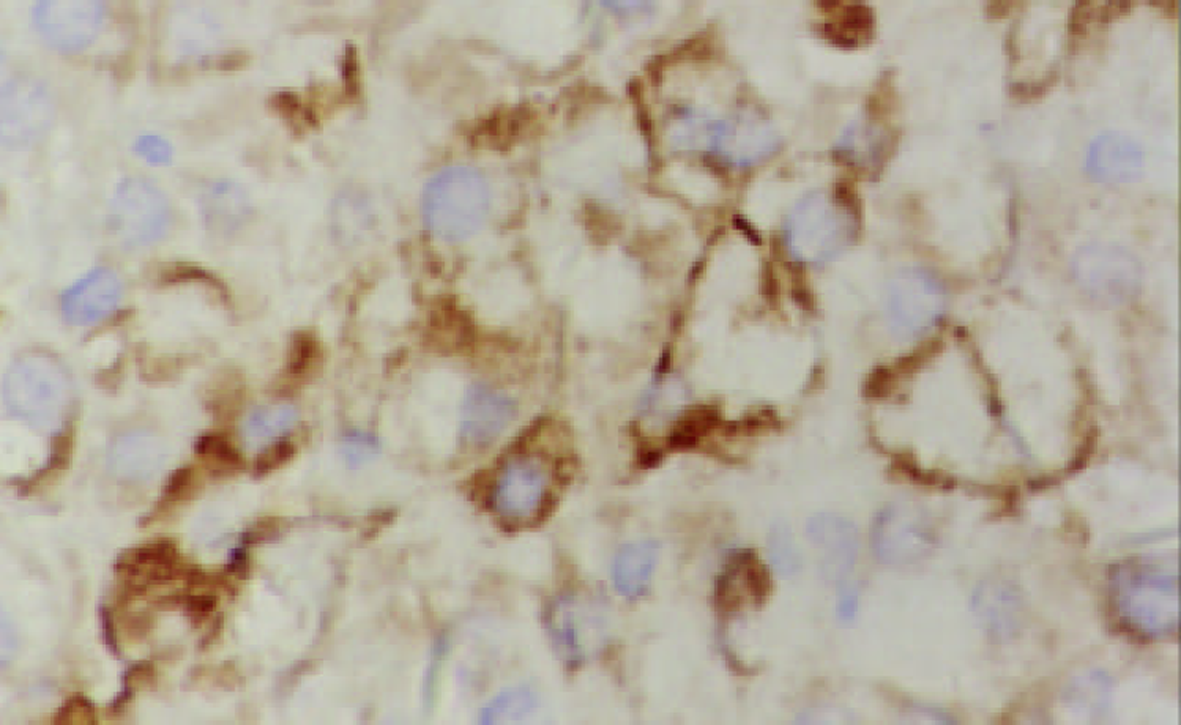
c-myc mRNA主要呈核型表达, 少数呈核浆型(图7). 61例HCC癌组织c-myc mRNA阳性45例, 阳性率为73.8%, 癌旁组织中阳性54例, 阳性率为88.5%, 后者显著高于前者(P<0.05). 9例正常对照呈阴性表达. c-myc蛋白阳性信号主要分布于细胞质, 少见核阳性(图8). 61例HCC癌组织c-myc蛋白阳性41例, 阳性率为67.2%, 癌旁组织中阳性51例, 阳性率为83.6%, 后者显著高于前者(P<0.05). 9例正常对照未见阳性表达.
在61例HCC中, PTTG mRNA和c-myc mRNA表达同时阳性者为39例, 同时阴性者为11例, 二者表达一致率占82.0%, 呈明显正相关(表2) (r = 0.544, P<0.005); PTTG 蛋白和c-myc 蛋白表达同时阳性者为38例, 同时阴性者为10例, 二者表达一致率占78.7%, 呈明显正相关(表3) (r = 0.489, P<0.005).
| PTTG mRNA | c-myc mRNA | 合计 | |
| 阳性 | 阴性 | ||
| 阳性 | 39 | 5 | 44 |
| 阴性 | 6 | 11 | 17 |
| 合计 | 45 | 16 | 61 |
| PTTG 蛋白 | c-myc 蛋白 | 合计 | |
| 阳性 | 阴性 | ||
| 阳性 | 38 | 10 | 48 |
| 阴性 | 3 | 10 | 13 |
| 合计 | 41 | 20 | 61 |
PTTG mRNA和PTTG蛋白表达强度均与HCC的病理分级无关(P>0.05), PTTG mRNA和PTTG蛋白在不同年龄组HCC间差异亦无显著性(P>0.05).
PTTG基因在大多数正常成人组织, 如结肠、垂体、肾脏、末梢血白细胞等, 只有弱表达甚至检测不到, 而在胚胎肝、睾丸、胸腺中有高表达[3-5]; 在垂体肿瘤[27], 大肠癌[28], 乳腺癌及肺癌[29]的研究中, PTTG均呈高表达. 但对PTTG基因在HCC及癌旁肝组织中表达的研究国内外尚未见文献报道, 且以往对PTTG基因表达的研究也仅限于其表达率及其在细胞内的定位, 而未描述PTTG基因的表达形态. 本实验显示: PTTG mRNA和PTTG蛋白在HCC中均呈明显高表达, 其阳性细胞呈弥漫性、小巢状或散在分布, 在细胞内阳性染色以胞质型为主, 呈弥漫性分布于细胞质, 有的呈包涵体状, 透明细胞性肝癌细胞中呈膜下型染色, 罕见核阳性. PTTG mRNA和PTTG蛋白在癌旁肝组织亦呈明显高表达, 阳性细胞呈弥漫性分布, 阳性染色呈全浆型, 其阳性信号强度比肝癌细胞强.
据文献[30]报道, PTTG基因表达水平与细胞周期密切相关, 在有丝分裂期表达水平最高, 故PTTG基因在含有高度增生细胞的组织, 如睾丸、胚胎肝中有高表达. 中国人肝癌发生与肝炎病毒感染-肝硬化增生-不典型增生-癌变发展过程密切相关, 本实验利用的HCC组织绝大多数癌旁组织具有肝硬化, 或在肝硬化基础上有不典型增生, PTTG mRNA和PTTG蛋白表达在癌旁阳性率要高于肝细胞癌, 这一结果表明, PTTG基因高水平表达可能与肝硬化结节中的细胞增生和不典型增生有关. PTTG基因表达的阳性信号强度在癌与癌旁肝组织中有差异, 癌组织中信号较弱, 癌旁组织信号较强, 且癌组织中PTTG mRNA和PTTG蛋白表达强度与HCC的分化程度无关, 提示PTTG基因的过度表达可能是HCC发生中的早期事件, 涉及癌变的起始过程, 或者是这些癌旁肝细胞虽表型尚无异常, 但实际上已处于癌前状态. 这与Pei et al [1]研究发现PTTG能引起细胞转化和肿瘤形成的结果相符, 过度表达的PTTG可能参与了肝细胞癌的发生发展.
MAPK级联反应在调节PTTG功能中有十分重要的作用. MAPK级联反应是细胞信号转导的重要途径, 许多生长因子、细胞因子和多种致癌因子通过Ras/Raf/MAPK途径, 将胞质内信号导入核内, 参与细胞生长、发育及分化等多种生理过程. Pei et al [31,32]研究发现, MAPK在Ser162将PTTG蛋白磷酸化, MEK1(MAPKK)通过SH3结合位点(PGLP)与PTTG直接作用. MAPK磷酸化及MEK1与PTTG相互作用不仅能增强PTTG蛋白反式激活作用, 也能促进PTTG蛋白移位至核内. 在核内, PTTG蛋白与泛转录激活因子USF1形成复合物, 在转录起始位点附近与c-myc启动子结合, 从而激活c-myc转录. 本研究显示, PTTG mRNA和PTTG蛋白阳性的HCC及癌旁肝组织中, 有相当部分c-myc mRNA和c-myc蛋白表达也阳性; 而PTTG mRNA和PTTG蛋白阴性的HCC及癌旁肝组织中, 有相当部分c-myc mRNA和c-myc蛋白表达也阴性. 表明PTTG mRNA过表达的蛋白质可能通过反式激活作用激活c-myc癌基因来参与细胞转化和肝细胞癌发生. PTTG与c-myc共同作用引起肝细胞癌发生的详细机制还有待进一步研究.
| 1. | Pei L, Melmed S. Isolation and characterization of a pituitary tumor-transforming gene (PTTG). Mol Endocrinol. 1997;11:433-441. [PubMed] [DOI] |
| 2. | Pei L. Genomic organization and identification of an enhancer element containing binding sites for multiple proteins in rat pituitary tumor-transforming gene. J Biol Chem. 1998;273:5219-5225. [DOI] |
| 3. | Dominguez A, Ramos-Morales F, Romero F, Rios RM, Dreyfus F, Tortolero M, Pintor-Toro JA. Hpttg, a human homologue of rat pttg, is overexpressed in hematopoietic neoplasms. Evidence for a transcriptional activation function of hPTTG. Oncogene. 1998;17:2187-2193. [PubMed] [DOI] |
| 4. | Zhang X, Horwitz GA, Prezant TR, Valentini A, Nakashima M, Bronstein MD, Melmed S. Structure, expression, and function of human pituitary tumor-transforming gene (PTTG). Mol Endocrinol. 1999;13:156-166. [PubMed] [DOI] |
| 5. | Pei L. Pitutary tumor-transforming gene protein associates with ribosomal protein S10 and a noval human homologue of DnaJ in testicular cells. J Biol Chem. 1999;274:3151-3158. [PubMed] [DOI] |
| 6. | Prezant TR, Kadioglu P, Melmed S. An intronless homolog of human proto-oncogene hPTTG is expressed in pituitary tumors: evidence for hPTTG family. J Clin Endocrinol Metab. 1999;84:1149-1152. [PubMed] [DOI] |
| 7. | Lee IA, Seong C, Choe IS. Cloning and expression of human cDNA encoding human homologue of pituitary tumor transforming gene. Biochem Mol Biol Int. 1999;47:891-897. [DOI] |
| 8. | Zou H, McGarry TJ, Bernal T, Kirschner MW. Identification of a vertebrate sister-chromatid separation inhibitor involved in transformation and tumorigenesis. Science. 1999;285:418-422. [DOI] |
| 9. | McCabe CJ, Gittoes NJ. PTTG-α new pituitary tumor transforming gene. J Endocrinol. 1999;162:163-166. [PubMed] [DOI] |
| 10. | Heaney AP, Horwitz GA, Wang Z, Singson R, Melmed S. Early involvement of estrogen-induced pituitary tumor transforming gene and fibroblast growth factor expression in prolactinoma. Nat Med. 1999;5:1317-1321. [DOI] |
| 11. | Kakar SS. Molecular cloning, genomic organization, and identification of the promoter for the human pituitary tumor transforming gene (PTTG). Gene. 1999;240:317-324. [DOI] |
| 12. | Wang Z, Melmed S. Pituitary tumor transforming gene (PTTG) transforming and transactivation activity. J Biol Chem. 2000;275:7459-7461. [PubMed] |
| 13. | Chen L, Puri R, Lefkowitz EJ, Kakar SS. Identification of the human pituitary tumor transforming gene (hPTTG) family: molecular structure, expression, and chromosomal localization. Gene. 2000;248:41-50. [DOI] |
| 14. | Heaney AP, Melmed S. Pituitary tumor transforming gene: a novel factor in pituitary tumor formation. Baillieres Best Pract Res Clin Endocrinol Metab. 1999;13:367-380. [DOI] |
| 15. | Yu R, Ren SG, Horwitz GA, Wang Z, Melmed S. Pituitary tumor transforming gene (PTTG) regulates placental JEG-3 cell divition and survival: evidence from live cell imaging. Mol Endocrinol. 2000;14:1137-1146. [DOI] |
| 16. | Pei L. Identification of c-myc as a down-stream target for pituitary tumor-transforming gene. J Biol Chem. 2001;276:8484-8491. [DOI] |
| 17. | Schleger C, Verbeke C, Hildenbrand R, Zentgraf H, Bleyl U. C-myc activation in primary and metastatic ductal adenocarcinoma of the pancreas: incidence, mechanisms, and clinical significance. Mod Pathol. 2002;15:462-469. [DOI] |
| 18. | Qian J, Hirasawa K, Bostwick DG, Bergstralh EJ, Slezak JM, Anderl KL, Borell TJ, Lieber MM, Jenkins RB. Loss of p53 and c-myc overrepresentation in stage T(2-3)N(1-3)M(0) prostate cancer are potential markers for cancer progression. Mod Pathol. 2002;15:35-44. [PubMed] |
| 19. | Naidu R, Wahab NA, Yadav MM, Kutty MK. Expression and amplification of cyclin D1 in primary breast carcinomas: relationship with histopathological types and clinico-pathological parameters. Oncol Rep. 2002;9:409-416. [DOI] |
| 20. | Avet-Loiseau H, Gerson F, Magrangeas F, Minvielle S, Harousseau JL, Bataille R. Rearrangements of the c-myc oncogene are present in 15% of primary human multiple myeloma tumors. Blood. 2001;98:3082-3086. [DOI] |
| 21. | Rummukainen JK, Salminen T, Lundin J, Joensuu H, Isola JJ. Amplification of c-myc oncogene by chromogenic and fluorescence in situ hybridization in archival breast cancer tissue array samples. Lab Invest. 2001;81:1545-1551. [DOI] |
| 22. | Stewart DA, Xu X, Thomas SD, Miller DM. Acridine-modified, clamp-forming antisense oligonucleotides synergize with cisplatin to inhibit c-myc expression and B16-F0 tumor progression. Nucleic Acids Res. 2002;30:2565-2574. [DOI] |
| 23. | Carroll JS, Swarbrick A, Musgrove EA, Sutherland RL. Mechanisms of growth arrest by c-myc antisense oligonucleotides in MCF-7 breast cancer cells: implications for the antiproliferative effects of antiestrogens. Cancer Res. 2002;62:3126-3131. [PubMed] |
| 24. | Hoffman B, Amanullah A, Shafarenko M, Liebermann DA. The proto-oncogene c-myc in hematopoietic development and leukemogenesis. Oncogene. 2002;21:3414-3421. [PubMed] |
| 25. | Vijayalakshmi N, Selvaluxmi G, Mahji U, Rajkumar T. C-myc oncoprotein expression and prognosis in patients with carcinoma of the cervix: an immunohistochemical study. Eur J Gynaecol Oncol. 2002;23:135-138. [PubMed] |
| 26. | Battaglino R, Kim D, Fu J, Vaage B, Fu XY, Stashenko P. C-myc is required for osteoclast differentiation. J Bone Miner Res. 2002;17:763-773. [DOI] |
| 27. | Zhang X, Horwitz GA, Heaney AP, Nakashima M, Prezant TR, Bronstein MD, Melmed S. Pituitary tumor transforming gene(PTTG) expression in pituitary adenomas. J Clin Endocrinol Metab. 1999;84:761-767. [DOI] |
| 28. | Heaney AP, Singson R, McCabe CJ, Nelson V, Nakashima M, Melmed S. Expression of pituitary-tumor transforming gene in colorectal tumours. Lancet. 2000;355:716-719. [DOI] |
| 29. | Saez C, Japon MA, Ramos-Morales F, Romero F, Segura DI, Tortolero M, Pintor-Toro JA. Hpttg is over-expressed in pituitary adenomas and other primary epithelial neoplasias. Oncogene. 1999;18:5473-5476. [DOI] |
| 30. | Ramos-Morales F, Dominguez A, Romero F, Luna R, Multon MC, Pintor-Toro JA, Tortolero M. Cell cycle regulated expression and phosphorylation of hpttg proto-oncogene product. Oncogene. 2000;19:403-409. [DOI] |
| 31. | Chien W, Pei L. A novel binding factor facilitates nuclear translocation and transcriptional activation function of the pituitary tumor-transforming gene product. J Biol Chem. 2000;275:19422-19427. [DOI] |
| 32. | Pei L. Activation of mitogen-activated protein kinase cascade regulates pituitary tumor-transforming gene transactivation function. J Biol Chem. 2000;275:31191-31198. [DOI] |