修回日期: 2003-03-20
接受日期: 2003-04-03
在线出版日期: 2003-10-15
研究丹参对TGFβ1刺激的NIH/3T3成纤维细胞功能的影响.
将正常大鼠进行丹参灌胃, 分离含药血清, 温育TGFβ1刺激的NIH/3T3成纤维细胞.RT-PCR法检测c-fos基因表达, Gel mobility shift assay法检测AP1蛋白的结合活性.
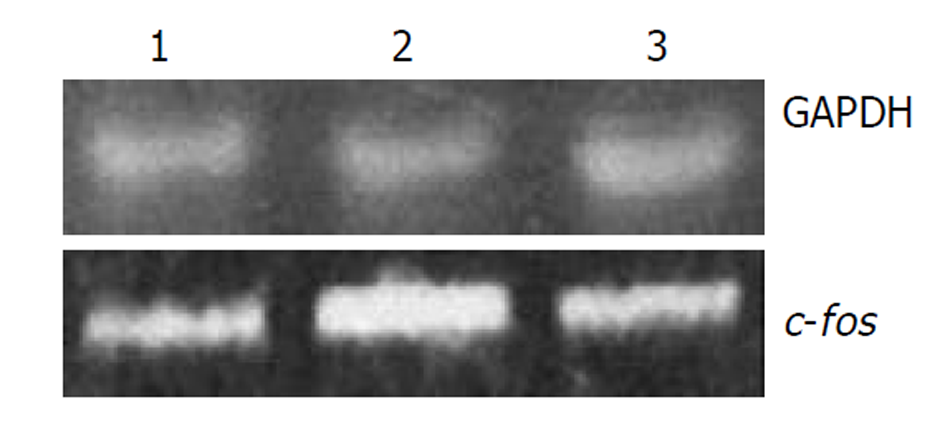
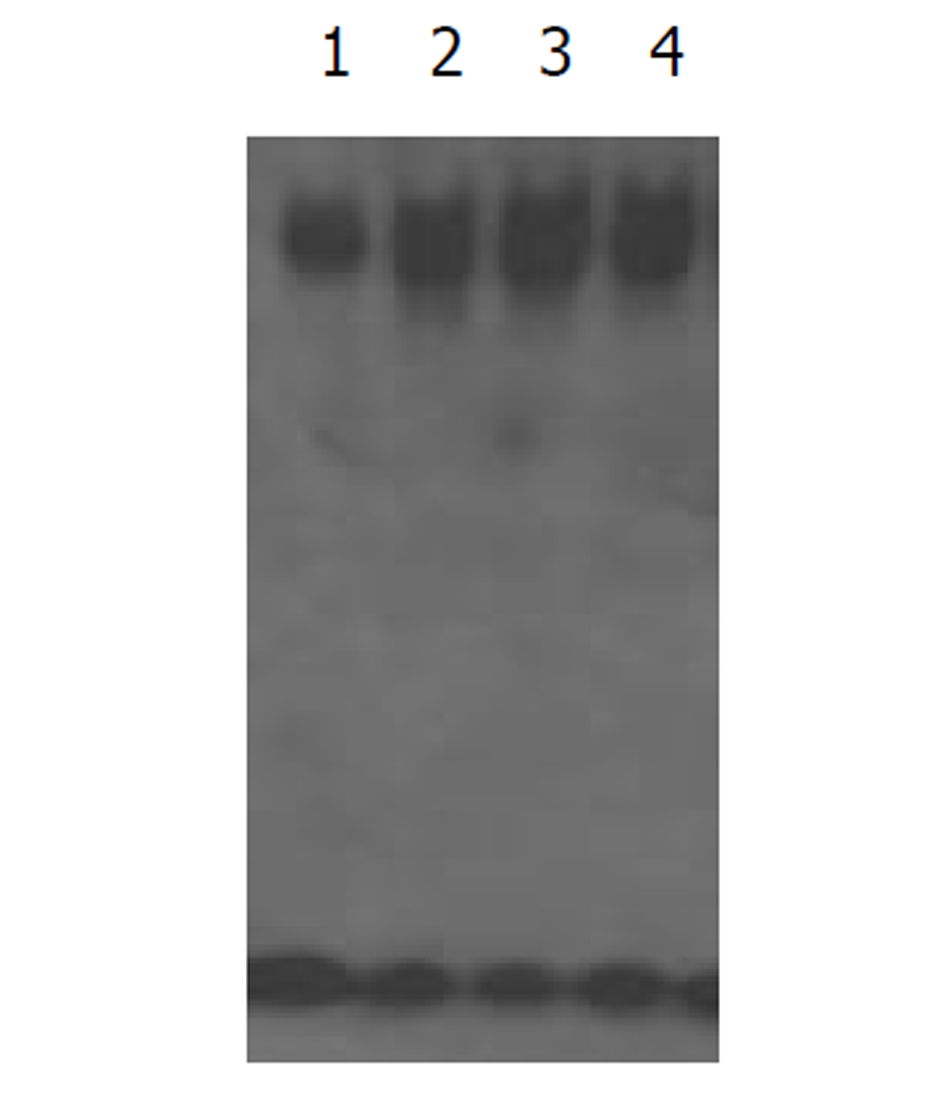
经TGFβ1刺激后, 细胞c-fos mRNA表达及AP1蛋白结合活性明显增强, 丹参含药血清可分别抑制由TGFβ1引起的细胞c-fos mRNA表达及AP1蛋白结合活性的增强.
丹参可以抑制TGFβ1刺激的NIH/3T3成纤维细胞中的c-fos基因表达及AP1蛋白结合活性.
引文著录: 胡旭东, 王晓玲, 童普德, 吴小江, 刘平. 丹参对TGF-β1刺激的NIH/3T3细胞c-fos mRNA表达和AP1蛋白结合活性的影响. 世界华人消化杂志 2003; 11(10): 1634-1636
Revised: March 20, 2003
Accepted: April 3, 2003
Published online: October 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(10): 1634-1636
- URL: https://www.wjgnet.com/1009-3079/full/v11/i10/1634.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i10.1634
正常情况下, 成纤维细胞中胶原蛋白处于合成代谢和分解代谢的动态平衡中.在某些条件诱导下, 导致合成代谢大于分解代谢, 造成胶原蛋白(其中以I型胶原为主)过度增生沉积于细胞间质中而发生纤维化. 这是心脏、肝脏、肾脏等各种脏器发生纤维化的细胞学基础.纤维化阶段是抑制和逆转疾病进一步发展的关键时期, 也是药物介入的最佳时期, 因此, 此阶段常作为治疗学上的研究对象和药物作用的关键环节.
在纤维化的起始阶段, 各种始动因素促使多种细胞因子的释放, 其中转化生长因子β1 (tansforming growth factor β1, TGFβ1)是目前所知最强大的促胶原生成因子, 在各种纤维化模型中, TGFβ1 mRNA主要定位在纤维化局部区域. TGFβ1对胶原基因表达的调节有一部分直接发生在转录水平上, TGFβ1可使I型胶原α1和α2链的转录速率分别增加2-3和4倍, 他通过诱导细胞核内立早基因(immediate early genes)内如c-fos与c-jun的表达增加转录调节因子(如AP1、NF1等), 并通过增强转录调节因子AP1、NF1等与响应顺式作用元件的结合活性, 使胶原基因的启动子活性增强而促进胶原的合成.在小鼠、大鼠及人胶原基因的启动子上均有TGFβ1的作用位点[2,11]; 其中I型胶原α2链(COL1A2)启动子中存在一个核转录因子AP1(c-fos和c-jun的产物)结合位点对TGFβ1调节I型胶原的表达起着非常关键的作用.
丹参是活血化瘀药的代表之一, 素有"丹参一味, 功同四物"之称, 广泛应用于心血管疾病中. 近年来, 临床[5]与动物实验[3,6]均证实, 丹参能有效改善肝脏炎症, 减轻细胞外基质的增生与沉积, 有较好的抗纤维化作用, 也常常作为抗纤维化复方的君药. 因此, 在既往研究的基础上, 探讨丹参影响TGFb1促I型胶原生成的机制及其抗纤维化的主要作用机制.
药物: 丹参为唇形科植物丹参saliva miltiorrhiza Bge的干燥根及根茎, 由上海中华制药厂协助制成流浸膏. 主要试剂: 重组人TGFβ1, Calbiochem 公司产品; 1640培养基及Moloney鼠白血病病毒逆转录酶, GIBCO公司产品; PCR markers 及六聚体随机引物、gel mobility shift assay试剂盒, Promega产品; γ-32P-ATP (5 000 Ci/mmol)北京福瑞生物工程公司; 其余试剂为国产或进口分析纯. 引物: GAPDH引物(甘油醛-3-磷酸脱氢酶, 长度为299 bp)[8]、c-fos引物(长度为432 bp)[9]. 细胞: 小鼠胚胎NIH/3T3成纤维细胞株, 购自中国科学院上海细胞研究所.
(1)丹参含药血清制备方法: 使用丹参流浸膏灌胃, 用量为体重65 kg成人的10倍, 对照组给予等量的生理盐水; 大鼠2次/d灌胃2 d, 第3 d首次灌胃2 h后追加1次, 再1 h后自后腔静脉采血, 离心分离含药血清[1]. (2)细胞培养: 以含100 mL/L小牛血清的1640培养液, 在50 mL/L CO2, 37 °C潮湿空气的培养箱中培养, 长至亚单层后, 更换为丹参含药血清及TGFβ1(5 ng/mL)继续培养24 h, 收取细胞层标本. (3)RT-PCR 及其产物分析: 异硫氰酸胍一步法提取细胞总RNA[10], 取总RNA 1-2 μg经逆转录后, 进行PCR 30-35个循环扩增. 产物经20 g/L琼脂糖凝胶电泳, 紫外透射反射仪观察及照相, 以GAPDH作为内参照, 调节各组总RNA用量. (4) gel mobility shift assay: 参照文献方法提取细胞核蛋白[7,13], 考马斯亮蓝法定量蛋白. 5'-末端标记寡核苷酸, 反应体系为: 寡核苷酸(1.75 pmol/μL) 2 μL、T4激酶缓冲液1 μL、 [γ-32P-ATP] 1 μL、无核酸酶水 5 μL、T4激酶1 μL, 37 °C 10 min, 加入0.5 mol/L EDTA 1 μL终止反应, 再加入89 μL TE缓冲液(10 mmol/L Tris-HCL, pH8.0, 1 mmol/L EDTA). G-25柱分离除去未标记核苷酸. DNA结合反应体系为: 无核酸酶水 5 μL 5×shift缓冲液 2 μL、核提取物10 μg蛋白, 室温10 min, 加入1μL32P标记寡核苷酸, 室温20 min. 反应结束后, 取10 μL样品经40 g/L凝胶, 0.5碩BE缓冲液 (TRIS 碱5.39 g, 硼酸2.75 g, EDTA-Na2.H2O 0.37 g)电泳, 固定、增感、水洗、干胶、放射自显影10-72 h, 定影、显影.
TGFβ1作用组较对照组c-fos mRNA 表达显著增加, 丹参加TGFβ1组较TGFβ1单独作用组c-fos mRNA表达量显著减少(图1).
TGFβ1(5ng/mL)作用后, NIH/3T3细胞AP1对启动子结合活性明显增加, 而100 mL/L丹参药物血清可拮抗TGFβ1的作用, 使AP1对启动子结合活性下降(图2).
TGFβ1是目前所知的最强大的促胶原生成因子. 在小鼠、大鼠及人胶原2条多肽链基因的启动子上均有TGFβ1的作用位点[2], 因此, TGFβ1对胶原的调节至少有一部分直接发生在转录水平. TGFβ1的促胶原表达是通过转录调节因子的参与而进行的.目前已知, 由c-fos和c-jun基因产物组成的AP1蛋白及其家族参与了TGFβ1对胶原启动子的作用[2,12].
本文的研究结果显示, 经TGFβ1作用后, c-fos的表达和AP1蛋白的结合活性明显增加, 提示TGFβ1的促胶原生成作用有一部分是通过促进c-fos的转录增加和AP1蛋白的表达增加而实现的, 而丹参可降低TGFβ1刺激的c-fos的转录增加及AP1 蛋白的结合活性. 结合以往的研究发现: 丹参对TGFβ1所产生的明显促进I型胶原α2链基因表达的作用也有部分抑制效果[1]. 表明丹参通过拮抗TGFβ1的作用来影响胶原蛋白的表达, 丹参对TGFβ1刺激的NIH/3T3细胞I型胶原表达的抑制作用有一部分是其抑制c-fos基因表达和AP1蛋白结合活性的结果. 国外已有文章报道, 胶原基因启动子竞争性结合物可以通过拮抗TGFβ与启动子的结合从而抑制由TGFβ诱导的胶原细胞中胶原蛋白的生成[15], 丹参对胶原蛋白产生的抑制作用是否也与胶原基因启动子的竞争性结合有关, 值得进一步研究.
最近的研究证明, 丹参抗纤维化的有效成分之一的丹参酚酸B可通过干扰TGFβ1在肝星状细胞胞质中的信号通路进而影响肝星状细胞的胶原生成[4,14], 和本研究中丹参影响成纤维细胞TGFβ1的细胞核内信号转导的结果相结合, 可看到丹参抗纤维化作用的一些作用位点和机制, 为丹参的进一步临床应用和开发提供理论依据.
| 1. | 王 晓玲, 刘 平, 童 普德, 谭 英姿, 钱 汝红, 胡 旭东, 蒋 文娟. 丹参对转化生长因子β1刺激的NIH/3T3细胞表达I型胶原和c-fos mRNA的影响. 中西医结合肝病杂志. 2001;11:19-20. |
| 5. | 余 亚新, 杨 汉青, 朱 立专, 曹 莉, 刘 宗良, 朱 礼尧, 张 尔康, 田 永明, 沈 怀成, 滕 士超. 大剂量丹参治疗肝纤维化的临床观察. 上海中医药杂志. 1994;2:8-10. |
| 7. | Dignam JD, Lebovitz RM, Roeder RG. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Research. 1983;11:1475-1489. [DOI] |
| 8. | Nicoletti A, Heudes D, Hinglais N, Appay MD, Philippe M, Sassy-Prigent C, Bariety J, Michel JB. Left ventricular fibrosis in renovascular hypertensive rats. Effect of losartan and spironolactone. Hypertension. 1995;26:101-111. [DOI] |
| 9. | Potter JJ, Rennie-Tankersley L, Anania FA, Mezey E. A transient increase in c-myc precedes the transdifferentiation of hepatic stellate cells to myofibroblast-like cells. Liver. 1999;19:135-144. [DOI] |
| 10. | Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem. 1987;162:156-159. [DOI] |
| 11. | Carcamo J, Weis FM, Ventura F, Wieser R, Wrana JL, Attisano L, Massague J. Type I receptors specify growth-inhibitory and transcriptional responses to transforming growth factor beta and activin. Mol Cell Biol. 1994;14:3810-3821. [DOI] |
| 12. | Jardine H, MacNee W, Donaldson K, Rahman I. Molecular mechanism of transforming growth factor (TGF)-beta1-induced glutathione depletion in alveolar epithelial cells. Involvement of AP-1/ARE and Fra-1. J Biol Chem. 2002;277:21158-21166. [DOI] |
| 13. | Smart DE, Vincent KJ, Arthur MJ, Eickelberg O, Castellazzi M, Mann J, Mann DA. JunD regulates transcription of the tissue inhibitor of metalloproteinases-1 and interleukin-6 genes in activated hepatic stellate cells. J Biol Chem. 2001;276:24414-24421. [DOI] |
| 15. | Meisler NT, Chiu JF, Cutroneo KR. Promoter competitors as novel antifibrotics that inhibit transforming growth factor-beta induction of collagen and noncollagen protein synthesis in fibroblasts. J Cell Biochem. 1999;75:196-205. [DOI] |