修回日期: 2002-12-20
接受日期: 2002-12-27
在线出版日期: 2003-10-15
构建含人幽门螺杆菌(H pylori)热休克蛋白A编码基因的重组载体、进行核甘酸序列分析, 并在E. coli BL21中表达, 研究其抗原性, 为疫苗的开发奠定基础.
利用分子克隆技术从H pylori DNA染色体中, 扩增热休克蛋白A编码基因片段; 将目的基因与载体pET32a(+)同时经kpnI、BamH I 双酶切、纯化、连接后, 转化含有目的基因的重组载体; 以含目的基因片段的重组载体转化大肠杆菌BL21(DE30)并表达; 表达产物经纯化后, 用Western blot法检测其抗原性.
经酶切、测序分析表明, 插入的基因片段为H pylori热休克蛋白A编码基因, 与GenBank报道的相比较, 有1.6%的碱基(bp)发生变异, 1.6%的氨基酸残基改变. 经SDS-PAGE分析发现, 融合基因表达的蛋白Mr为33×103, 其中pET32a(+)表达的蛋白Mr约为20×103, 可溶性表达产物占全菌总蛋白的18.96%. 重组蛋白经Ni+-NTA琼脂糖树脂纯化后, 其纯度达95%以上. 用Western blot方法检测显示, 该重组蛋白可被H pylori阳性患者的血清所识别, 具有良好的抗原性.
成功地克隆并表达了H pylori热休克蛋白A码基因, 为H pylori蛋白质疫苗的研制和快速诊断试剂盒的研究奠定了良好的基础.
引文著录: 姜政, 蒲丹, 黄爱龙, 陶小红, 王丕龙. 人幽门螺杆菌热休克蛋白A编码基因的克隆、表达及抗原性研究. 世界华人消化杂志 2003; 11(10): 1480-1484
Revised: December 20, 2002
Accepted: December 27, 2002
Published online: October 15, 2003
To construct a recombinant vector containing gene encoding heat shock protein A with a Mr of 13 000 from human Helicobacter pylori (H pylori) and express it in E. coli BL21, and to explore the antigenicity.
The target gene was amplified from H pylori chromosome by PCR, and then inserted into the prokaryotic expression vector pET32a (+) digested by restrictive endonuclease enzymes of kpn I, BamH I simultaneously. The recombinant vector was transformed and expressed in E.coli BL21.The antigenicity of recombinant fusion protein was analysed by Western blot.
Enzyme digestion and sequencing analysis showed that the target gene has been inserted into the recombinant vector, but as compared with the gene reported by GenBank, 1.6% of gene mutation and 1.6% of amino acid residues change in H pylori occurred, respectively. SDS-PAGE analysis showed that the recombinant vector could be expressed in E.coli BL21, the relative molecular mass (Mr) of expressed product was 33×103, while Mr of protein expressed by pET32a (+) was about 20×103, and soluble fusion expression product accounted for 18.96% of total bacterial protein. After purification with Ni+-NTA agarose resin, the purity of recombinant fusion protein was about 95%. Western blot result showed that recombinant fusion protein could be recognized by anti-H pylori positive serum, suggesting that the protein had good antigenicity.
The gene encoding H pylori heat shock protein A has been cloned and expressed successfully. The results lay the foundation for development of H pylori protein vaccine and a quick diagnostic kit for detection of H pylori infection.
- Citation: Jiang Z, Pu D, Huang AL, Tao XH, Wang PL. Cloning, expression and antigenic analysis of heat shock protein A gene of human Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2003; 11(10): 1480-1484
- URL: https://www.wjgnet.com/1009-3079/full/v11/i10/1480.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i10.1480
幽门螺杆菌(Helicobacter pylori, H pylori)是人类最常见的致病菌, 我国普通人群的感染率为50-80%, 并仍以每年1-2%的速度增加[1], 每年新增感染人数近千万. H pylori感染不但与消化性溃疡、MALT淋巴瘤、胃癌的发生有密切关系[2-7], 而且与肠道外疾病的发生也有显著的作用[8-15], 故已被世界卫生组织国际癌症研究机构列入第一类致癌原[16]. 根除H pylori的感染目前采取的方式很多: 比如药物的二联、三联以及四联疗法, 虽然可以达到治疗消化道疾病的目的, 同时也不同程度的根除H pylori的感染, 但近年来, 由于广泛的、大剂量的抗生素应用, 导致了H pylori耐药菌株的产生; 同时出现了一些药物副作用; 而且患者耐受性、依从性以及承受力都受到了挑战. 鉴于此, 欲求降低H pylori感染率及其相应疾病的发生率, 不少研究工作者正致力于开发研究新的H pylori治疗以及预防方案: H pylori疫苗的开发. 疫苗的研制已成为全球研究的热点, 美国已将其列为21世纪疫苗优先发展的II类项目, 有人预测在2010年, H pylori疫苗将有选择地应用于人群的预防和临床治疗. 新近研究表明: H pylori的尿素酶、热休克蛋白A(HspA)、中性粒细胞激活蛋白、黏附素、空泡细胞毒素、细胞毒素相关A蛋白以及Mr为18 000、26 000 OMP均是有效的抗原成分[17-34]. 而HspA为所有的H pylori共同的抗原成分, 用作疫苗抗原可使70-80%试验小鼠获得保护, 由于H pylori属微需氧菌, 培养条件高, 难以获得大量天然的HspA, 因此, 我们采用基因克隆技术, 将HspA编码基因, 经PCR扩增后, 构建重组载体, 在E. coli中进行表达, 为H pylori疫苗的研制及快速诊断试剂盒的制备奠定基础.
H pylori由本校微生物学教研室提供; Top10、BL21(DE3)菌株和pET32a(+)载体, 为本校病毒性肝炎研究所保存; T4 DNA连接酶和限制性内切酶(kpnI和BamH I)购自Promega公司; Taq DNA聚合酶为Takara产品; dNTP为上海生工生物工程公司产品; IPTG为sigma公司产品; PE-2400型PCR为美国PE公司产品. 参照文献[33]提取H pylori基因组DNA, 取H pylori培养物1.5 mL, 以12000 r/min离心2 min; 取沉淀, 加入TE缓冲液567 μL混悬, 再加入100 g/L SDS 30 μL和20 g/L 蛋白酶K 3 μL, 于37 °C温育1h; 而后依次加入5 mol/L NaCl 100 μL和100 g/L SDS 80 μL, 于65 °C温育10 min. 用酚及酚/氯仿各抽提3次, 收集上清液转入EP管中, 加入0.6倍于上清液的异丙醇, 并以12000 r/min离心15 s. 取沉淀, 加入700 mL/L乙醇1 mL洗涤, 再以12000 r/min 离心5 min, 弃掉上清, 将沉淀溶于100 μL TE中, 于-20 °C保存备用.
热休克蛋白A(HspA)编码基因的扩增, 根据GenBank, 经微机分析设计扩增HspA编码基因的引物P1和p2, P1的序列为5'-CCGGTACC-ATGAAGTTTCAACCATTAGG-3'; P2为5'-CCGGATCC-GTGTTTTTTGTGATCATGAC-3'. P1引物中引入kpnI酶切位点, P2引物中引入BamH I酶切位点. 在50 μL反应体系中, 分别加入dNTP 1 μL, DNA(作为模板) 2 μL及浓度各为18 μmol/L的P1和P2引物各1 μL, 以及Taq DNA聚合酶1 μL, 按照以下条件进行PCR扩增, 即94 °C变性7 min, 然后94 °C变性1 min, 52 °C退火50 s, 72 °C延伸50 s, 最后1个循环结束后再72 °C延伸7 min, 共35个循环. 所获PCR产物进行10 g/L琼脂糖凝胶电泳, 同时进行10 g/L琼脂糖凝胶回收. 将纯化的PCR产物和载体pET32a(+), 分别以kpnI和BamH I双酶切, 并用PCR纯化试剂盒进行纯化; 将酶切纯化的目的基因和pET32a(+)按4:1 (摩尔数)比例, 并在4 °C条件下连接过夜; 同时根据文献[33]制备Top10感受态菌: 取Top10菌的过夜培养物50 μL, 加于LB培养液2 mL中, 以 300 r/min摇荡3 h, 然后在室温下以10000 r/min离心 2 min. 弃上清, 加入100 mmol/L CaCl2 150 μL混悬, 置0 °C冰水浴中2 h, 而后加入连接产物10 μL混悬, 依次于0 °C冰水浴中30 min、42 °C水浴中2 min及冰水浴中2 min; 加入1 mL LB培养液, 于37 °C孵育30 min; 取200 μL培养物, 涂于LB+氨苄青霉素100 mg/L平皿, 于37 °C过夜. 于次日挑选单个菌落, 接种于2 mL LB+氨苄青霉素100 mg/L培养液中, 于37 °C以250 r/min培养12 h. 重组载体的提取, 按照上海生物工程公司出版的DNA抽提纯化操作手册进行, 同时进行酶切鉴定和基因测序分析.
1.2.1 重组载体pET32a(+)/HspA在E.coli中的表达 以酶切鉴定的重组载体转化E.coli BL21, 随后挑选含重组载体的单个菌落接种于盛有LB培养基的试管(含氨苄青霉素100 mg/L)中. 于37 °C培养至A600 = 0.4-0.6时, 加入终浓度为1.0 mmol/L的IPTG, 诱导表达4 h, 以10 000 r/min离心2 min. 收集菌体, 加入等体积蛋白上样缓冲液, 煮沸5 min, 进行150 g/L SDS-PAGE, 筛选高表达的含重组质粒的单个菌落, 以获得大量的重组蛋白.
1.2.2 表达产物的纯化及活性检测 由于融合蛋白的C端融合了6个组氨酸, 故表达产物采用Ni+-NTA琼脂糖树脂进行纯化. 将500 mL LB培养基制备的细菌, 混悬于超声破碎液(50 mmol/L NaH2PO4和300 mmol/L NaCl, pH 7.0)10 mL中, 在35%×600 v的低温条件下, 超声破碎40 min, 以4 °C 10000 r/min离心15 min, 取上清液过Ni+-NTA琼脂糖树脂柱, 先以洗涤液(50 mmol/L磷酸盐缓冲液、300 mmol/L NaCl及20 mmol/L咪唑, pH7.8)10 mL洗涤2次, 然后以洗脱液(50 mmol/L磷酸盐缓冲液、300 mmol/L NaCl, 250 mmol/L咪唑, pH7.8) 10 mL洗脱, 并分3段收集. 分别取3段收集液各10 μL, 以等量2×蛋白上样缓冲液混匀后, 煮沸5 min, 进行150 g/L SDS-PAGE. 采集H pylori阳性患者的血清作为一抗, 辣根过氧化物酶标记的羊抗人血清(IgG)为二抗, 以western blot方法, 检测目的蛋白的生物学活性.
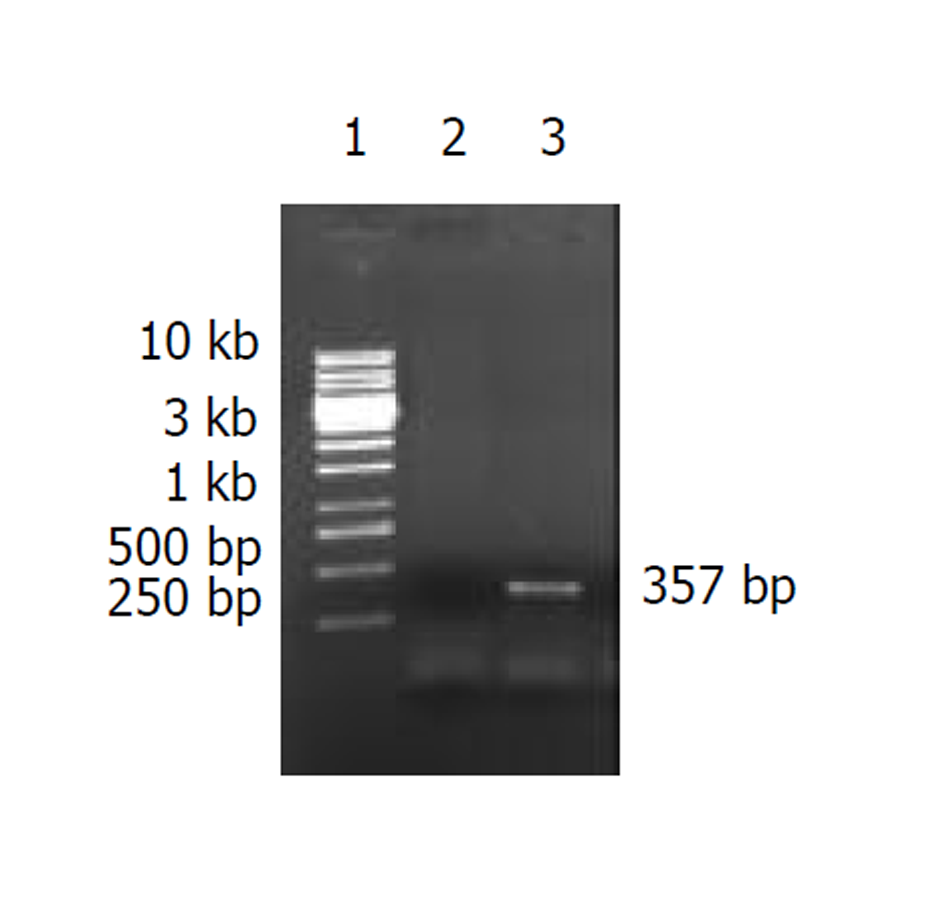
以H pylori基因组DNA为模板进行PCR扩增. 所获PCR产物进行10 g/L琼脂糖凝胶电泳分析(图1). 结果表明, PCR扩增产物位于250-500 bp之间. 序列分析证实, PCR扩增产物, 即为所需要的目的基因片段, 其大小约为357 bp.
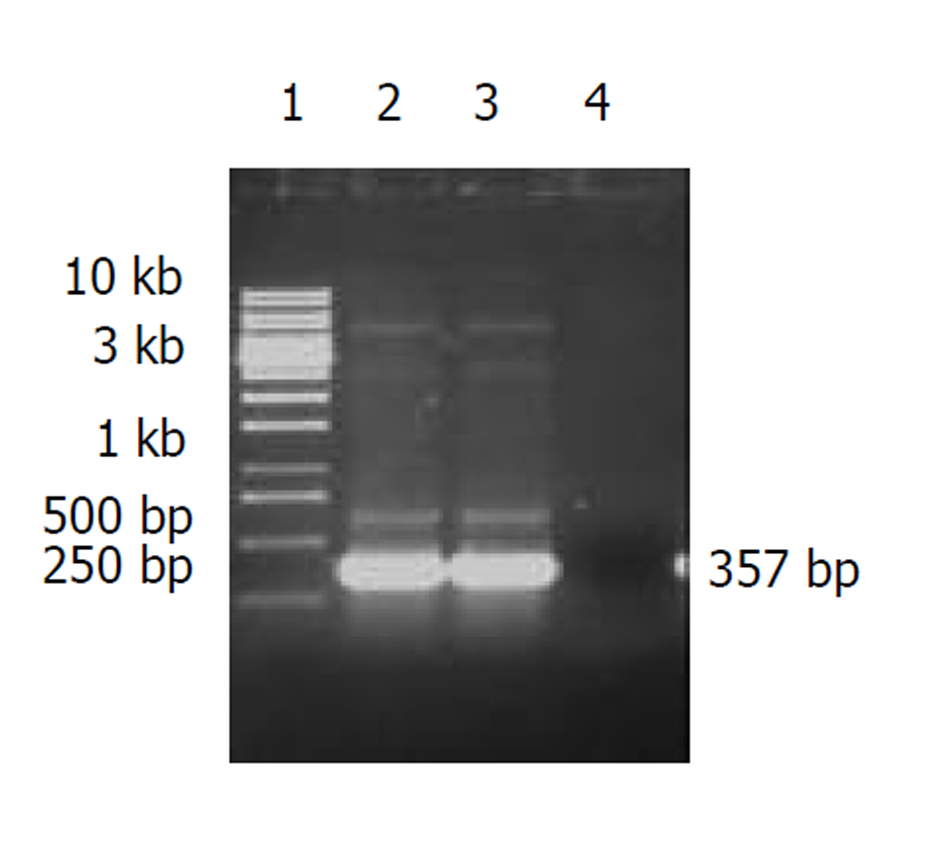
分别以重组载体和含重组载体的Top10菌为模板, 按照上述PCR扩增条件进行PCR扩增, 反应体系25 μL, 共35个循环. 所获PCR产物进行10g/L琼脂糖凝胶电泳, 结果显示: 以重组载体和含重组载体的Top10菌为模板, 均能扩增出1条约为357 bp的带(图2), 与实验设计相一致. 说明重组载体构建成功.
将重组载体以T7为引物进行序列分析(上海基康生物有限公司), 并采用电脑DNA分析辅助软件, 对所测定的DNA序列进行同源性分析. 结果发现, 插入的基因片段为HspA基因的片段, 其中有6个bp发生变异, 另有2处编码的氨基酸残基发生变化, 一处由G→D, 一处由A→S, 但HspA的特性无明显改变, 其同源性高达98%. 关于克隆的编码HspA基因及表达的目的蛋白的序列见其后.
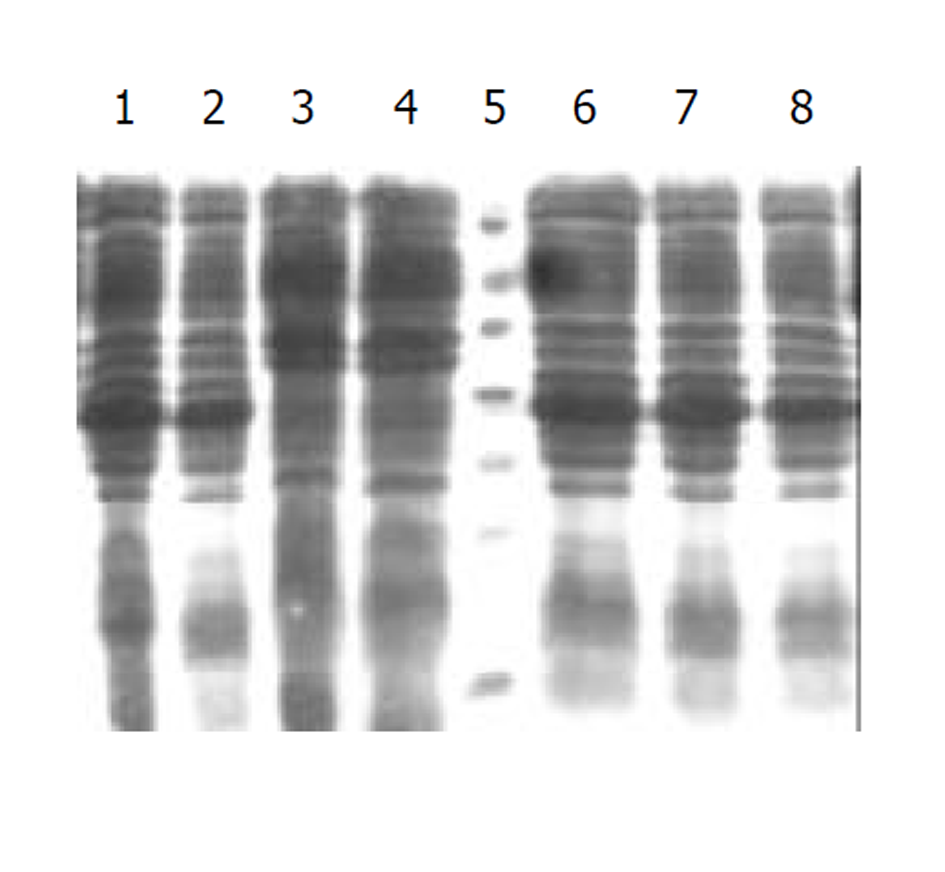
从重组载体pET32a(+)/ HspA转化的E.coli BL21中, 筛选高效表达菌株. 将含有重组载体的单个菌落置于LB培养液(含氨苄青霉素100 mg/L)中, 于37 °C培养至A600 = 0.4-0.6时, 加入终浓度为1.0 mmol/L的 IPTG诱导表达4 h, 以10000 r/min, 离心5 min. 收集菌体, 进行150 g/L SDS-PAGE. 结果发现, 经IPTG诱导后, 可高效表达Mr为33000的融合蛋白(图3). 通过Imagemaster totallab v1.11软件进行凝胶自动扫描分析, 融合蛋白的表达量约占菌体总蛋白的18.96%. 将500 mL LB(含氨苄青霉素100 mg/L)培养基制备的菌体, 溶于超声波缓冲液中, 破碎细菌、离心以及Ni+-NTA琼脂糖树脂柱纯化, 通过SDS-PAGE以及Imagemaster totallab v1.11软件进行凝胶自动扫描分析, 获得纯度达95%以上的终产物.
将诱导培养的BL21/pET32a(+), BL21/ pET32a(+)/HspA细菌各取1 mL, 离心, 在沉淀中加入蛋白上样缓冲液, 煮沸5 min, 进行150 g/L SDS-PAGE电泳, 而后在以电压14 V, 4°C的条件下, 进行电转8-12 h, 再将PVDF膜进行封闭、洗涤, 加入H pylori阳性患者的血清作为一抗, 同时以HRP标记的羊抗人lgG作为二抗(1:1000)进行western blot检测. 结果显示, 在BL21/ pET32a(+)/HspA的泳道上相应于其表达产物相对分子质量的地方出现了棕色的条带, 而BL21/pET32a(+)的泳道上未出现任何条带(图4).
热休克蛋白, 其广泛存在于人、动物、微生物和植物细胞内, 主要在细胞内发挥功能, 占细胞内总蛋白的5%, 属高度保守的应激蛋白质[35-38]. 而H pylori合成的热休克蛋白-热休克蛋白家族HspA、B, Hsp60, Hsp70等, 在细菌的致病机制中起着重要的角色, 同时能显著增强H pylori尿素酶的活性. 编码热休克蛋白A, B的DNA疫苗, 分别接种C57BL小鼠: 接种pcDNA3.1-HspA小鼠产生了IgG2a, 而接种pcDNA3.1-HspB则产生IgG1/IgG2a, 他们都显著地减少H pylori在胃内的定植, 同时减轻因H pylori存在的炎症反应. 因而, 作者认为, 以热休克蛋白为基础的(核酸DNA, 或蛋白质)疫苗不失为一种有效的H pylori疫苗.
鉴于此, 我们将H pylori HspA编码基因进行了克隆、构建了重组载体并进行了表达. 克隆HspA编码基因有1.6% (6/357)的碱基发生变异, 约1.6% (2/119)的氨基酸残基发生改变, 据文献[33]报道, 可能的原因有: (1)所采用的H pylori菌种不同; (2)H pylori具有转化能力, 能够通过已死亡的H pylori DNA转化而致基因组发生重排导致基因变异. (3)由H pylori菌株间的变异引起. 不同的患者感染的H pylori具有其特殊的限制性片段长度多态性(RFLP)谱型, 尤其是不同地区差别更加明显, 通常有好几个片段的差异, 但其高度的同源性又决定了不同菌株间编码蛋白的主要抗原决定簇的一致性, 从而保证了重组载体的表达. (4)PCR扩增所致的错配现象. 由于H pylori HspA编码基因编码119个氨基酸残基, 其多肽Mr约13 000道尔顿, 分子量较小, 故我们采用原核表达载体pET32a(+), 其主要特点是, 除能够编码6个组氨酸残基外, 还带有大肠杆菌TrxA基因. TrxA基因可编码109个氨基酸的硫氧还蛋白, 外源基因经多克隆位点插入后, 可与TrxA一起融合表达. 融合表达不仅提高了表达产物的稳定性, 而且由于相对分子质量增大, 用SDS-PAGE更容易分析鉴定. 此外, 外源蛋白与硫氧还蛋白之间具有肠激酶和凝血酶的识别位点, 从而也方便了外源蛋白与硫氧还蛋白的分离. 本研究中, 我们获得了高产量的融合蛋白产物, 由于载体pET32a(+)表达的6个组氨酸残基可与Ni+-NTA琼脂糖树脂中的Ni2+结合, 从而可对表达产物进行纯化. 我们通过Western blotting检测了融合蛋白表达产物的抗原性, 在BL21/ pET32a(+)/HspA的泳道上相应于其表达产物相对分子质量的地方出现了棕色的条带, 而BL21/pET32a(+)的泳道上未出现任何条带, 实验结果表明, 融合表达的蛋白具有良好的抗原性, 能够被H pylori阳性患者的血清所识别. 为以后制备安全、高效的疫苗, 以及制备ELISA快速诊断试剂盒奠定了基础.
除了构建和表达H pylori HspA编码基因外, 我们还致力于寻找活的载体. 因为抗原的呈递系统影响免疫反应的质和量. 黏膜免疫具有以下优点: (1)能够刺激局部免疫和体液免疫; (2)简单、经济, 适合群体免疫; (3)具有广泛的场所, 但到目前为止, 还未找到适合人类的副作用小的活载体; 而通过皮下免疫除了具有上述优点外, 还具有: (1)一次性接种, 终身带菌; (2)本身就是一种免疫佐剂, 可增强机体免疫功能; (3)如果细菌在体内过度表达, 可通过体外简单的方法加以解决, 这类载体以卡介苗为代表. 以 BCG( mycobacterium bovis bacillus calmette-guerin)牛型结核分枝杆菌的减毒菌株作为载体, 则具有无比的优越性. BCG以往主要用于预防结核菌的感染, 由于是活载体及其独特的安全性和免疫佐剂作用而受到科学家们的关注, 现已经研究表明, 重组的BCG(rBCG)表达的IL-12、IFN-γ、GM-CSF、HCG-β能被机体识别, 具有生物活性, 可广泛用于医疗卫生事业. 关于抗爱滋病、百白破、寄生虫疫苗正在研究之中, 我们正在构建以BCG为载体的重组能同时表达H pylori HspA与Mr 18 000 OMP疫苗, 我们相信, 不久的将来, H pylori疫苗一定将广泛应用于临床, 彻底根除与H pylori相关的一切疾病.
| 1. | Morgner A, Miehlke S, Fischbach W, Schmitt W, Muller-Hermelink H, Greiner A, Thiede C, Schetelig J, Neubauer A, Stolte M. Complete remission of primary high-grade B-cell gastric lymphoma after cure of Helicobacter pylori infection. J Clin Oncol. 2001;19:2041-2048. [PubMed] [DOI] |
| 2. | Nakamura S, Matsumoto T, Suekane H, Takeshita M, Hizawa K, Kawasaki M, Yao T, Tsuneyoshi M, Iida M, Fujishima M. Predictive value of endoscopic ultrasonography for regression of gastric low grade and high grade MALT lymphomas after eradication of Helicobacter pylori. Gut. 2001;48:454-460. [DOI] |
| 3. | Hiyama T, Haruma K, Kitadai Y, Masuda H, Miyamoto M, Ito M, Kamada T, Tanaka S, Uemura N, Yoshihara M. Clinicopathological features of gastric mucosa-associated lymphoid tissue lymphoma: a comparison with diffuse large B-cell lymphoma without a mucosa-associated lymphoid tissue lymphoma component. J Gastroenterol Hepatol. 2001;16:734-739. [DOI] |
| 4. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 5. | Kate V, Ananthakrishnan N, Badrinath S. Effect of Helicobacter pylori eradication on the ulcer recurrence rate after simple closure of perforated duodenal ulcer: retrospective and prospective randomized controlled studies. Br J Surg. 2001;88:1054-1058. [PubMed] [DOI] |
| 6. | Xue FB, Xu YY, Wan Y, Pan BR, Ren J, Fan DM. Association of H pylori infection with gastric carcinoma: a Meta analysis. World J Gastroenterol. 2001;7:801-804. [PubMed] [DOI] |
| 7. | Xia HX, Fan XG, Talley NJ. Clarithromycin resistance in Helicobacter pylori and its clinical relevance. World J Gastroenterol. 1999;5:263-266. [DOI] |
| 8. | Tsai CJ, Huang TY. Relation of Helicobacter pylori infection and angiographically demonstrated coronary artery disease. Dig Dis Sci. 2000;45:1227-1232. [PubMed] [DOI] |
| 9. | Gocyk W, Niklinski T, Olechnowicz H, Duda A, Bielanski W, Konturek PC, Konturek SJ. Helicobacter pylori, gastrin and cyclooxygenase-2 in lung cancer. Med Sci Monit. 2000;6:1085-1092. [PubMed] |
| 10. | Tsang KW, Lam WK, Kwok E, Chan KN, Hu WH, Ooi GC, Zheng L, Wong BC, Lam SK. Helicobacter pylori and upper gastrointestinal symptoms in bronchiectasis. Eur Respir J. 1999;14:1345-1350. [DOI] |
| 11. | Caselli M, Zaffoni E, Ruina M, Sartori S, Trevisani L, Ciaccia A, Alvisi V, Fabbri L, Papi A. Helicobacter pylori and chronic bronchitis. Scand J Gastroenterol. 1999;34:828-830. [DOI] |
| 12. | Dauden E, Jimenez Alonso I, Garcia-Diez A. Helicobacter pylori and idiopathic chronic urticaria. Int J Dermatol. 2000;39:446-452. [DOI] |
| 13. | Ojetti V, Armuzzi A, De-Luca A, Nucera E, Franceschi F, Candelli M, Zannoni GF, Danese S, Di-Caro S, Vastola M. Helicobacter pylori infection affects eosinophilic cationic protein in the gastric juice of patients with idiopathic chronic urticaria. Int Arch Allergy Immunol. 2001;125:66-72. [PubMed] [DOI] |
| 14. | Vainio E, Huovinen S, Liutu M, Uksila J, Leino R. Peptic ulcer and Helicobacter pylori in patients with lichen planus. Acta Derm Venereol. 2000;80:427-429. [DOI] |
| 15. | Szlachcic A, Sliwowski Z, Karczewska E, Bielanski W, Pytko-Polonczyk J, Konturek SJ. Helicobacter pylori and its eradication in rosacea. J Physiol Pharmacol. 1999;50:777-786. [PubMed] |
| 16. | Delchier JC, Lamarque D, Levy M, Tkoub EM, Copie-Bergman C, Deforges L, Chaumette MT, Haioun C. Helicobacter pylori and gastric lymphoma: high seroprevalence of CagA in diffuselarge B-cell lymphoma but not in low-grade lymphoma of mucosa-associatedlymphoid tissue type. Am J Gastroenterol. 2001;96:2324-2328. [PubMed] [DOI] |
| 17. | Ghiara P, Rossi M, Marchetti M, Di Tommaso A, Vindigni C, Ciampolini F, Covacci A, Telford JL, De Magistris MT, Pizza M. Therapeutic intragastric vaccination against Helicobacter pylori in mice eradicates an otherwise chronic infection and confers protection against reinfection. Infect Immune. 1997;65:4996-5002. [PubMed] |
| 18. | Goto T, Nishizono A, Fujioka T, Ikewaki J, Mifune K, Nasu M. Local secretory immunoglobulin A and postimmunization gastritis correlate with protection against Helicobacter pylori infection after oral vaccination of mice. Infect Immun. 1999;67:2531-2539. [PubMed] |
| 19. | Michetti P, Kreiss C, Kotloff K, Porta N, Blanco J, Bachmann D, Herranz M, Saldinger PF, Corthesy-Theulaz I, Losonsky G. Oral immunization with Urease and Escherichia coli Heat-labile enterotoxin is safe and immunogenic in Helicobacter pylori-infected adults. Gastroenterology. 1999;116:804-812. [DOI] |
| 20. | Li MF, Ling Z, Ma AY, Zhao JH, Sun JX, Yu SZ, Wu XP. Cloning, expression and immunogenicity of Hp UreB gene. Shijie Huaren Xiaohua Zazhi. 1999;7:596-600. |
| 21. | Lee CK, Soike K, Hill J, Georgakopoulos K, Tibbitts T, Ingrassia J, Gray H, Boden J, Kleanthous H, Giannasca P. Immunization with recombinant Helicobacter pylori urease decreases colonization levels following experimental infection of rhesus monkeys. Vaccine. 1999;17:1493-1505. [DOI] |
| 22. | Solnick JV, Canfield DR, Hansen LM, Torabian SZ. Immunization with recombinant Helicobacter pylori urease in specific-pathogen-free rhesus monkeys (Macaca mulatta). Infect Immun. 2000;68:2560-2565. [DOI] |
| 23. | Satin B, Del Giudice G, Della Bianca V, Dusi S, Laudanna C, Tonello F, Kelleher D, Rappuoli R, Montecucco C, Rossi F. The neutrophil-activating protein (HP-NAP) of Helicobacter pylori is a protective antigen and a major virulence factor. J Exp Med. 2000;191:1467-1476. [DOI] |
| 24. | Todoroki I, Joh T, Watanabe K, Miyashita M, Seno K, Nomura T, Ohara H, Yokoyama Y, Tochikubo K, Itoh M. Suppressive effects of DNA vaccines encoding heat shock protein on Helicobacter pylori-induced gastritis in mice. Biochem Biophys Res Commun. 2000;277:159-163. [PubMed] [DOI] |
| 25. | Myers GA, Ermak TH, Georgakopoulos K, Tibbitts T, Ingrassia J, Gray H, Kleanthous H, Lee CK, Monath TP. Oral immunization with recombinant Helicobacter pylori urease confers long-lasting immunity against Helicobacter felis infection. Vaccine. 1999;17:1394-1403. [DOI] |
| 26. | Kim BO, Shin SS, Yoo YH, Pyo S. Peroral immunization with Helicobacter pylori adhesin protein genetically linked to cholera toxin A2B subunits. Clin Sci (Lond). 2001;100:291-298. [DOI] |
| 27. | Kotloff KL, Sztein MB, Wasserman SS, Losonsky GA, DiLorenzo SC, Walker RI. Safety and immunogenicity of oral inactivated whole-cell Helicobacter pylori vaccine with adjuvant among volunteers with or without subclinical infection. Infect Immun. 2001;69:3581-3590. [PubMed] [DOI] |
| 28. | Ikewaki J, Nishizono A, Goto T, Fujioka T, Mifune K. Therapeutic oral vaccination induces mucosal immune response sufficient to eliminate long-term Helicobacter pylori infection. Microbiol Immunol. 2000;44:29-39. [DOI] |
| 29. | Koesling J, Lucas B, Develioglou L, Aebischer T, Meyer TF. Vaccination of mice with live recombinant Salmonella typhimurium aroA against H pylori: parameters associated with prophylactic and therapeutic vaccine efficacy. Vaccine. 2001;20:413-420. [DOI] |
| 30. | Bumann D, Metzger WG, Mansouri E, Palme O, Wendland M, Hurwitz R, Haas G, Aebischer T, von Specht BU, Meyer TF. Safety and immunogenicity of live recombinant Salmonella enterica serovar Typhi Ty21a expressing urease A and B from Helicobacter pylori in human volunteers. Vaccine. 2001;20:845-852. [DOI] |
| 31. | Liao W, Chen M, Zhu S. Construction of attenuated Salmonella typhimurium vaccine strain expressing Helicobacter pylori catalase and observation on its protective immunity. Zhonghua Yixue Zazhi. 2001;81:613-616. [PubMed] |
| 32. | Lee MH, Roussel Y, Wilks M, Tabaqchali S. Expression of Helicobacter pylori urease subunit B gene in Lactococcus lactis MG1363 and its use as a vaccine delivery system against H pylori infection in mice. Vaccine. 2001;19:3927-3935. [DOI] |
| 33. | Jiang Z, Tao XH, Huang AL, Wang PL. A study of recombinant protective H pylori antigens. World J Gastroenterol. 2002;8:308-311. [DOI] |
| 34. | Keenan J, Oliaro J, Domigan N. Immune response to an 18-kilodalton outer membrane antigen identifies Lipoprotien 20 as a Helicobacter pylori vaccine candidate. Infect Immun. 2000;68:3337-3343. [DOI] |
| 35. | Ning XX, Wu KC, Shi YQ, Wang X, Zhao YQ, Fan DM. Construction and expression of gastric cancer MG7 mimic epitopic fused to heat shock protein 70. Shijie Huaren Xiaohua Zazhi. 2001;9:892-896. |
| 36. | Jiang YG, Wang YM, Li QF. Expression and significance of HLA-DR antigen and heat shock protein 70 in chronic hepatitis B. Shijie Huaren Xiaohua Zazhi. 2001;9:907-910. |
| 37. | Chen ZF, Deng CS, Xia B, Zhu YQ, Zeng J, Gong LL. Expression of heat shock protein60, CD44 splice variant V6 in human gastric cancer. Shijie Huaren Xiaohua Zazhi. 2001;9:988-991. |
| 38. | Wu SL, Pan CE, Yang W, Niu XJ, Geng ZM. Expression of Hsp70 and MHC-1 antigen in hepatocellular carcinoma and its significance. Shijie Huaren Xiaohua Zazhi. 2002;10:291-294. |