修回日期: 2003-05-20
接受日期: 2003-06-10
在线出版日期: 2003-10-15
构建和表达人幽门螺杆菌(H pylori)热休克蛋白A亚单位(HspA)与E. coli不耐热肠毒素B亚单位(LTB)的重组融合蛋白, 并对其基本的生物学及免疫学特性进行研究.
采用PCR技术从人H pylori染色体DNA中扩增出354 bp的HspA基因, 并克隆至pPLtB载体中与ltB基因融合, 形成含有ltB-HspA融合基因的原核表达载体pPLH, 并在工程菌E.coli JM109中诱导表达.
经序列分析, ltB-HspA融合基因由684个碱基组成, 为编码228个氨基酸残基的多肽. SDS-PAGE和Western blotting检测发现, 融合蛋白的Mr 25×103, 并与H pylori感染的阳性血清发生抗原抗体反应, ELISA检测显示融合蛋白中存在LTB组分, 并保持与LT受体-神经节苷脂GM1结合的活性.
LTB-HspA融合蛋白有可能用于H pylori基因工程疫苗的研究.
引文著录: 郭红, 邹全明, 赵哓晏, 吴超. 幽门螺杆菌HspA与大肠杆菌LTB基因融合及表达. 世界华人消化杂志 2003; 11(10): 1475-1479
Revised: May 20, 2003
Accepted: June 10, 2003
Published online: October 15, 2003
To construct and express the fusion gene of H pylori heat shock protein A subunit (HspA) and E.coli heat-labile enterotoxin B subunit (LTB), and analyse the biologic and immunologic characteristics of the fusion protein.
HspA gene was amplified from H pylori chromosome by PCR. The gene was cloned into plasmid pPLtB and the fusion gene of H pylori urease B subunit (HspA) and E.coli heat-labile enterotoxin B subunit (LTB) was constructed, and then LTB-HspA recombinant protein was expressed in E.coli JM109.
LtB-HspA fusion gene was found to be 684 base pairs and encode the recombinant fusion protein, which was composed of 228 amino acid residues. SDS-PAGE and Western blotting analysis showed that the recombinant fusion protein had a molecular weight of 25kD and a positive reaction with the serum from H pylori-infected patients. ELISA analysis showed that LTB protein existed in the fusion protein. At the same time, fusion protein kept the character of binding with LTB receptor-ganglioside GM1.
LTB-HspA recombinant protein may be used for research of genetically engineered H pylori vaccine.
- Citation: Guo H, Zou QM, Zhao XY, Wu C. Construction and expression of the fusion gene of H pylori HspA subunit and E.coli heat-labile enterotoxin B subunit. Shijie Huaren Xiaohua Zazhi 2003; 11(10): 1475-1479
- URL: https://www.wjgnet.com/1009-3079/full/v11/i10/1475.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i10.1475
幽门螺杆菌(H.pylori)与B型胃炎, 消化性溃疡, 胃黏膜相关淋巴组织(MALT)淋巴瘤以及胃癌发生密切相关, WHO已将其列为一级致癌物质[1-37]. H pylori的致病性包括他的动力、黏附力、尿素酶、磷脂酶A、热休克蛋白(Hsp)和毒素, 毒素包括空泡细胞毒素(vacuolating cytotoxin A, VacA)和细胞毒素相关A蛋白(cytotoxin associated gene A protein, CagA) [38-48]. H pylori的尿素酶B亚单位(UreB)、热休克蛋白A亚单位(HspA)和VacA均是有效的抗原成分, 作为疫苗免疫动物均已取得良好的免疫预防和治疗效果. 大肠杆菌不耐热肠毒素(LT)与H pylori的保护性抗原共同口服免疫后可起到预防和治疗H pylori感染的作用, 其中B亚单位以其无毒性和较好佐剂活性已得到高度重视[49-58]. 我们采用PCR技术克隆H pylori HspA并与ltB基因融合, 进行表达, 为研究其产物的免疫学功能及LTB的分子内佐剂活性奠定了基础.
质粒pFs2.2由F.schodel博士惠赠; 原核表达载体PinPointTMXa-III购自Promega 公司; E.coli DH5α及E.coli JM109由本室保存, H pylori标准菌株NCTC11637购自中国预防科学研究所; 各种工具酶购自宝灵曼公司; 兔抗LT多抗血清购自上海市卫生防疫站, 免抗H pylori多抗血清本室制备; 羊抗兔HRP酶标二抗, 核酸相对分子质量标准、蛋白相对分子质量标准、IPTG购自华美公司; HRP标记的羊抗兔IgG抗体购自博士德公司; LT, GM1购自Sigma公司. 根据Genebank公布的hLT基因序列, 设计了两条引物分别为: 上游引物 5'ATCTGCAGGGAGTTACTCACATGGCTCCCCAGTCTATTAC 3', 下游引物 5'CGCGGATCCATCCTGAGGGTAGTTTT'3. 上游引物位于LTB DNA序列ATG下游64 bp位置, 下游引物位于LTB 3'端终止子前面部分序列, 同时引入Pst I和Bam HI酶切位点, 并在LTB最后一氨基酸(Asn)残基密码子AAC与Bam HI酶切位点之间设计增加了编码YPQD的12个核苷酸. 以含有ltB基因的质粒pFs2.2为模板进行PCR扩增. 根据GenBank公布的H pylori HspA序列及实验目的设计扩增引物, 分别在上游引物和下游引物5'端加入Bam HI和EcoR V酶切位点, 由于靠近hspA基因终止密码子TAA处存在大量不利于引物设计的连续相同的碱基, 故将下游引物设计到与终止密码子TAA后约130+ bp处的碱基相匹配. 采用Net Primer引物分析软件评价设计引物, 由上海生工公司合成, PAGE方式纯化. 上游引物: 5'-GTCGATCCAAGTTTCAACCATTAGG-3'下游引物: 5'-GCGATATCACAGCGTCATGGAGTT-3'.
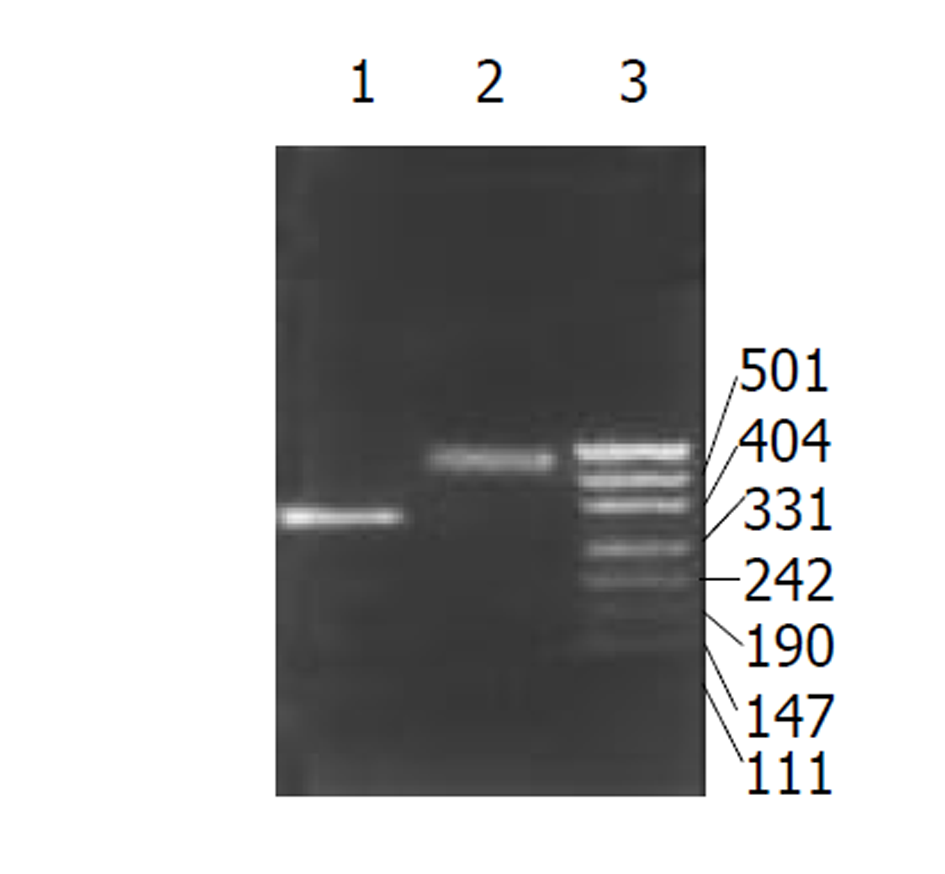
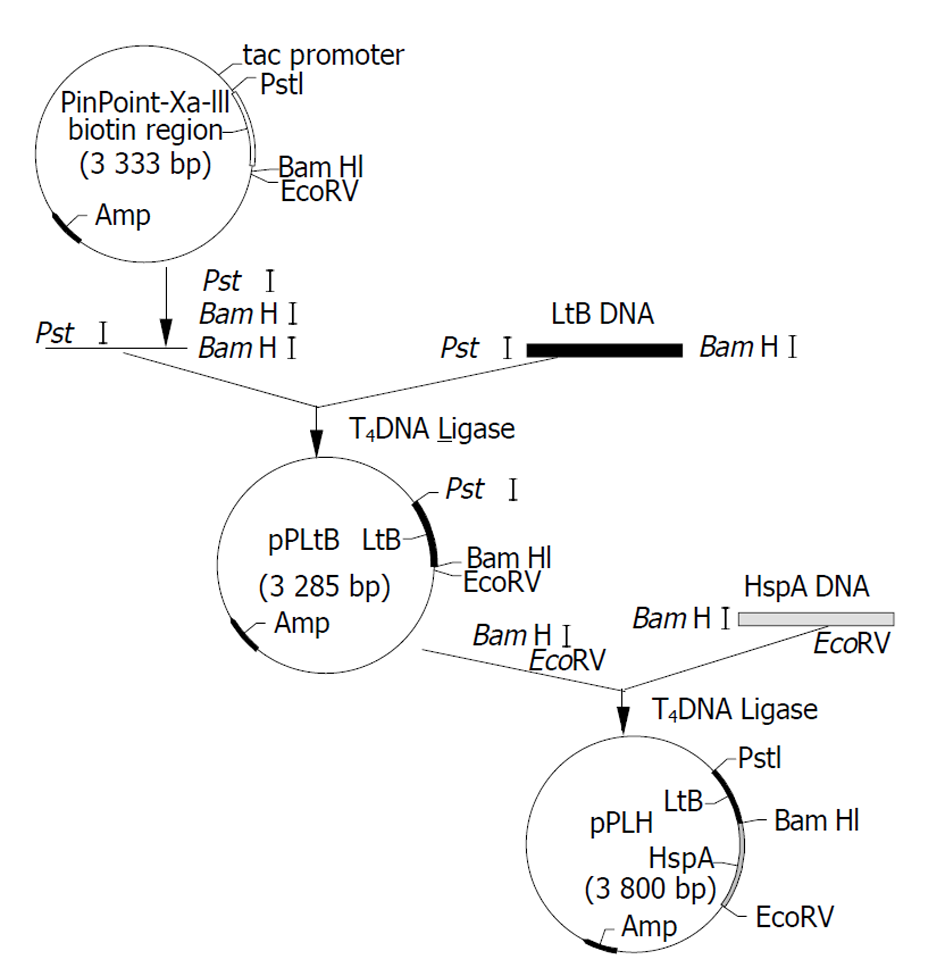
LtB基因和H pylori HspA基因的PCR扩增: 分别以含有ltBDNA的质粒pFs2.2和Hp NCTC1 1637基因组DNA为模板, 按常规PCR条件进行扩增. 反应条件: 94 °C预变性5 min, 加入Taq DNA聚合酶, 然后按如下参数循环: 94 °C, 1 min, 55 °C, 1 min, 72 °C, 1 min, 最后一个循环结束后72 °C反应5 min. 反应完毕后取产物3 μl, 在10 g/L-1琼脂糖凝胶中进行电泳分析. 融合基因表达载体的构建及DNA序列分析: LtB PCR产物经Pst I+Bam HI双酶切并纯化后与同样Pst I+Bam HI双酶切的PinPointTMXa-III载体相连接, 构建LTB融合表达质粒pPLtB, 外源基因可通过pPLtB上多克隆位点插入, 与ltB基因构成融合基因. 质粒pPLtB和HspA PCR产物均用Bam HI和EcoRV酶切, 用上海生工公司Silver Beads胶回收kits纯化回收DNA片段, 将pPLtB/ BamH I+Eco RV和PCR产物/BamHI+EcoRV在14-16 °C连接16 h. 连接产物转化E.coli DH5a, 经氨苄青霉素抗性及质粒少量抽提电泳筛选, 酶切鉴定, 得到阳性重组子, 命名为pPLH. 用全自动测序仪进行序列分析. 将重组表达质粒pPLH转化至E.coli JM109中, 经IPTG诱导后重组融合蛋白表达, SDS-PAGE电泳分析. 重组融合蛋白的免疫学鉴定: Western-blotting检测按《精编分子生物学实验指南ISBN 7-03-006408-9/Q.768》进行. 所用一抗为兔抗H pylori抗血清(1:2000倍稀释), 二抗为辣根过氧化物酶标记的羊抗兔IgG (1:3000倍稀释), 邻苯二胺显色. ELISA检测 用重组菌诱导表达超声破碎物包被酶标板, 10 g/L-1牛血清白蛋白封闭各孔, 先后加入兔抗LT多抗(1: 1000)和HRP标记的羊抗兔IgG抗血清(1: 10000), 邻苯二胺显色. 重组融合蛋白的GM1-ELISA检测, 按文献进行.
采用PCR技术分别从质粒pFs2.2和H pylori基因组中扩增出LtB 基因和HspA基因, 大小与预计大小相符(图1).
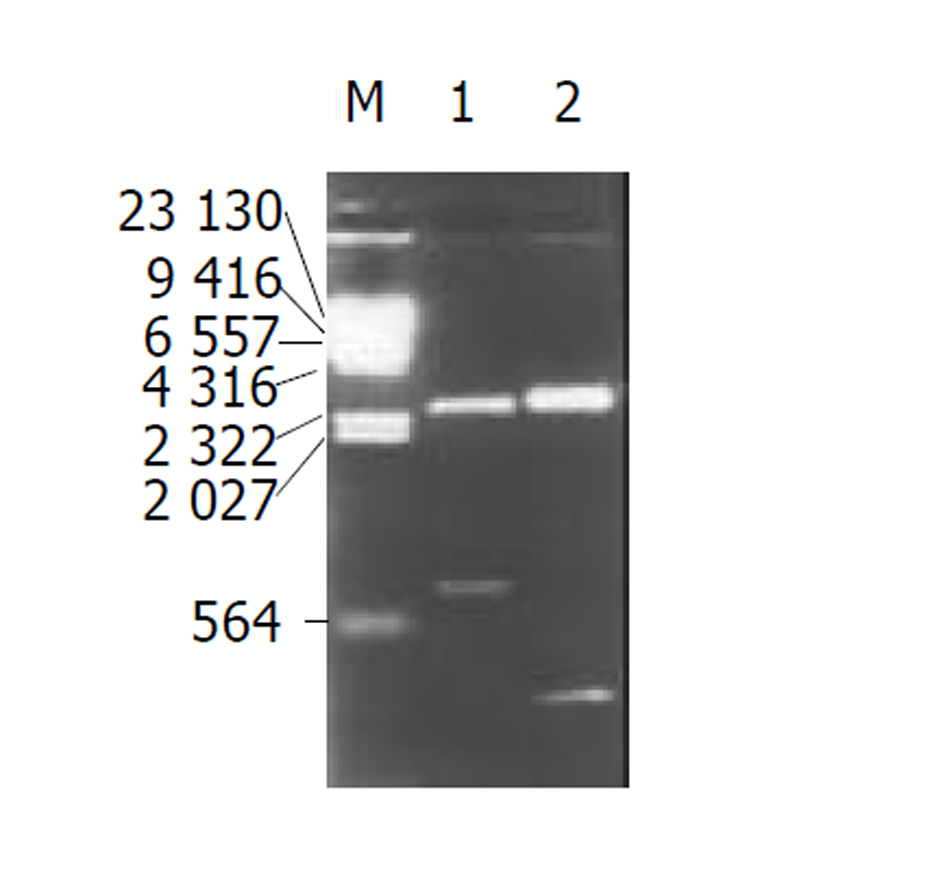
LtB PCR产物经PstI+BamHI双酶切并纯化后与同样PstI+BamHI双酶切的PinPointTMXa-III载体相连接, 构建LTB融合表达质粒pPltB. 经Amp抗性筛选, 碱裂解少量抽提和PstI+BamHI酶切鉴定, 出现330 bp DNA片段的为阳性重组子(图2). 再通过多克隆位点中BamHI和EcoRV切点将HspA PCR产物定向克隆于pPLtB载体并与ltB基因形成ltB-HspA融合基因 , 得到重组质粒pPLH(图3), PstI+EcoRV酶切鉴定, 出现约800 bp DNA片段的为阳性重组子(图2). 将克隆载体pPLH进行双向序列分析(图4), 与GenBank中公布的相应基因序列相比较, 结果表明融合基因中ltB基因序列的同源性为99.1%(327/330), 推定氨基酸同源性为99.1%, 而HspA基因序列同源性为96.3%(341/354), 氨基酸同源性为98.3%(2/118). 整个融合基因仅有2.33%的碱基差异和1.3%的氨基酸不同.
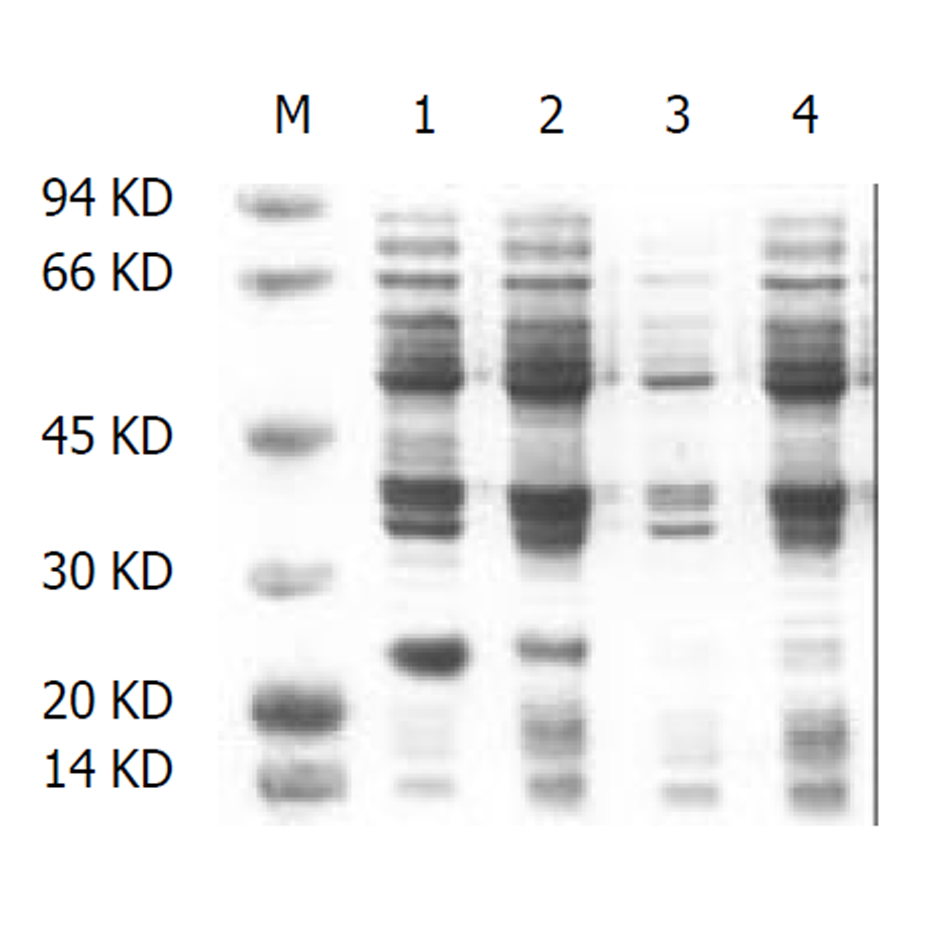
重组质粒pPLH在E.coli JM109中诱导表达后进行SDS-PAGE电泳, 可见新的蛋白条带出现, 与推定的融合蛋白Mr 25 000基本相符(图5). 重组LTB-HspA融合蛋白经Western blotting检测显示, 重组表达质粒在未经IPTG诱导和诱导后均在Mr 25000处出现单一的阳性反应条带, 而其他对照均无阳性反应条带(图6). 证明融合蛋白中含有HspA组分. ELISA检测显示融合蛋白包被孔呈明显的棕黄色, 而其他对照孔呈无色或淡黄色, 说明LTB-HspA融合蛋白中存在LTB组分. GM1-ELISA检测结果显示, 融合蛋白组呈现阳性, 而其他组为阴性, 证明该蛋白保留与神经节苷脂GM1受体相结合的活性.
幽门螺杆菌的热休克蛋白(Hsp)由于其特殊的结构和结合镍离子的特性, 已被认为是激发机体产生预防H pylori感染的最有效的抗原成分之一[59], 可以作为基因工程疫苗的侯选分子. 我们克隆出H pylori 354 bp HspA基因并与大肠杆菌ltB基因进行融合, 得到ltB-HspA融合基因. 经序列分析, 该融合基因由684个碱基组成, 包括ltB基因和HspA基因的序列, 其ltB基因序列与文献报道的序列相比较, 有0.90% (3/330)的编码碱基发生变异, 但其推定的氨基酸序列完全相同, 同源性高达99.1%; 而HspA基因序列与GenBank公布的序列相比, 有3.67%(13/354)的编码碱基发生变异, 其氨基酸序列中仅有2个氨基酸不同, 分别为Val-51变为Ala-51和Val-73变为Thr-73, 同源性高达98.3%. 整个融合基因约有2.33%(16/684)的碱基差异和1.3% (3/228)的氨基酸序列不同, 同源性极高, 为该融合基因的准确表达奠定了基础, 并且两个结构基因间仅存在18个非编码的碱基, 可以推测其编码的氨基酸将不会影响整个融合蛋白的免疫原性. 为了使所构建的LtB-HspA融合基因以天然蛋白形式表达, 特意将该融合蛋白表达载体中编码担体蛋白(tag)的一段DNA序列切去, 构建得到重组表达质粒pPLH, 在工程菌E.coli JM109中经IPTG诱导表达后, 可见Mr 25 000的蛋白条带出现. Western blotting检测目的条带处出现阳性反应, ELISA试验呈现阳性. 表明所表达蛋白为LTB-HspA融合蛋白, 且具有免疫反应性. 大肠杆菌的不耐热肠毒素为一种外毒素物质, 可引起人和猪等家畜的严重腹泻, 其主要的毒性部位为A亚单位, 可通过B亚单位与肠黏膜上皮细胞膜上的神经节苷脂GM1受体相结合进而发挥肠毒素活性. 我们根据LTB可与神经节苷脂GM1特异结合的特点, 建立GM1-ELISA方法, 检测证明了LTB-HspA融合蛋白中LTB的存在且具有与神经节苷脂GM1进行特异性结合的生物学活性. 同时以融合蛋白作为抗原包被酶标板后, 与H pylori感染患者的阳性血清发生抗原一抗体反应, 表明该融合蛋白保持了HspA原有的免疫反应性, 据此可将其用于H pylori感染患者的血清学检测与诊断.
大肠杆菌不耐热肠毒素(LT)除了具有毒素活性外, 更重要的是他还具有黏膜免疫原性和黏膜免疫佐剂性[60,61]. LTB亚单位既缺乏LT全毒素分子的毒性, 又保留了黏膜免疫佐剂的作用, 他与多种非相关的蛋白或非蛋白抗原经不同途径免疫均能明显增强机体的黏膜免疫反应, 故研究者们选用他作为口服疫苗的黏膜免疫佐剂. Weltzin 将重组LTB作为佐剂与尿素酶共同免疫小鼠, 发现可产生特异性的血清抗尿素酶IgG1和 IgG2a以及唾液中的抗尿素酶IgA, 以及对H pylori的保护性免疫[11]. 大量实验研究证明, UreA, HspA加LT通过黏膜途径免疫可获得有效的免疫保护性. 将LTB与HspA构建成融合蛋白形式表达, 为进一步研究LTB的分子内佐剂性和整个蛋白的免疫原性奠定了基础.
| 8. | Go MF. Review article: natural history and epidemiology of Helicobacter pylori infection. Aliment Pharmacol Ther. 2002;16:3-15. [PubMed] [DOI] |
| 14. | 聂 昭华, 祝 扬, 张 敏, 赵 源, 耿 玉兰, 曹 颖, 陈 秀珍. Hp(+)DU患者外周血T淋巴细胞亚群与胃黏膜组织急性炎症的关系. 世界华人消化杂志. 2000;8:590-592. |
| 24. | Sokucu S, Suoglu OD, Turkkan E, Elkabes B, Ozden T, Saner G. Helicobacter pylori infection in Turkish children with gastrointestinal symptoms and evaluation of serology. Turk J Pediatr. 2002;44:102-108. [PubMed] |
| 42. | 张 玲霞, 张 沥, 刘 永国, 张 宁霞, 阎 小君, 韩 锋产, 侯 瑜. 幽门螺杆菌细胞毒素相关蛋白A与胃十二指肠溃疡关系的病例对照研究. 世界华人消化杂志. 2000;8:733-736. |
| 45. | Gotteland M, Corvalan A, Sarmiento F, Chavez E, Backouse C, Palma M, Kakarieka E, Vial MT, Figueroa G. Gastric permeability is not increased in children colonized by CagA-positive strains of Helicobacter pylori. Dig Liver Dis. 2001;33:750-754. [DOI] |
| 49. | 吴 超, 邹 全明, 郭 红, 张 卫军, 袁 小澎, 毛 旭虎. 幽门螺杆菌UreB与大肠杆菌LTB基因融合及表达的研究. 中华微生物学和免疫学杂志. 2002;22:175-179. |
| 51. | 毛 旭虎, 邹 全明, 许 霖水. 大肠杆菌不耐热肠毒素的分子生物学特性. 国外医学·临床生物化学与检验学分册. 2000;21:228-229. |
| 54. | Dundon WG, Nishioka H, Polenghi A, Papinutto E, Zanotti G, Montemurro P, Del GG, Rappuoli R, Montecucco C. The neutrophil-activating protein of Helicobacter pylori. Int J Med Microbiol. 2002;291:545-550. [DOI] |
| 55. | Londono-Arcila P, Freeman D, Kleanthous H, O'Dowd AM, Lewis S, Turner AK, Rees EL, Tibbitts TJ, Greenwood J, Monath TP. Attenuated salmonella enterica serovar Typhi expressing urease effectively immunizes mice against Helicobacter pylori challenge as part of a heterologous mucosal priming parenteral boosting vaccination regimen. Infect Immun. 2002;70:5096-5106. [DOI] |
| 56. | Raghavan S, Svennerholm AM, Holmgren J. Effects of oral vaccination and immunomodulation by cholera toxin on experimental Helicobacter pylori infection, reinfection, and gastritis. Infect Immun. 2002;70:4621-4627. [DOI] |
| 57. | Keller WC, Michetti P. Vaccination against Helicobacter pylori-an old companion of man. Expert Opin Biol Ther. 2001;1:795-802. [PubMed] [DOI] |
| 58. | Nilsson CL. Bacterial proteomics and vaccine development. Am J Pharmacogenomics. 2002;2:59-65. [DOI] |
| 59. | Figura N, Piomboni P, Ponzetto A, Gambera L, Lenzi C, Vaira D, Peris C, Lotano MR, Gennari L, Bianciardi L. Helicobacter pylori infection and infertility. Eur J Gastroenterol Hepatol. 2002;14:663-669. [DOI] |
| 60. | De Haan L, Verweij WR, Feil IK, Holtrop M, Hol WG, Agsteribbe E, Wilschut J. Role of GM1 binding in the mucosal immunogenicity and adjuvant activity of the Escherichia coli heat-labile enterotoxin and its B subunit. Immunology. 1998;94:424-430. [PubMed] [DOI] |
| 61. | Weltzin R, Guy B, Thomas WD Jr, Giannasca PJ, Monath TP. Parenteral adjuvant activities of Escherichia coli heat-labile toxin and its B subunit for immunization of mice against gastric Helicobacter pylori infection. Infect Immun. 2000;68:2775-2782. [DOI] |