修回日期: 2002-06-15
接受日期: 2002-07-10
在线出版日期: 2003-01-15
目的: 探讨转化生长因子b1(TGF-b1)在人肝纤维化组织中的分布和作用.
方法: 采用放射免疫方法检测36例慢性乙型肝炎患者血清中PCIII、IV-C、HA、LN水平, 同时采用原位杂交和免疫组化的方法检测其肝组织中TGF-β1 mRNA及蛋白表达情况, 并对蛋白表达结果进行半定量分析.
结果: TGF-β1 mRNA 和蛋白表达于肝纤维化活跃的汇管区、纤维间隔、Disse间隙及肝细胞变性坏死处, 随肝纤维化程度的加重, TGF-β1蛋白表达着色积分增加(S0期 1.4±0.8, S1期 1.7±0.9, S2期2.9±1.0, S3期4.8±1.5, S4期 6.8±1.5); 并且与血清PCIII, IV-C, HA及LN水平呈明显的正相关(r = 0.39, P<0.05; r = 0.436, P<0.05; r = 0.63, P<0.01; r = 0.40, P<0.05).
结论: TGF-β1与胶原蛋白沉积密切相关, 在人肝纤维化的形成和发展中起关键性的作用.
引文著录: 李清华, 秦成勇, 劳萍. 转化生长因子β1在人肝纤维化组织中的表达及作用的探讨. 世界华人消化杂志 2003; 11(1): 103-105
Revised: June 15, 2002
Accepted: July 10, 2002
Published online: January 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(1): 103-105
- URL: https://www.wjgnet.com/1009-3079/full/v11/i1/103.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i1.103
转化生长因子-β1(transforming growth factor-beta 1, TGF-β1)是一种具有同源双链的多肽细胞因子, 具有调节细胞生长和分化的作用, 是组织修复过程的重要因素[1,2]. 近来研究认为TGF-β1是最重要的肝纤维化递质, 细胞外基质(extracelluar matrix, ECM)的合成和降解主要由TGF-β1 调控[1-4]. 我们采用原位杂交、免疫组化技术检测慢性乙型病毒性肝炎患者肝组织中TGF-β1的存在、定位, 并同时检测其血清中PCIII、IV-C、HA及LN的水平, 以期探讨TGF-β1与肝纤维化的关系.
住院和门诊的慢性乙型病毒性肝炎患者36例, 男20例, 女16例, 年龄21-65岁. 所有病例均经肝活检病理学证实. 诊断依据1995 年全国传染病寄生虫病会议修订的标准. 正常组织对照4例, 男3例, 女1例, 年龄32-50岁. 正常血清标本对照取自健康献血员15名, 年龄17-52岁, 男9名, 女6名. 所有对照者HAV-HEV的血清学标志均为阴性, 并且肝功能、肾功能检查均在正常范围. 静脉空腹取血3 mL, 分离血清, 抽血后3 d内进行肝穿刺和外科手术获得 肝组织标本, 1份入甲醛液固定; 另一份用OTC 包埋后置液氮冻存.
检测血清PCIII、IV-C、HA及LN水平, 采用放射免疫法, 试剂盒为重庆肿瘤研究所和上海海军医学研究所提供, 操作按说明书严格进行. 免疫组化按常规ABC方法进行, 检测用试剂盒为武汉博士德公司提供, 用PBS代替一抗作阴性对照. 半定量积分判定方法参照文献[5]方法, 略加以修改, 将门静脉及小叶着色面积积分分5个等级, 分别赋予0-4分, 选取一张片子上5个显微镜下视野计算着色总积分为两者着色面积积分之和. 原位杂交采用武汉博士德公司提供的TGF-β1原位杂交检测试剂盒, 操作按说明书严格进行, 最后DAB显色, 苏木素复染, 中性树脂封片. 所有标本均进行Mallory三色染色, 胶原纤维呈蓝色染色.
统计学处理 所有数据均以mean±SD 表示, 采用方差分析和直线相关分析的方法.
随S0-S3期肝纤维化加重, 4个指标依次升高, 除S1期PCIII, IV-C及LN水平, 各期指标与S0期比较均显著升高, S2-S4期PCIII、IV-C及HA水平还显著高于S1期, 且S3期和S4期HA水平亦明显高于S2期, 见表1.
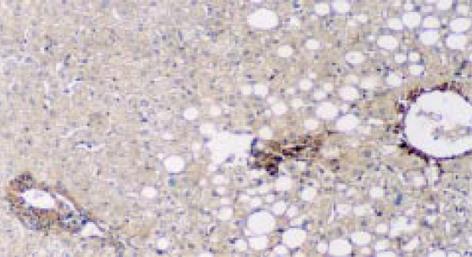
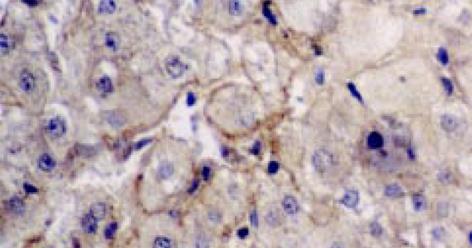
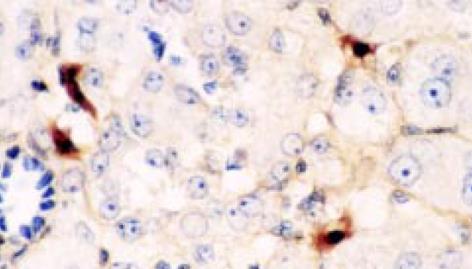
正常肝组织中活性TGF-β1免疫组化染色表明在中央静脉、肝动脉、门静脉及胆管管壁均见阳性染色. Mallory染色示, 胶原纤维尚未见明显增加的慢肝病变组织中的小叶内和汇管区的炎症细胞浸润、灶性坏死区的多量炎细胞、成纤维细胞及窦旁细胞却已见TGF-β1阳性染色. 随着肝病的发展, Mallory染色发现ECM的明显沉积增加, 慢性肝病变肝组织的炎症坏死区、中央静脉周围、门管区见图1, 及肝窦周Disse间隙的ECM沉积处见图2, 亦见明显的TGF-β1阳性染色. 肝硬化及慢性肝炎病变肝组织的纤维间隔及硬化结节边缘可见强阳性的TGF-β1染色, 与Mallory染色示胶原纤维沉积部位相一致. 在各种病变肝组织尤其是毗邻以上部位亦可见极少数肝细胞质有TGF-β1阳性染色. 活性TGF-β1着色积分随肝纤维化加重明显增加. 活性TGF-β1着色积分 除S0期(1.4±0.8)和S1期(1.7±0.9)、S3期(4.8±1.5)和S4期(6.8±1.5)之间, 各期之间均有显著差异(P<0.01). 且组织活性TGF-β1着色积分与血清PCIII、IV-C、HA 及LN水平亦呈明显的正相关(r = 0.39, P<0.05; r = 0.436, P<0.05; r = 0.630, P<0.01; r = 0.40; P<0.05).
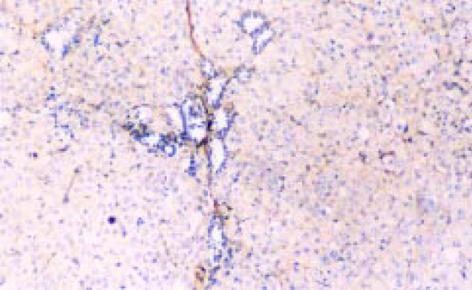
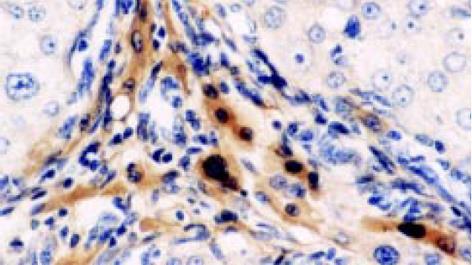
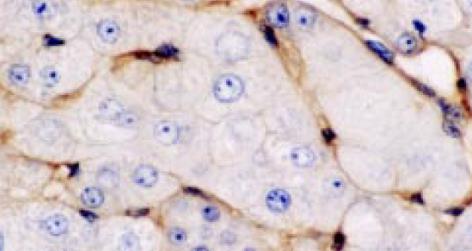
反映TGFβ1mRNA分布, TGF1杂交结果表明: 正常肝组织在背景染色基础上, 见少数肝细胞及中央静脉、门静脉、肝动脉、胆管的管壁处可探及较多的杂交信号, 分布均匀. 肝硬化及慢肝患者肝组织的假小叶周边、纤维间隔见图3、汇管区及间质与实质交界处炎性活动病变区及周围的成纤维细胞、炎细胞见图4, 增生胆管壁基底膜见图3, 及ECM沉积处见图4, 有明显的杂交信号, 毗邻以上部位处肝细胞亦见明显杂交信号, 分布不均匀, 呈灶状; 但肝硬化肝组织的肝细胞中极少. 另外肝小叶的肝Disse间隙及Disse腔内的窦旁细胞见图3、图5、图6, 亦见明显阳性杂交信号.
TGF-β1能促进各种ECM成分及受体的产生, 抑制基质降解蛋白酶的合成及促进基质降解蛋白酶抑制剂(PAI, TIMP等)合成[1-4]. 本实验研究了正常人、慢性乙肝及肝硬化患者肝组织中TGF-β1的表达. 以前大多数研究为单独进行原位杂交或免疫组化, 但是单原位杂交检测mRNA, 不能反映蛋白质表达或转录后激活过程, 而且激活过程是TGF-β1起作用的关键; 而单进行免疫组化的研究, TGF-β1 阳性亦可能是由于肝细胞摄入引起. 我们的结果表明: 不论TGF-β1 mRNA还是活性TGF-β1 蛋白于ECM沉积处, 如汇管区、纤维间隔、假小叶周边、肝窦Disse间隙、中央静脉管壁及炎症坏死区均见明显的阳性染色. 与胶原纤维沉积部位相一致. 另外肝纤维化早期, 主要是炎症坏死处及肝纤维化中、晚期, 主要为纤维间隔内的炎细胞、成纤维细胞、窦旁细胞及毗邻以上部位的极少数肝细胞亦见阳性染色. TGF-β1阳性染色分布不均匀, 呈灶状. 并且免疫组化示活性TGF-β1 染色积分随肝纤维化加重亦明显增加. Ito细胞是合成ECM最主要的间质细胞, 他主要位于肝窦周Disse间隙和纤维间隔[6]. 活动性肝病肝组织的Diees间隙、汇管区、炎细胞浸润变性坏死处、纤维间隔及肝硬化结节周边均为肝纤维化活动最活跃的地方. 表明活性TGF-β1同肝纤维化密切相关, 且发生在分子水平, 同以往的报道相一致[5,7-9], 证明这些地方是肝纤维化时增多的TGF-β1的来源之处. 肝纤维化早期, 肝损因子(如病毒)导致炎细胞及其他间质细胞浸润增多, 分泌适量的TGF-β1, 其通过自分泌和旁分泌机制又作用于间质细胞, 增加基质成分的合成[2-4,6,10], 由于TGF-β1对炎症细胞及成纤维细胞均有趋化作用, 从而使肝纤维化程度不断加重. 同时证明了临床上用各种方法保护慢性肝炎患者肝细胞不受损害, 抑制炎症反应, 是防治肝纤维化的重要措施.
肝纤维化时异常沉积的ECM, 包括胶原蛋白(I, II, IV, V, VI), 糖蛋白(FN, LN, VN等), 蛋白多糖(HA等). 众多研究已表明血清中PCIII, IV-C, HA, LN水平可反映肝内其含量及肝纤维化程度和活性[11-15]. 我们的实验亦表明这4个指标的水平随着病情和肝纤维 化程度的加重明显增加. 而且肝活性TGF-β1着色积分同血清中4个指标的水平呈明显的正相关. 进一步证明了TGF-β1与ECM的合成、代谢、胶原蛋白的沉积密切相关, 肝中活性TGF-β1 染色可反映肝纤维化程度及活动情况, 提示亦可作为肝纤维化的诊断指标.
编辑: N/A
| 4. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 5. | Inuzuka S, Ueno T, Torimura T, Tamaki S, Sugawara H, Sakata R, Kusaba N, Sata M, Tanikawa K. The significance of colocalization of plasminogen activator inhibitor-1 and vitronectin in hepatic fibrosis. Scand J Gastroenterol. 1997;32:1052-1060. [PubMed] [DOI] |
| 6. | Lewindon PJ, Pereira TN, Hoskins AC, Bridle KR, Williamson RM, Shepherd RW, Ramm GA. The role of hepatic stellate cells and transforming growth factor-beta(1) in cystic fibrosis liver disease. Am J Pathol. 2002;160:1705-1715. [PubMed] [DOI] |
| 8. | Hattori H, Matsuzaki A, Suminoe A, Ihara K, Nakayama H, Hara T. High expression of platelet-derived growth factor and transforming growth factor-beta 1 in blast cells from patients with Down Syndrome suffering from transient myeloproliferative disorder and organ fibrosis. Br J Haematol. 2001;115:472-475. [PubMed] [DOI] |
| 9. | Sedlaczek N, Jia JD, Bauer M, Herbst H, Ruehl M, Hahn EG, Schuppan D. Proliferating bile duct epithelial cells are a major source of connective tissue growth factor in rat biliary fibrosis. Am J Pathol. 2001;158:1239-1244. [PubMed] [DOI] |
| 11. | Luo R, Yang S, Xie J, Zhao Z, He Y, Yao J. [Diagnostic value of five serum markers for liver fibrosis]. Zhonghua Gan Zang Bing Za Zhi. 2001;9:148-150. [PubMed] |
| 12. | 常 克宏, 程 书权, 张 自富, 钱 梅艳. 血清HA, PLD, PCIII, LN, IV-C联合检测对慢性肝病诊断价值的探讨. 世界华人消化杂志. 2000;8:45-46. [DOI] |
| 14. | 刘 芳, 刘 金星, 曹 治宸, 李 兵顺, 赵 采彦, 孔 丽, 甄 真. 慢性肝病患者血清TGF-β1与肝纤维化指标和肝组织病理的关系. 世界华人消化杂志. 1999;7:519-521. [DOI] |
| 15. | Stickel F, Urbaschek R, Schuppan D, Poeschl G, Oesterling C, Conradt C, McCuskey RS, Simanowski UA, Seitz HK. Serum collagen type VI and XIV and hyaluronic acid as early indicators for altered connective tissue turnover in alcoholic liver disease. Dig Dis Sci. 2001;46:2025-2032. [PubMed] [DOI] |