Copyright
©The Author(s) 2013.
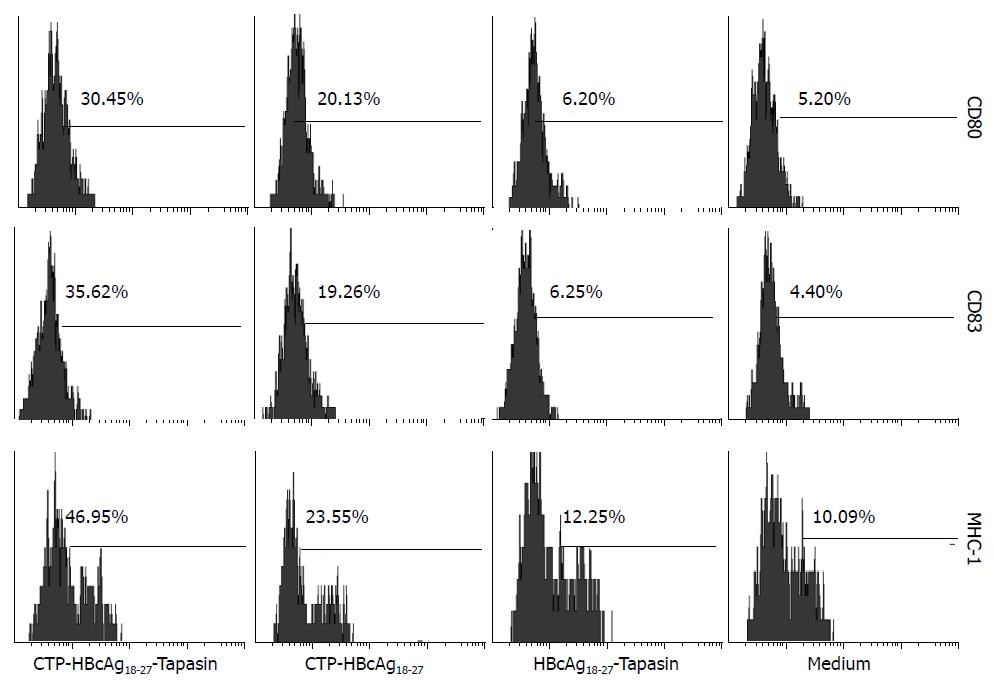
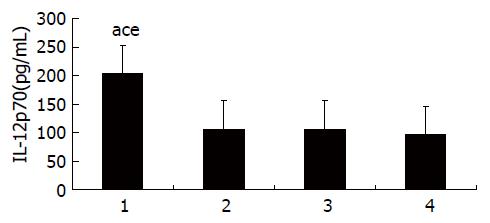
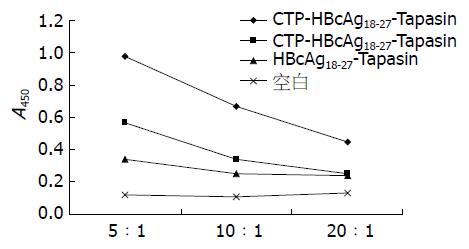
图3 HBV转基因小鼠树突状细胞上清液中IL-12p70水平的检测.
1: CTP-HBcAg18-27-Tapasin; 2: CTP-HBcAg18-27; 3: HBcAg18-27-Tapasin; 4: 空白组. aP<0.05 vs 空白组; cP<0.05 vs HBcAg18-27-Tapasin组; eP<0.05 vs CTP-HBcAg18-27组.
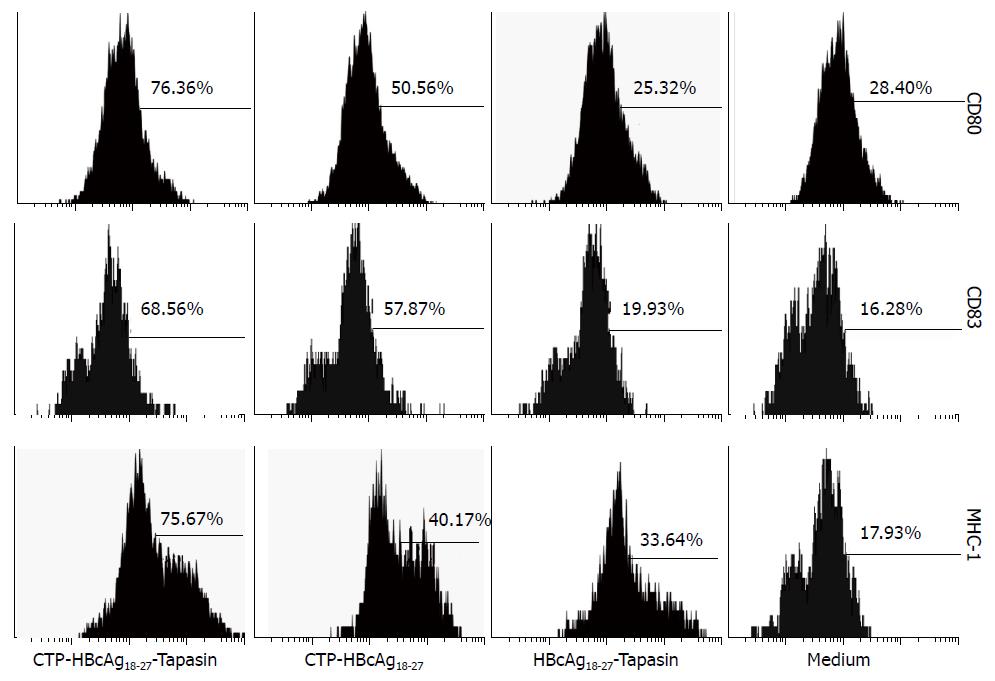
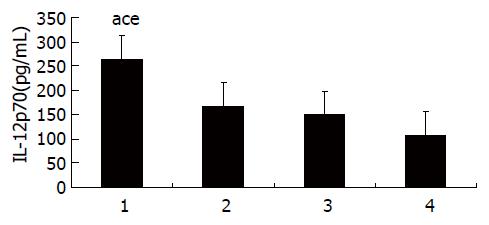
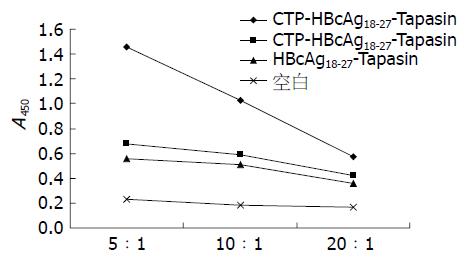
图4 C57BL/6小鼠树突状细胞上清液中IL-12p70水平的检测.
1: CTP-HBcAg18-27-Tapasin; 2: CTP-HBcAg18-27; 3: HBcAg18-27-Tapasin; 4: 空白组. aP<0.05 vs 空白组; cP<0.05 vs HBcAg18-27-Tapasin组; eP<0.05 vs CTP-HBcAg18-27组.
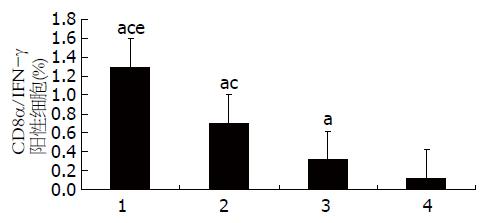
图7 流式细胞术检测HBV转基因小鼠不同组别CD8α/IFN-γ双阳性细胞数百分比(%).
1: CTP-HBcAg18-27-Tapasin; 2: CTP-HBcAg18-27; 3: HBcAg18-27-Tapasin; 4: 空白组. aP<0.05 vs 空白组; cP<0.05 vs HBcAg18-27-Tapasin组; eP<0.05 vs CTP-HBcAg18-27组.
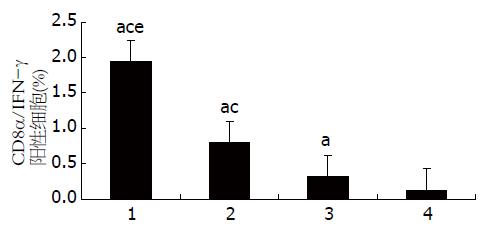
图8 流式细胞术检测C57BL/6小鼠不同组别CD8α/IFN-γ双阳性细胞数百分比(%).
1: CTP-HBcAg18-27-Tapasin; 2: CTP-HBcAg18-27; 3: HBcAg18-27-Tapasin; 4: 空白组. aP<0.05 vs 空白组; cP<0.05 vs HBcAg18-27-Tapasin组; eP<0.05 vs CTP-HBcAg18-27组.
引文著录: 唐余燕, 余永胜, 卓萌, 臧国庆, 汤正好, 陈小华. 胞质转导肽-HBcAg18-27-Tapasin体外诱导HBV转基因小鼠髓源性树突状细胞成熟及在T淋巴细胞增殖中的作用. 世界华人消化杂志 2013; 21(2): 122-129