修回日期: 2018-06-14
接受日期: 2018-07-15
在线出版日期: 2018-08-18
探索影响早期胃癌(early gastric cancer, EGC)生存的危险因素.
选取SEER数据库经手术治疗诊断为T1期胃癌患者, 采用COX比例风险模型、卡方检验(单因素分析)、Logistic回归对患者资料进行分析.
COX比例风险模型分析显示年龄、种族、性别、肿瘤大小、病理类型、分化程度、淋巴结转移情况均为影响EGC患者预后的独立风险因素. 在≤60岁EGC患者中, 肿瘤大小不是影响预后的独立危险因素. 在性别分组中, 在种族因素中, 男性中亚裔及其他总生存期要优于白人和黑人, 但在女性中没有差异. 男性中肿瘤大小、病理类型是影响预后的危险因素, 但在女性中不是. 而女性中, 肿瘤分化程度是影响预后的独立风险因素, 但在男性中不是. 影响淋巴结转移的独立风险因素只有肿瘤大小、病理分型和分化程度.
年龄和性别也是影响EGC患者预后的独立因素. 在不同年龄段和不同性别中影响预后的风险因素也有所差异. 因此, 了解不同临床特征患者的危险因素对于EGC患者精准治疗提供一定的循证学证据支持.
核心提要: 癌症的精准治疗成为现今热议的话题. 我们分析发现在不同年龄段和不同性别中影响预后的风险因素也有所差异. 因此, 了解不同临床特征患者的危险因素对于早期胃癌患者精准治疗提供一定的循证学证据支持.
引文著录: 边君, 王丽娟, 刘媛, 林海. 基于SEER数据库的影响早期胃癌风险因素分析. 世界华人消化杂志 2018; 26(23): 1408-1414
Revised: June 14, 2018
Accepted: July 15, 2018
Published online: August 18, 2018
To identify the risk factors affecting the survival of patients with early gastric cancer (EGC).
The patients who were diagnosed with T1 gastric cancer after operation were selected from the SEER database. The COX proportional hazards model, chi square test, and logistic regression were used to analyze the patients' data.
COX proportional risk model analysis showed that age, race, sex, tumor size, pathological type, degree of differentiation, and lymph node metastasis were independent prognostic factors for overall survival. Tumor size was not an independent risk factor for EGC in patients younger than 60 years of age. With regard to gender, race was an independent risk factor for male patients, but there was no difference among females. Tumor size and pathological type were risk factors for prognosis in males but not in females. The independent risk factors affecting lymph node metastasis were tumor size, pathological type, and degree of differentiation.
Age and gender are independent factors affecting the prognosis of EGC patients. There are also differences in risk factors affecting prognosis among different age groups and different gender groups. Understanding the risk factors for patients with different clinical characteristics can provide evidence-based medicine support for accurate treatment of EGC patients.
- Citation: Bian J, Wang LJ, Liu Y, Lin H. Analysis of prognostic factors in patients with early gastric cancer based on SEER database. Shijie Huaren Xiaohua Zazhi 2018; 26(23): 1408-1414
- URL: https://www.wjgnet.com/1009-3079/full/v26/i23/1408.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i23.1408
胃癌(Gastric cancer, GC)是世界上发病率及死亡率最高的肿瘤之一[1,2]. 世界卫生组织(World Health Organization, WHO)分类和日本胃肠内窥镜学会将早期GC(early gastric cancer, EGC)定义为: 癌组织局限于胃黏膜层或黏膜线下层, 不论其侵犯范围大小及是否有淋巴结转移[3]. 在亚洲东北部地区, EGC占所有GC的50%以上[4]. 在日本和一些西方国家, 超过90%的EGC患者能够长期生存[5,6].
病理类型、肿瘤大小和侵犯深度是已经公认的淋巴结转移及影响预后的危险因素[3]. 最近, Kim等[7]报道性别是影响淋巴结转移的一个重要因素, 并且在不同性别和不同年龄段的EGC患者中, 病理类型也有差异. Suh等[8]报道在不同性别及年龄段淋巴结转移状况及预后的差异. 本项研究将基于SEER(美国国立癌症研究所大型肿瘤数据库)数据分析影响EGC预后风险因素, 及不同人群中ECG预后影响因素分析.
我们筛选了2010/2015年SEER数据库登记的GC患者信息. 选取了经手术治疗的3691例T1期原发性GC患者. 患者年龄分为≤60岁和>60岁. 种族分为白人、黑人和亚裔及其他, 分析同一环境不同种族之间EGC风险因素的差异.
肿瘤大小根据文献分为≤3 cm和>3 cm; 病理类型根据WHO分类, 本研究将病理类型分为普通型及特殊型. 普通型包括: 乳头状腺癌、管状腺癌、低分化腺癌、黏液腺癌、印戒细胞癌. 特殊型包括: 腺鳞癌、鳞癌、类癌、未分化癌、大细胞癌等特殊类型; 根据肿瘤的分化程度分为高分化、中分化和低分化或未分化; T及N分期使用美国癌症联合委员会第七版TNM分期. N分组为淋巴结转移(N0)和伴有淋巴结转移(N1+N2+N3)总生存期(overall survival, OS)定义为从手术到死亡或最后失访日期为止.
统计学处理 应用SPSS21.0对数据进行分析. 使用卡方检验(单因素分析)或Logistic回归模型(多变量分析)分析危险因素. 生存分析采用Kaplan-Meier法(log-rank检验)和COX比例风险模型进行分析. P值小于0.05被认为具有统计学意义.
表1总结了筛选出的EGC患者临床信息. 所有患者均接受手术治疗, 诊断为T1的患者. 在本项研究的3691例患者中, >60岁患者2522(68.33%), ≤60患者为1169(31.67). 男性2067(56%), 女性1624(44%). 其中约66.8%患者肿瘤≤3 cm. 55%患者肿瘤病理类型为普通型. 但其中肿瘤高分化患者仅占26%左右. 伴有淋巴结转移患者占12.7%左右.
| 变量 | n (%) |
| 年龄 | |
| ≤60岁 | 1169 (31.67) |
| >60岁 | 2522 (68.33) |
| 种族 | |
| 白人 | 2447 (67.21) |
| 黑人 | 470 (12.91) |
| 亚裔及其他 | 724 (19.88) |
| 缺失 | 50 (1.37) |
| 性别 | |
| 男性 | 2067 (56.00) |
| 女性 | 1624 (44.00) |
| 肿瘤大小 | |
| ≤3 cm | 2467 (66.84) |
| >3 cm | 638 (17.29) |
| 缺失 | 586 (15.88) |
| 病理类型 | |
| 普通型 | 2032 (55.05) |
| 特殊型 | 1659 (44.95) |
| 分化程度 | |
| 高分化 | 815 (26.77) |
| 中分化 | 1036 (34.03) |
| 低分化或未分化 | 1193 (39.19) |
| 缺失 | 647 (21.25) |
| N分期 | |
| N0 | 3158 (21.25) |
| N1+N2+N3 | 462 (12.76) |
| 缺失 | 71 (1.96) |
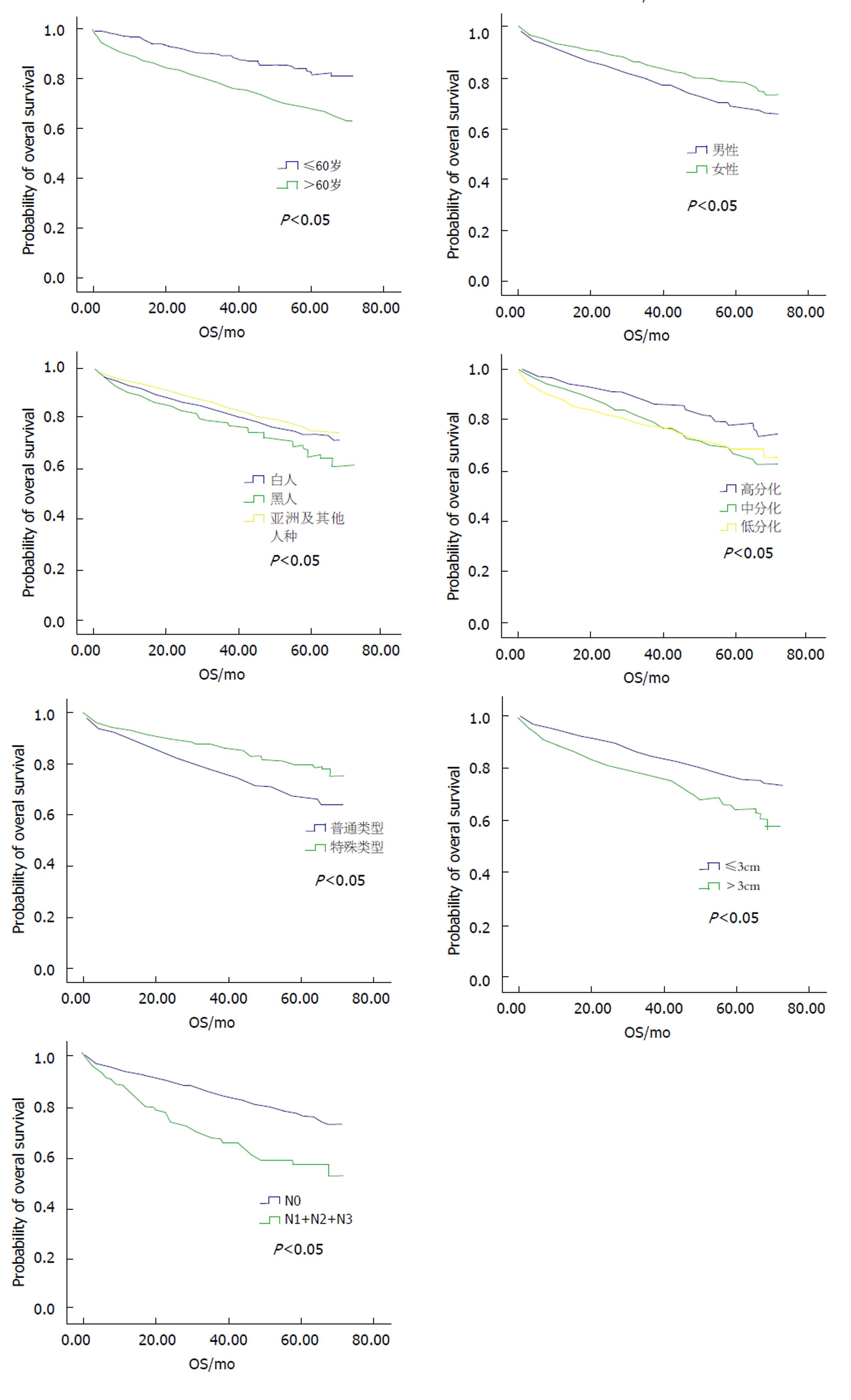
我们应用COX风险比例模型对患者临床信息进行了分析, 结果显示年龄、种族、性别、肿瘤大小[8]、病理类型、分化程度、淋巴结转移情况均为影响EGC患者预后的独立风险因素(表2). K-M生存曲线可以看出, 年龄>60岁、 白人和黑人、男性、肿瘤>3 cm、病理普通型、低分化和未分化、淋巴结转移均能导致患者预后不佳(图1).
| 变量 | HR | 95%CI | P-value |
| 年龄 | <0.001 | ||
| ≤60岁 | 1 | ||
| >60岁 | 2.266 | 1.738-2.956 | |
| 种族 | |||
| 白人 | 1 | 0.003 | |
| 黑人 | 1.347 | 1.03-1.762 | 0.030 |
| 亚裔及其他 | 0.771 | 0.603-0.987 | 0.039 |
| 性别 | <0.001 | ||
| 男性 | 1 | ||
| 女性 | 0.68 | 0.553-0.836 | |
| 肿瘤大小 | 0.001 | ||
| ≤3 cm | 1 | ||
| >3 cm | 1.424 | 1.154-1.758 | |
| 病理类型 | <0.001 | ||
| 普通型 | 1 | ||
| 特殊型 | 0.646 | 0.514-0.813 | |
| 分化程度 | |||
| 高分化 | 1 | 0.040 | |
| 中分化 | 1.133 | 0.854-1.501 | 0.387 |
| 低分化或未分化 | 1.389 | 1.055-1.830 | 0.019 |
| N分期 | <0.001 | ||
| N0 | 1 | ||
| N1+N2+N3 | 1.682 | 1.334-2.12 |
根据患者年龄的不同应用COX风险比例模型对患者临床信息进行了分析(表3). 我们发现, 不同年龄对于影响预后的危险因素有所差异. 种族因素中, 风险基本相同, 亚裔或其他人种预后要显著好于白人和黑人. 在性别分组中, 女性生存要优于男性. 而在肿瘤大小因素中, ≤60岁患者中肿瘤大小并不是影响预后独立危险因素, 但是在>60岁患者中, 肿瘤越大预后越差, 是独立危险因素. 病理类型中, 两组均为特殊类型要优于普通型患者. 分化程度对于两组年龄段均不是独立风险因素. 淋巴结转移在两组年龄段上均能影响预后.
| 变量 | ≤60岁 | >60岁 | ||||
| HR | 95%CI | P-value | HR | 95%CI | P-value | |
| 种族 | ||||||
| 白人 | 1 | 0.026 | 1 | 0.040 | ||
| 黑人 | 1.741 | 0.975-3.109 | 0.061 | 1.257 | 0.925-1.707 | 0.143 |
| 亚裔及其他 | 0.586 | 0.279-1.23 | 0.158 | 0.793 | 0.61-1.031 | 0.084 |
| 性别 | 0.028 | 0.002 | ||||
| 男性 | 1 | 1 | ||||
| 女性 | 0.537 | 0.308-0.936 | 0.706 | 0.565-0.883 | ||
| 肿瘤大小 | 0.651 | 0.001 | ||||
| ≤3 cm | 1 | 1 | ||||
| >3 cm | 1.138 | 0.65-1.995 | 1.465 | 1.166-1.84 | ||
| 病理类型 | <0.001 | 0.013 | ||||
| 普通型 | 1 | 1 | ||||
| 特殊型 | 0.369 | 0.211-0.642 | 0.729 | 0.568-0.935 | ||
| 分化程度 | ||||||
| 高分化 | 1 | 0.125 | 1 | 0.200 | ||
| 中分化 | 1.119 | 0.511-2.45 | 0.779 | 1.101 | 0.814-1.489 | 0.534 |
| 低分化或未分化 | 1.828 | 0.895-3.732 | 0.098 | 1.291 | 0.956-1.743 | 0.096 |
| N分期 | 0.009 | <0.001 | ||||
| N0 | 1 | 1 | ||||
| N1+N2+N3 | 2.104 | 1.206-3.673 | 1.64 | 1.27-2.117 | ||
根据患者性别的不同应用COX风险比例模型对患者临床信息进行了分析(表4). 我们发现, 不同性别对于影响预后的危险因素有所差异. 对于不同性别, 年龄和淋巴结转移情况均为影响预后独立风险因素. 在种族因素中, 男性中亚裔及其他OS要优于白人和黑人, 但在女性中没有差异. 男性中肿瘤大小、病理类型是影响预后的危险因素, 但在女性中不是. 而女性中, 肿瘤分化程度是影响预后的独立风险因素, 但在男性中不是.
| 变量 | 男性 | 女性 | ||||
| HR | 95%CI | P-value | HR | 95%CI | P-value | |
| 年龄 | <0.001 | <0.001 | ||||
| ≤60岁 | 1 | 1 | ||||
| >60岁 | 2.029 | 1.484-2.775 | 2.937 | 1.773-4.866 | ||
| 种族 | ||||||
| 白人 | 1 | 0.029 | 1 | 0.235 | ||
| 黑人 | 1.43 | 1.009-2.027 | 0.045 | 1.292 | 0.846-1.973 | 0.091 |
| 亚裔及其他 | 0.822 | 0.612-1.103 | 0.191 | 0.674 | 0.427-1.065 | 0.115 |
| 肿瘤大小 | 0.005 | 0.115 | ||||
| ≤3 cm | 1 | 1 | ||||
| >3 cm | 1.451 | 1.122-1.877 | 1.348 | 0.93-1.952 | ||
| 病理类型 | <0.001 | 0.416 | ||||
| 普通型 | 1 | 1 | ||||
| 特殊型 | 0.546 | 0.402-0.742 | 0.860 | 0.598-1.237 | ||
| 分化程度 | ||||||
| 高分化 | 1 | 0.118 | 1 | 0.021 | ||
| 中分化 | 0.887 | 0.632-1.245 | 0.490 | 1.839 | 1.117-3.03 | 0.017 |
| 低分化或未分化 | 1.182 | 0.843-1.659 | 0.332 | 1.907 | 1.184-3.072 | 0.008 |
| N分期 | <0.001 | 0.034 | ||||
| N0 | 1 | 1 | ||||
| N1+N2+N3 | 1.772 | 1.338-2.348 | 1.568 | 1.035-2.376 | ||
我们根据淋巴结转移情况对患者的临床资料进行了分析(表5). 在以上结果中可以看出, 不论是综合分析, 还是对年龄和性别分层分析, 淋巴结的转移状态均为影响EGC患者预后的独立风险因素. 因此我们应用卡方检验和Logistic回归模型对淋巴结转移的风险因素进行了分析. 卡方检验中结果显示种族、性别、肿瘤大小、病理类型、分化程度均为影响淋巴结转移的危险因素, 虽然年龄不是影响淋巴结转移的危险因素, 但是考虑到年龄会对其它危险因素产生影响, 因此我们将年龄也纳入了Logistic回归分析. Logistic回归分析Hosmer and Lemeshow Test(P = 0.537)显示该模型拟合优度较高, 分析结果显示只有较大的肿瘤、普通型病理分型和肿瘤分化程度较低是影响淋巴结转移的独立风险因素.
| 变量 | 单变量 | 多变量 | |||
| n | P-value | HR | 95%CI | P-value | |
| 年龄 | 0.658 | 0.265 | |||
| ≤60岁 | 1143 | 1 | |||
| >60岁 | 2477 | 1.154 | 0.897-1.485 | ||
| 种族 | <0.001 | ||||
| 白人 | 2398 | 1 | 0.218 | ||
| 黑人 | 464 | 1.230 | 0.88-1.72 | 0.225 | |
| 亚裔及其他 | 714 | 1.224 | 0.942-1.591 | 0.129 | |
| 性别 | 0.001 | 0.129 | |||
| 男性 | 2027 | 1 | |||
| 女性 | 1593 | 0.833 | 0.658-1.054 | ||
| 肿瘤大小 | <0.001 | <0.001 | |||
| ≤3 cm | 254 | 1 | |||
| >3 cm | 159 | 2.343 | 1.844-2.977 | ||
| 病理类型 | <0.001 | 0.004 | |||
| 普通型 | 2005 | 1 | |||
| 特殊型 | 1615 | 0.685 | 0.53-0.886 | ||
| 分化程度 | <0.001 | ||||
| 高分化 | 801 | 1 | <0.001 | ||
| 中分化 | 1022 | 3.741 | 2.365-5.92 | <0.001 | |
| 低分化或未分化 | 1167 | 8.212 | 5.307-12.707 | <0.001 | |
淋巴结转移情况已经被证实是影响生存的重要危险因素[8,9]. 在我们的研究中, 年龄、种族、性别、肿瘤大小、病理类型、分化程度均能影响EGC患者的生存. Popiela等人发现年龄也是影响EGC预后的独立危险因素, 与我们的结果一致, 但在其它研究中并未得出一致的结论[9-11]. 这些差异可能是因为OS或疾病相关死亡的分析差异. 另外, 在我们的研究中发现, 患者的生存危险因素因性别或年龄的不同而有所差异. 众所周知, 年龄较大的男性相比女性来说OS更差, 这是因为老年男性相比女性有更多合并症[10,11]. 在我们的研究中也证实男性确实比女性OS更差.
ECG治疗首先要考虑患者是否伴有淋巴结的转移. ECG伴有淋巴结转移或淋巴结转移的可能性, 不应该使用内镜切除治疗. 因此许多研究试图预测EGC淋巴结转移为危险因素, 并得出淋巴结转移与黏膜下层浸润、肿瘤大小、分化程度有关[12,13]. 因此, 日本GC协会制定了内镜治疗EGC的标准: 无溃疡表现的分化型腺癌; T1A并且直径小于2 cm[3]. 我们的研究显示, 年龄≤60岁患者淋巴结转移风险要高于年龄>60岁患者. 这有可能是因为年龄≤60岁患者中病理类型为普通型患者风险更高.
本研究也存在一定的局限性. 首先, 该研究属于回顾性研究, 患者资料来源于SEER; 第二, 因获取的资料有限, 并没有分析患者治疗情况及具体病理信息之间的差异. 因此, 我们的主要研究为分析年龄、性别及淋巴结转移的对于生存的影响.
总之, 我们的研究结果提示, 年龄和性别也是影响EGC患者预后的独立因素. 在不同年龄段和不同性别中影响预后的风险因素也有所差异. 因此, 了解不同临床特征患者的危险因素对于EGC患者精准治疗提供一定的循证医学证据支持.
早期胃癌(early gastric cancer, EGC): 癌组织局限于胃黏膜层或黏膜线层, 不论其侵犯范围大小及是否有淋巴结转移. 随着诊断技术及筛查的进步, 诊断为EGC患者越来越多. 影响EGC预后风险因素也越来越得到人们的重视.
癌症的精准治疗成为目前研究的热点. 因此, 对于EGC分层风险因素分析能够更好的预测EGC预后分析.
通过对于EGC分层风险因素分析, 对各个临床特征的患者做出预后预测.
通过与SEER数据库中EGC患者数据分析, 获得EGC预后独立危险因素. 通过对不同临床特征的EGC进行影响预后的危险因素分析, 探讨不同临床特征EGC患者独立危险因素之间的差异.
分析结果显示年龄、种族、性别、肿瘤大小、病理类型、分化程度、淋巴结转移情况均为影响EGC患者的预后. 随后对不同的年龄、性别和淋巴结转移状态进行分层分析, 发现不同的年龄、性别及淋巴结转移状态对预后的影响因素均有差异.
我们的研究结果提示, 年龄和性别也是影响EGC患者预后的独立因素. 在不同年龄段和不同性别中影响预后的风险因素也有所差异. 因此, 了解不同临床特征患者的危险因素对于EGC患者精准治疗提供一定的循证医学证据支持.
年龄和性别也是影响EGC患者预后的独立因素. 在不同年龄段和不同性别中影响预后的风险因素也有所差异. 因此, 了解不同临床特征患者的危险因素对于EGC患者精准治疗提供一定的循证学证据支持.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑:崔丽君 电编:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7-30. [PubMed] [DOI] |
| 2. | Chen W, Sun K, Zheng R, Zeng H, Zhang S, Xia C, Yang Z, Li H, Zou X, He J. Cancer incidence and mortality in China, 2014. Chin J Cancer Res. 2018;30:1-12. [PubMed] [DOI] |
| 3. | Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma: 3rd English edition. Gastric Cancer. 2011;14:101-112. [PubMed] [DOI] |
| 4. | Fujii M, Sasaki J, Nakajima T. State of the art in the treatment of gastric cancer: from the 71st Japanese Gastric Cancer Congress. Gastric Cancer. 1999;2:151-157. [PubMed] [DOI] |
| 5. | Zhou Y, Cui JG, Huang F, Zhang A, Li C, Zhao ZC, Li WD, Fu WH. Prognostic Factors for Survival in Node-Negative Gastric Cancer Patients Who Underwent Curative Resection. Scand J Surg. 2017;106:235-240. [PubMed] [DOI] |
| 6. | Zhu L, Qin J, Wang J, Guo T, Wang Z, Yang J. Early Gastric Cancer: Current Advances of Endoscopic Diagnosis and Treatment. Gastroenterol Res Pract. 2016;2016:9638041. [PubMed] [DOI] |
| 7. | Kim BS, Oh ST, Yook JH, Kim BS. Signet ring cell type and other histologic types: differing clinical course and prognosis in T1 gastric cancer. Surgery. 2014;155:1030-1035. [PubMed] [DOI] |
| 8. | Suh DD, Oh ST, Yook JH, Kim BS, Kim BS. Differences in the prognosis of early gastric cancer according to sex and age. Therap Adv Gastroenterol. 2017;10:219-229. [PubMed] [DOI] |
| 9. | Zheng Z, Zhang Y, Zhang L, Li Z, Wu X, Liu Y, Bu Z, Ji J. A nomogram for predicting the likelihood of lymph node metastasis in early gastric patients. BMC Cancer. 2016;16:92. [PubMed] [DOI] |
| 10. | Biffi R, Botteri E, Cenciarelli S, Luca F, Pozzi S, Valvo M, Sonzogni A, Chiappa A, Leal Ghezzi T, Rotmensz N. Impact on survival of the number of lymph nodes removed in patients with node-negative gastric cancer submitted to extended lymph node dissection. Eur J Surg Oncol. 2011;37:305-311. [PubMed] |
| 11. | Folli S, Dente M, Dell'Amore D, Gaudio M, Nanni O, Saragoni L, Vio A. Early gastric cancer: prognostic factors in 223 patients. Br J Surg. 1995;82:952-956. [PubMed] |
| 12. | Ahmad R, Setia N, Schmidt BH, Hong TS, Wo JY, Kwak EL, Rattner DW, Lauwers GY, Mullen JT. Predictors of Lymph Node Metastasis in Western Early Gastric Cancer. J Gastrointest Surg. 2016;20:531-538. [PubMed] [DOI] |
| 13. | Saragoni L, Gaudio M, Morgagni P, Folli S, Vio A, Scarpi E, Saragoni A. The role of growth patterns, according to Kodama's classification, and lymph node status, as important prognostic factors in early gastric cancer: analysis of 412 cases. Gastric Cancer. 2000;3:134-140. [PubMed] |