修回日期: 2017-09-30
接受日期: 2017-10-17
在线出版日期: 2017-11-08
探讨母鼠饮食中甲基供体含量的缺乏是否可能通过影响干扰素γ(interferon γ, IFN-γ)基因的甲基化参与子代鼠溃疡性结肠炎(ulcerative colitis, UC)的发生及发展.
从母鼠孕前1 mo至生产子鼠哺乳期结束, 分别给予母鼠(Balb/c)正常饮食和甲基供体(叶酸、维生素B12)缺乏饮食. 随后母鼠所产子代小鼠分别给予葡聚糖硫酸钠(dextran sulfate sodium, DSS)溶液和纯净水作为饮用水. 实验子鼠被随机分为4组: 标准饮食无DSS处理组(C/DSS-)、甲基供体缺乏饮食无DSS处理组(D/DSS-)、标准饮食DSS处理组(C/DSS+)、甲基供体缺乏饮食DSS处理组(D/DSS+). 处理5 d后, 评价子鼠结肠黏膜炎症程度, 检测血清叶酸、维生素B12和同型半胱氨酸, 并检测肠组织IFN-γ表达以及干扰素γ基因(interferon γ gene, IFNG)启动子区CpG岛基因甲基化水平.
D/DSS+组小鼠较C/DSS+组的结肠黏膜炎性活动指数(disease activity index, DAI)显著增高(3.22±0.55 vs 2.22±0.50, P<0.01). D/DSS+和D/DSS-组与C/DSS+和C/DSS-组相比, 血清叶酸(8.87 nmol/L±1.11 nmol/L vs 11.34 nmol/L±0.31 nmol/L, P<0.01)、维生素B12(409.2 ng/L±56.27 ng/L vs 676.1 ng/L±51.66 ng/L, P<0.01)显著降低, 同型半胱氨酸显著增高(8.45 μmol/L±0.35 μmol/L vs 6.77 μmol/L±0.36 μmol/L, P<0.01). C/DSS+和D/DSS+组IFN-γ表达较C/DSS-和D/DSS-组显著增高(5.3±1.2 vs 10.6±10.8, χ2 = 14.517, P = 0.001, P<0.01), DSS+组的IFN-γ表达水平与结肠炎症程度正相关(r = 0.853, 0.840; P = 0.031, 0.036; P<0.05). 子鼠结肠黏膜中的IFNG启动子区总体甲基化水平以及同一位点的甲基化水平, 4组之间相比无统计学差异(P>0.05).
母体孕期及哺乳期饮食中甲基供体缺乏可能通过结肠黏膜中IFN-γ表达增高导致子鼠结肠黏膜炎症严重程度增加. 子鼠结肠黏膜中IFN-γ的表达异常与IFNG启动子区的甲基化无明显相关性, 可能是其他途径导致的.
核心提要: 母体孕期及哺乳期饮食中甲基供体缺乏可能通过结肠黏膜中干扰素γ(interferon γ, IFN-γ)表达增高导致子鼠结肠黏膜炎症严重程度增加. 子鼠结肠黏膜中IFN-γ的表达异常与IFN-γ基因启动子区的甲基化无明显相关性, 可能是其他途径导致引起.
引文著录: 张蕊, 马玉萍, 刘文天. 母体甲基供体缺乏对子代小鼠结肠炎发生影响的研究. 世界华人消化杂志 2017; 25(31): 2791-2797
Revised: September 30, 2017
Accepted: October 17, 2017
Published online: November 8, 2017
To investigate whether maternal methyl donor deficiency promotes the pathogenesis and development of ulcerative colitis (UC) by affecting DNA methylation.
Maternal BALB/c mice were fed either a normal diet (C) or a methyl donor deficiency diet (D) from one month before pregnancy until the offspring weaned. Young mice were given dextran sulfate sodium (DSS) or purified water as drink water for five days. The young mice were randomly divided into four groups: C/DSS-, D/DSS-, C/DSS+, and D/DSS+. The degree of colonic inflammation was evaluated; serum folate, vitamin B12, and homocysteine (Hcy) were determined; the expression of interferon-γ (IFN-γ) in the colonic mucosa was detected; and the methylation level of CpG islands in the IFNG promoter was determined.
The disease activity index (DAI) was significantly higher in the D/DSS+ group than in the C/DSS+ group (3.22 ± 0.55 vs 2.22 ± 0.50, P < 0.01). Compared to the normal diet group, the methyl donor deficient diet group had significantly lower serum levels of folic acid (8.87 nmol/L ± 1.11 nmol/L vs 11.34 nmol/L ± 0.31 nmol/L, P < 0.01) and vitamin B12 (409.2 ng/L ± 56.27 ng/L vs 676.1 ng/L ± 1.66 ng/L, P < 0.01) and significantly higher Hcy (8.45 μmol/L ± 0.35 μmol/L vs 6.77 μmol/L ± 0.36 μmol/L, P < 0.01). The IFN-γ expression in the colonic mucosa was significantly higher in the C/DSS+ and D/DSS+ groups than in the C/DSS- and D/DSS- groups (5.3 ± 1.2 vs 10.6 ± 10.8, χ2 = 14.517, P < 0.01). The expression level of IFN-γ in the colonic mucosa of DSS+ groups was positively related to the degree of inflammation (r = 0.853, 0.840; P = 0.031, 0.036; P < 0.05). There were no significant differences in the methylation level of all CpG sites or same CpG sites among the four samples.
Methyl donor deficient diet may cause aggravated experimental colitis by increasing the expression of IFN-γ. The abnormal expression of IFN-γ in the colonic mucosa has no relationship with hypo-methylation of CpG islands in the IFNG promoter.
- Citation: Zhang R, Ma YP, Liu WT. Effect of maternal methyl donor deficient diet on experimental colitis in rat offsprings. Shijie Huaren Xiaohua Zazhi 2017; 25(31): 2791-2797
- URL: https://www.wjgnet.com/1009-3079/full/v25/i31/2791.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i31.2791
遗传易感性、环境、机体免疫相互作用, 共同参与溃疡性结肠炎(ulcerative colitis, UC)的发病过程, 但其发病机制不明. DNA甲基化是一种重要的表观遗传修饰方式, 其不改变DNA序列仅导致表型的改变从而影响疾病. 本研究将从表观遗传学方面探讨UC发病机制. 目前认为, 营养和膳食因素可以通过两种机制影响基因甲基化: (1)改变S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)的含量; (2)改变甲基化过程中DNA甲基转移酶(DNA methyltransferases, DNMTS)活性. 叶酸等甲基供体能够调节母体表观遗传机制[1], 进而调节表观基因组, 产生表型和疾病易感性的差异[2]. 此外以小鼠为模型的研究表明, 母体DNA甲基化能够通过孕期营养干预(如补充叶酸)而改变, 从而改变子代表型[3].
在UC动物模型中发现, 干扰素γ(interferon γ, IFN-γ)对于黏膜炎症的产生、发展和维持都起到重要作用. 与正常对照组相比, 炎症性肠病(inflammatory bowel disease, IBD)患者的结肠黏膜中干扰素γ基因(interferon γ gene, IFNG)甲基化水平降低[4], 但是导致结肠黏膜IFNG低甲基化的原因尚不清楚. 因此, 推测由于母体叶酸、维生素B12和甲硫氨酸等甲基供体的缺乏可能改变SAM的含量, 直接导致IFN基因低甲基化改变, 使IFN-γ高表达, 进而参与了UC的发病.
选择SPF级健康♀(n = 16)及♂7周龄(n = 8)Balb/c小鼠, 饲养于实验动物中心, 所有动物实验方案遵守天津医科大学实验动物伦理委员会相关规定. 饲养环境: 通风良好, 环境温度24 ℃±1 ℃, 相对湿度55%±5%, 灯光控制在明暗各12 h, 饮食水量充足且不限. 主要试剂和仪器: 甲基供体缺乏和标准小鼠饲料(北京华阜康生物科技有限公司); 葡聚糖硫酸钠(美国MP Biomedicals公司); 小鼠叶酸、维生素B12、同型半胱氨酸酶联免疫检测试剂盒(北京方程嘉鸿科技有限公司); 组织DNA提取试剂盒(天根生化公司); 扩增引物(上海赛百胜基因技术有限公司); EZ DNA Methylation-Gold Kit(ZYMO); 通用型SP免疫组织化学染色试剂盒(北京中杉金桥生物技术有限公司); 兔抗鼠IFN-γ多克隆抗体(北京博奥森生物科技有限公司); PCRmix体系、T7 RNA and DNA Polymerase、RNaseA、MassARRAY系统(Sequenom公司)光学显微镜(日本Olympus公司); 低温高速离心机(德国Eppendorf公司); 酶标仪(爱普生有限公司); 稳压稳流电泳仪(北京通用分析仪器厂); 全自动凝胶成像系统(上海天能科技有限公司).
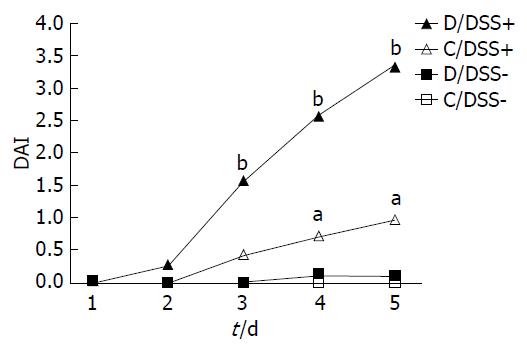
1.2.1 造模: ♀鼠于孕前1 mo分别喂养标准饮食(C, n = 8)和甲基供体缺乏饮食(D, 无叶酸、胆碱、维生素B12和甲硫氨酸, n = 8), 1 mo后与♂鼠交配, 用阴道栓测定雌鼠是否怀孕, 将怀孕的雌鼠隔离并持续喂养之前相同饮食至所产子鼠断乳, 所有子代小鼠于产后21 d断乳. 随后两组子鼠分别随机取6只, 以葡聚糖硫酸钠(dextran sulfate sodium, DSS)溶液作为饮用水5 d, 诱导子代小鼠实验性结肠炎, 其余子鼠作为对照组给予纯净水. 此时实验小鼠共分为4组, 每组6只(图1): (1)标准饮食未用DSS组(C/DSS-); (2)甲基供体缺乏饮食未用DSS组(D/DSS-); (3)标准饮食并用DSS组(C/DSS+); (4)甲基供体缺乏饮食并用DSS组(D/DSS+).
1.2.2 样本处理及保存: 一般情况, 观察各组子代小鼠的毛发光泽, 精神状态, 活动情况, 饮食情况以及大便和体质量变化. 所有子鼠在麻醉状态下眼球取血, 外周血在室温下静置4-6 h, 待凝固后1500 r/min离心10 min, 分离血清于-80 ℃低温冰箱保存. 眼球取血后处死子鼠, 立即暴露腹腔取出所有结肠组织, 用PBS磷酸盐缓冲液洗净后, 一半置于40 g/L甲醛溶液, 一半置于液氮速冻, 置入-80 ℃冰箱保存.
1.2.3 血清甲基供体检测: 血清叶酸、维生素B12、同型半胱氨酸的测定采用酶联免疫吸附法检测三项指标, 全部使用酶联免疫检测试剂盒测定. 具体步骤参照试剂盒说明.
1.2.4 子代小鼠结肠黏膜炎症程度和组织学评价: 子代小鼠在DSS处理第1天开始, 每天观察并记录小鼠体质量、粪便性状、活动情况及肛周出血程度. 参数包括体质量减轻评分、粪便性状评分和便血程度评分, 通过以上参数计算结肠黏膜炎性活动指数(disease activity index, DAI)[5], DAI = 1/3总评分, 分数范围0-4分. 组织学评分 = 受累范围×(组织损伤分级评分+炎性细胞浸润程度评分), 最高分为8分[6].
1.2.5 肠黏膜组织IFN-γ表达: 采用免疫组织化学SP方法检测IFN-γ在肠黏膜组织中的表达. 位于结肠黏膜组织上皮细胞和肠腺之间, 染色呈黄棕色颗粒的间质炎性细胞为阳性细胞. 每张切片中随机选择5个高倍镜视野, 共计数500个细胞, 根据500个细胞中阳性细胞占总细胞的百分比和阳性细胞染色强度程度进行评分.
1.2.6 DNA提取及浓度测定: 按照组织基因组DNA 提取试剂盒说明进行操作, 加入蛋白酶使肠道黏膜组织蛋白溶解, 裂解液裂解细胞核后沉淀DNA, 乙醇洗涤后用DNA溶解液溶解. DNA溶液稀释100倍, 用分光光度计分析DNA的纯度.
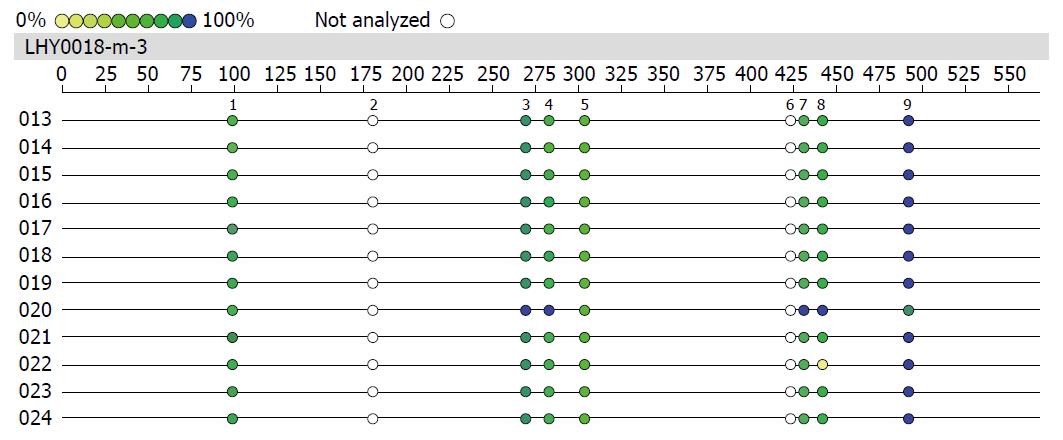
1.2.7 Sequenom MassArray甲基化检测: 使用亚硫酸盐将样本中DNA未甲基化的胞嘧啶(C)全部转化为尿嘧啶(U), 使用一对特殊引物PCR扩增样本, 得到带有T7RNA聚合酶启动子序列的扩增产物, 在体外转录体系中, 用T7RNA聚合酶将产物转录为RNA片段. 由于RNaseA能够特异性识别并切割RNA中U3'端, 将RNA片段切割成带有CpG位点的小片段, 最后在MassArray飞行质谱分析系统上检测产物的甲基化程度.
统计学处理 采用SPSS18.0统计软件进行统计学数据分析, 呈正态分布的计量资料以mean±SD表示并进行t检验, 计数资料组间比较采用χ2检验, 相关性分析采用Spearman相关分析. P<0.05为差异具有统计学意义.
与标准饮食组(C/DSS-和C/DSS+组)相比, 甲基供体缺乏饮食组(D/DSS-和D/DSS+组)的子代小鼠血清叶酸(8.87 nmol/L±1.11 nmol/L vs 11.34 nmol/L±0.31 nmol/L, P<0.01)和维生素B12(409.2 ng/L±56.27 ng/L vs 676.1 ng/L±51.66 ng/L, P<0.01)显著降低, 同型半胱氨酸(8.45±0.35 vs 6.77±0.36 μmol/L, P<0.01)显著增高, 以上差异均有统计学意义(表1).
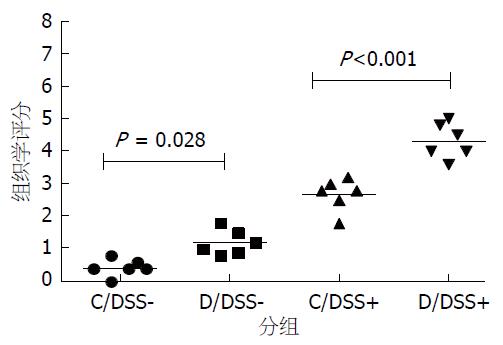
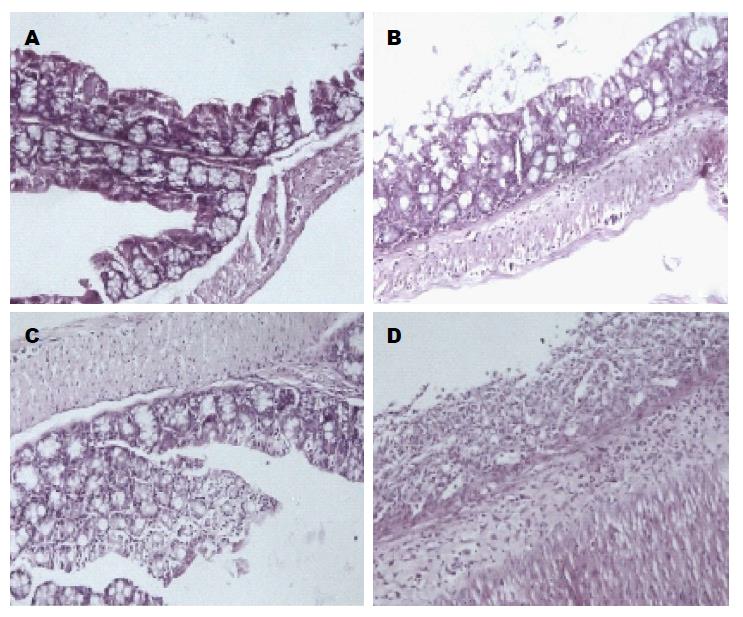
甲基供体缺乏饮食组的小鼠结肠黏膜炎症程度较高, 主要表现在D/DSS+组较C/DSS+组的DAI显著增高(3.22±0.55 vs 2.22±0.50, P<0.01); C/DSS+组较C/DSS-组的DAI高(0.97±0.25 vs 0.01±0.01, P<0.05); C/DSS-组和D/DSS-组的DAI无统计学差异(图1). 组织学评分发现, D/DSS-组评分高于C/DSS-组(1.19 vs 0.43, P<0.05), D/DSS+组明显高于C/DSS+组(4.30 vs 2.67, P<0.05, 图2, 图3).
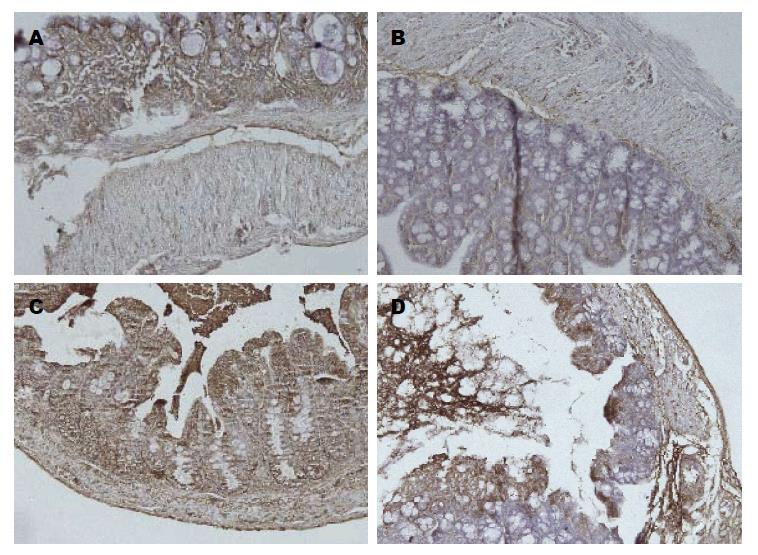
小鼠结肠黏膜组织中IFN-γ在C/DSS+和D/DSS+组表达较C/DSS-和D/DSS-组明显增高, 具有显著性差异(5.3±1.2 vs 10.6±10.8, χ2 = 14.517, P = 0.001, P<0.01), D/DSS+组与C/DSS+组比较, 差异有统计学意义(4.3±0.5 vs 11.7±9.6, χ2 = 6.791, P = 0.034, P<0.05, 图4). 且C/DSS+组和D/DSS+组的IFN-γ表达与DAI呈正相关(r = 0.853, 0.840; P = 0.031, 0.036; P<0.05).
溃疡性结肠炎是一种非特异性炎症性疾病, 为了有效预防疾病发生和探索有效治疗方案, 关于IBD发病机制的研究越来越多. 近年来, 许多观点认为溃疡性结肠炎的发病是机体与环境间相互作用的结果, 其中, 膳食营养在疾病发生发展中发挥重要作用. 以往的研究表明叶酸和维生素B12缺乏与子代低出生体质量、中心性肥胖、脂肪肝和心肌肥大相关[7], 饮食中叶酸缺乏可能是导致UC发病率增高的原因, 但叶酸是否参与其发病机制尙不明确[8]. 本研究结果表明在同样DSS诱导下, 母体孕期及哺乳期饮食中甲基供体缺乏可以使子代小鼠血清叶酸和维生素B12水平降低, 同型半胱氨酸升高. 在IBD患者中经常观察到高同型半胱氨酸血症[9], 同型半胱氨酸是叶酸和维生素B12缺乏的一种生物标志, 可以促进促炎细胞因子和趋化因子的分泌[10], 正常情况下, 同型半胱氨酸在叶酸和维生素B12的作用下合成蛋氨酸和四氢叶酸, 因此叶酸和维生素B12缺乏可以导致同型半胱氨酸升高.
IFN-γ是IBD等慢性炎症中重要的促炎因子[11]. 目前全基因组关联研究分析发现12q15位点的IFNG基因与UC发病有密切关系[12], 在此基础上, 本文对结肠黏膜IFN-γ表达和DAI进行了相关性分析, 结果显示IFN-γ与DAI正相关, 即IFN-γ可以一定程度上反映小鼠实验性结肠炎的严重程度. 母体孕期及哺乳期饮食中甲基供体缺乏, 可能通过结肠黏膜中IFN-γ表达增高的途径导致子鼠结肠黏膜炎症严重程度增加.
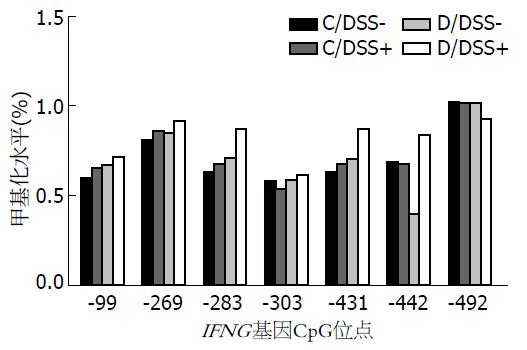
许多观点认为, DNA甲基化是人类复杂性自身免疫性疾病发生发展的重要影响因素. 在真核生物基因组中, DNA甲基化的过程是甲基供体SAM的甲基团通过DNMTS催化共价结合到CpG二核苷酸胞嘧啶环的碳5位点形成5-甲基胞嘧啶. 有研究报道, 实时定量PCR检测IBD患者LP-T细胞发现, IFN-γ基因DNA启动子区的甲基化水平降低5%可以导致IFN-γ表达水平增加3倍[13]. 为了研究甲基供体缺乏饮食加重实验性结肠炎的机制, 本实验检测了结肠黏膜中IFN-γ启动子区CpG的甲基化水平, 检测结果并未发现结肠组织IFNG甲基化水平有明显差异, 这可能是由膳食营养与DNA甲基化之间存在的组织特异性决定的, 因此通过饮食调整的DNA甲基化可能具有组织特异性[14]. 例如, 叶酸缺乏饮食的大鼠肝脏组织整体DNA低甲基化, 而脑组织高甲基化. 然而本实验只通过鼠的肠道组织提取DNA进行检测, 这就造成了实验结果有一定的局限性.
虽然本研究中母体甲基供体缺乏饮食并未导致子代小鼠IFNG基因启动子区CpG位点甲基化水平明显降低, 但是否存在其他影响溃疡性结肠炎发生发展的表观遗传学机制, 仍然值得进一步探讨.
目前研究发现在溃疡性结肠炎(ulcerative colitis, UC)患者中存在许多基因的异常甲基化, 因此UC可能由于DNA甲基化改变致病. 母鼠子宫中低叶酸会降低成年子鼠肠道总体甲基化水平. 炎症性肠病患者的干扰素-γ(interferon-γ, IFN-γ)甲基化水平在结肠黏膜中低于外周血T细胞.
目前研究表明叶酸缺乏可以加重UC发病, 补充叶酸可以治疗和缓解UC. DNA甲基化相关的膳食营养如何影响UC患者体内DNA甲基化水平, 通过什么通路或途径参与UC发病是亟待研究的问题.
对于DSS诱导的小鼠结肠炎模型, 使用甲基化抑制物可以加重结肠炎症程度, 然而补充叶酸后, 小鼠的结肠炎症反应得到改善. 但是并没有研究证实叶酸与UC的肠道某些基因的特异性甲基化有相关性, 如IFNG的甲基化.
本文将缺乏甲基供体的子代小鼠结肠炎模型造模成功, 证实了母体甲基供体的缺乏能够使子鼠体内IFN-γ表达增多, 加剧子代鼠实验性结肠炎, 但IFN-γ异常与IFNG基因启动子区CpG位点甲基化水平无相关性.
叶酸等靶向DNA甲基化的化合物将会成为一种有效、低廉、安全的预防和治疗UC的方法.
DNA甲基化: 表观遗传的修饰途径之一, 在真核生物中, 甲基供体S-腺苷甲硫氨酸的甲基团通过DNA甲基转移酶催化共价结合到CpG二核苷酸胞嘧啶环的碳5位点形成5-甲基胞嘧啶. 生物体甲基化的方式是稳定的, 可遗传的.
高峰, 主任医师, 新疆维吾尔自治区人民医院消化专业; 刘杰民, 副主任医师, 贵州省人民医院消化内镜科; 杨柏霖, 教授, 主任医师, 南京中医药大学附属医院肛肠科
本研究探讨母鼠饮食中甲基供体含量的缺乏是否可能通过影响IFN-γ基因的甲基化参与子代鼠溃疡性结肠炎发生及发展, 为溃疡性结肠炎在发病机制研究提供一种新思路.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑:马亚娟 电编:李瑞芳
| 1. | Chango A, Pogribny IP. Considering maternal dietary modulators for epigenetic regulation and programming of the fetal epigenome. Nutrients. 2015;7:2748-2770. [PubMed] [DOI] |
| 2. | Lillycrop KA, Burdge GC. Maternal diet as a modifier of offspring epigenetics. J Dev Orig Health Dis. 2015;6:88-95. [PubMed] [DOI] |
| 3. | McKay JA, Wong YK, Relton CL, Ford D, Mathers JC. Maternal folate supply and sex influence gene-specific DNA methylation in the fetal gut. Mol Nutr Food Res. 2011;55:1717-1723. [PubMed] [DOI] |
| 4. | Gallou-Kabani C, Vigé A, Gross MS, Junien C. Nutri-epigenomics: lifelong remodelling of our epigenomes by nutritional and metabolic factors and beyond. Clin Chem Lab Med. 2007;45:321-327. [PubMed] [DOI] |
| 5. | Wang L, Jiang X, Liu X, Qian T, Chu Y. Local immune compartments are related to the severity of dextran sodium sulphate induced colitis. Biosci Trends. 2014;8:242-247. [PubMed] [DOI] |
| 6. | Nagy-Szakal D, Mir SA, Ross MC, Tatevian N, Petrosino JF, Kellermayer R. Monotonous diets protect against acute colitis in mice: epidemiologic and therapeutic implications. J Pediatr Gastroenterol Nutr. 2013;56:544-550. [PubMed] [DOI] |
| 7. | Guéant JL, Namour F, Guéant-Rodriguez RM, Daval JL. Folate and fetal programming: a play in epigenomics? Trends Endocrinol Metab. 2013;24:279-289. [PubMed] [DOI] |
| 8. | Leddin D, Tamim H, Levy AR. Is folate involved in the pathogenesis of inflammatory bowel disease? Med Hypotheses. 2013;81:940-941. [PubMed] [DOI] |
| 9. | Oussalah A, Guéant JL, Peyrin-Biroulet L. Meta-analysis: hyperhomocysteinaemia in inflammatory bowel diseases. Aliment Pharmacol Ther. 2011;34:1173-1184. [PubMed] [DOI] |
| 10. | Robert K, Nehmé J, Bourdon E, Pivert G, Friguet B, Delcayre C, Delabar JM, Janel N. Cystathionine beta synthase deficiency promotes oxidative stress, fibrosis, and steatosis in mice liver. Gastroenterology. 2005;128:1405-1415. [PubMed] [DOI] |
| 11. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 12. | Silverberg MS, Cho JH, Rioux JD, McGovern DP, Wu J, Annese V, Achkar JP, Goyette P, Scott R, Xu W. Ulcerative colitis-risk loci on chromosomes 1p36 and 12q15 found by genome-wide association study. Nat Genet. 2009;41:216-220. [PubMed] [DOI] |
| 13. | Gonsky R, Deem RL, Targan SR. Distinct Methylation of IFNG in the Gut. J Interferon Cytokine Res. 2009;29:407-414. [PubMed] [DOI] |
| 14. | Maegawa S, Hinkal G, Kim HS, Shen L, Zhang L, Zhang J, Zhang N, Liang S, Donehower LA, Issa JP. Widespread and tissue specific age-related DNA methylation changes in mice. Genome Res. 2010;20:332-340. [PubMed] [DOI] |