修回日期: 2016-06-21
接受日期: 2016-06-27
在线出版日期: 2016-12-28
肠道菌群是目前研究的热点领域, 现有的研究结果提示: 肠道菌群可能与代谢性疾病、免疫性疾病、神经系统疾病、认知与行为失常、癌症等多种疾病相关. 本文检索和分析了近10余年来有关肠道菌群及其微环境与结直肠癌(colorectal cancer, CRC)关系的研究成果, 从肠道菌群及其微环境与CRC的定义、健康与CRC状态下的肠道菌群构成、肠道菌群的失调方式、肠道菌群微环境与CRC的相关性、肠道菌群微环境与CRC的病理生理机制等5个方面进行了综述, 期望能够为揭示肠道菌群微环境在CRC的发生与发展病理机制中的作用, 以及以肠道菌群微环境为靶向的、新的CRC预防和治疗手段的研发提供思路和线索.
核心提要: 通过改变不健康的饮食习惯或应用益生菌来恢复肠道菌群的生理平衡状态、调控肠道炎症的发生, 可能有益于对结直肠癌的预防和治疗.
引文著录: 秧茂盛, 周密. 肠道菌群微环境与结直肠癌的关系研究进展. 世界华人消化杂志 2016; 24(36): 4759-4765
Revised: June 21, 2016
Accepted: June 27, 2016
Published online: December 28, 2016
Intestinal flora is a hot research topic. Studies suggest that intestinal flora is associated with the development of metabolic diseases, autoimmune diseases, neurological disorders, cognitive and behavioral disorders, cancer and so on. In this paper, we retrieved and analyzed the literature published in the past ten years which studied the relationship between microbiota microenvironment and colorectal cancer. We discuss the definitions of intestinal flora, microbiota microenvironment and colorectal cancer, the composition of intestinal flora, imbalance of intestinal flora, correlation between microbiota microenvironment and colorectal cancer, and the pathophysiology of colorectal cancer associated with microbiota microenvironment, with an aim to reveal the role of intestinal flora microenvironment in the pathogenesis of colorectal cancer, and to provide ideas and clues for the development of new intestinal flora-targeted approaches for prevention and treatment of colorectal cancer.
- Citation: Yang MS, Zhou M. Relationship between intestinal flora microenvironment and colorectal cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(36): 4759-4765
- URL: https://www.wjgnet.com/1009-3079/full/v24/i36/4759.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i36.4759
肠道菌群是对寄居在人体肠道内微生物群落的总称, 是近年来微生物学和医学的研究热点之一. 肠道菌群与人体之间不仅是共存关系, 而且是对彼此具有重要影响的共生关系, 科学家们将其称之为人体的另一个器官[1-3]. 肠道菌群微环境是指在一定的结构空间内, 菌群及其代谢产物与宿主相互作用后, 形成的能独立进行物质、能量、信息交流的相对稳定的生物系统[4,5]. 肠道菌群微环境在促进食物的消化吸收、维持肠道正常生理功能、调节免疫及拮抗病原微生物等方面具有不可替代的重要作用[6-8]. 肠道在行使消化代谢功能的同时, 有一系列免疫调控机制来维持免疫耐受, 以阻止病原微生物通过肠道静脉系统进入全身血液循环. 正常情况下, 肠道黏膜能够屏障多种危险因素, 维持稳态. 一旦既有平衡被打破, 肠道微环境改变, 肠道微生物将会诱发炎症反应, 持续性的炎症刺激可损伤肠黏膜、黏膜下肌层, 甚至肠浆膜, 从而引起各种肠道疾病.
结直肠癌(colorectal cancer, CRC)是世界第三高发癌症, 严重影响着人类健康; 而且, 80%以上的CRC患者没有家族史、属于散发病例[9-11]. 也就是说, 环境因素很可能在大多数CRC的发生与发展上发挥着重要的作用. 肠道菌群微环境是否参与介导CRC的病理过程[12,13], 是一个很有趣的、重要的科学问题, 值得深入研究. 为此, 本文就近10余年来国内外有关肠道菌群微环境与CRC的关系研究进展作一综述, 期望可以为揭示肠道菌群微环境在CRC的发生与发展过程中的作用提供新的见解.
肠道菌群是指寄居机体胃肠道中的各种微生物的总称. 肠道菌群按一定的比例组合, 各菌种之间互相制约、互相依存, 在质和量上维持一种生态平衡. 人体肠道拥有数量庞大的微生物[14-16], 包括细菌、病毒、古生菌等; 其中, 又以细菌为主, 数量达到1014. 肠道菌群主要被分为3大类: (1)益生菌, 是指对身体健康有益处的细菌, 如双歧杆菌、乳酸杆菌等; (2)条件致病菌, 是指正常情况下不致病, 当肠道微环境改变或菌群平衡关系被打破时, 可以诱发疾病的细菌, 如大肠杆菌等; (3)致病菌, 是指正常情况下也能引起疾病的细菌, 如葡萄球菌、肺炎链球菌、奈瑟球菌等.
肠道菌群对维系机体的生存和健康具有不可或缺的重要作用. 已有的研究结果提示, 肠道菌群至少具有如下生理功能: (1)抑制致病菌的侵入, 调整人体与微生物之间的平衡状态, 维持机体肠道的健康或生理状态; (2)免疫功能, 肠道菌群可通过刺激宿主产生免疫反应, 抑制病原菌在肠内繁殖; (3)排毒功能, 肠道菌群可调节肠道的蠕动和水分的吸收, 促进大便和有害物质的排泄; (4)营养作用, 肠道菌群能够合成或促进营养物质的吸收; (5)肠道菌群可通过降解、清除体内的致癌因子以及激活体内的抗肿瘤细胞因子等方式来发挥其抗肿瘤作用; (6)肠道菌群可通过减少氧自由基的生成、控制炎症反应等途径来发挥其延缓衰老的功能.
肠道菌群微环境是指肠道菌群与宿主共同塑造的肠道免疫平衡微环境. 这个肠道免疫平衡微环境, 对互利共生的双方都具有重要的意义. 肠道菌群微环境处于生态平衡时, 益生菌群通过产生细菌素、抗生素和其他代谢产物, 以及通过争夺营养和生存空间来维持菌群微环境的稳态[6]. 当肠道菌群微环境平衡被打破, 进而引发免疫反应, 则可诱发肠易激综合征、克罗恩病、溃疡性结肠炎等疾病; 此外, 内分泌系统疾病、中枢神经系统疾病、类风湿性关节炎等疾病可能也与肠道菌群微环境的改变有关[17-19].
CRC是指发生在机体下消化系统结肠部位的恶性肿瘤, 绝大多数为腺癌, 好发于乙状结肠, 其次是盲肠与升结肠[20,21]. 由于社会环境与饮食文化的改变, CRC在我国的发病率显著增高, 目前位居恶性肿瘤的第4位; 长期的多油、高糖、高碳水化合物饮食与CRC的高风险密切相关[20,22]. 当肠道菌群微环境发生改变时, 可导致CRC的发生[14,23].
在机体肠道细菌样本中[24,25], 厚壁菌门和拟杆菌门是丰度最高的两大门类, 其次是放线菌门、变形菌门、梭杆菌门(表1). 在门的水平上, 健康与CRC状态下的肠道菌群样本之间存在明显差异[26,27]. 上述发现暗示, 肠道菌群的差异具有成为CRC预测或诊断指标的潜力.
| 分组 | 厚壁菌门 | 拟杆菌门 | 放线菌门 | 变形菌门 | 梭杆菌门 |
| 健康对照组 | 57.20 | 32.00 | 2.22 | 2.82 | 2.20 |
| 结肠癌组 | 63.10 | 22.70 | 4.55 | 4.68 | 1.59 |
当肠道发生早期癌前病变时, 肠道菌群就已经发生了显著性的改变[26,27]. CRC患者肠道菌群失调的一个显著特征是条件性致病菌的显著增加[17,24,28]. 例如: 在CRC患者的肠道中, 柔嫩梭菌、球形梭菌、致病性大肠杆菌的丰度要明显高于健康对照组. 此外, 肠道菌群失调的另一个显著特征是生产丁酸盐的菌种明显减少[17,24,29]. 现有的研究结果表明, 丁酸盐参与调控结肠上皮细胞的增殖和凋亡, 具有一定的降低肠道炎症和CRC发病风险的能力, 在维持肠道稳态中发挥着重要的作用; 随着条件性致病菌数量的增加, 益生菌(比如: 生产丁酸盐的菌种)数量的减少, 可显著提高CRC的发病风险[24,30]. 宿主肠道菌群的变化不仅出现在CRC的早期阶段, 而且贯穿CRC发生与发展的全过程[31-33]. 可见, 肠道菌群的改变可作为一种生物学指标: (1)可用于评估机体的健康状态; (2)可用于预测CRC的发病风险及其预后.
研究[34,35]表明, CRC患者肠道菌群的失调主要包括下列3种方式: (1)菌群结构的改变. 肠道菌群种类和数量在长期高糖、高脂饮食, 长期使用药物, 以及随着宿主年龄的增长等因素的影响下, 会导致肠道菌群构成发生明显变化, 原有的稳态受到破坏; (2)肠道菌群发生移位. 在肠道黏膜组织出现损伤或者宿主发生创伤、大出血、心源性休克或感染性休克等病理情况下, 肠道黏膜上皮细胞的通透性增加, 引起肠道菌群进入肠道组织内、甚至进入机体的血液循环中, 从而对机体产生局部或全身损害; (3)肠道菌群之间发生基因转移. 当肠道微环境发生变化时, 益生菌可通过基因转移途径转变成致病菌, 使得致病菌数量大增, 引发肠道菌群失调症.
CRC的发生与发展过程涉及众多环节, 目前对其病理机制的认识仍十分有限, 遗传背景、免疫状况、饮食习惯、环境因素等都可能与此有关[36-38]. 最近的动物实验结果提示, 肠道菌群失调可能是诱发CRC的关键因素之一[26], 进一步验证了"肠道菌群的改变可以促进CRC发生"的假说.
肠道中的微生物种类和数量众多, 参与宿主的糖、蛋白质、脂质、维生素等营养物质的代谢, 调控机体的免疫功能, 对维系宿主的健康发挥着不可代替的作用. 肠道菌群在肠道微环境中始终处于一种动态平衡状态, 一旦肠道菌群动态平衡状态被打破, 将引发各种疾病. 研究结果提示, CRC人群与健康人群肠道微生物构成存在差异[24], CRC的发生和发展与遗传、免疫、环境、饮食和生活习惯等风险因素有关, 但是CRC的确切病理机制目前尚不清楚.
来自动物的试验结果[17,26]表明, 无菌动物肠道炎症和CRC的发生率极低, 但一旦将失调的肠道菌群移植到无菌动物肠道内, 肠道炎症和CRC的发病率都会显著升高. 这些结果暗示: 肠道菌群的稳态是维系肠道健康的基础与保障, 证实了肠道菌群微环境与CRC之间的密切相关性. 然而, 上述结论尚缺乏来自人类的直接证据, 有待今后进一步的探索和深入研究.
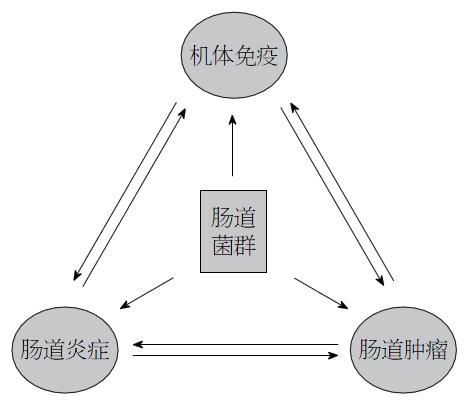
炎症、免疫、肿瘤之间存在着相互关联的"三角纽带"关系, 癌症的发生发展往往与炎症密切相关. 例如: 慢性肝炎与肝癌. 此外, 炎症的发生又往往伴随有免疫能力的改变; 而肠道菌群则在这一关系中发挥着"立交桥"式的功能(图1). 正常情况下, 免疫系统能及时发现并清理发生基因突变的细胞, 但在菌群微环境紊乱的情况下, 肠道免疫耐受被打破, 导致炎症的发生[39,40]. 肠道炎症可刺激炎性细胞及白介素(interleukin, IL)-6、IL-8、IL-17、IL-23、肿瘤坏死因子-α等炎性介质释放, 制造了一个免疫抑制、炎症持续激活的微环境, 通过其介导的细胞通路让肿瘤免疫失灵; 同时, 激活转录因子核因子-κB和STAT3, 激活微环境中与生长因子激活相关的Wnt等信号通路, 促进基因突变细胞的增殖[41-43]; 促炎症反应信号通路的异常激活, 加剧肠道黏膜上皮细胞的损伤, 进一步恶化肠道菌群微环境的破坏, 使肠道处于长期慢性炎症状态, 继而增加CRC的发生率. Wilson等[44]和Sester等[45]的最新研究结果表明, 免疫功能调节基因AIM2参与调控CRC的侵袭性、并介导菌群或病原体与宿主之间的相互作用. 进一步证实了免疫、菌群与肿瘤相互之间存在着密切的相关性.
研究发现失调菌群的代谢能力发生了改变, 并且能够释放多种细菌毒素. 例如: 硫化氢、次级胆汁酸. 硫化氢是肠道内硫酸盐还原菌降解有机物的代谢产物, 而CRC患者体内硫化氢含量明显高于健康个体[1,46,47]. 硫化氢可直接损伤肠道黏膜上皮细胞, 通过诱导DNA损伤、黏膜炎症、上皮细胞过度增长, 同时抑制丁酸盐的利用, 促进CRC的发生与发展. 次级胆汁酸[24]是7α脱羟基菌的代谢产物, 可促进炎症反应, 通过诱导肠道上皮细胞DNA损伤、诱导活性氧族的产生等方式来增加CRC的发病风险.
细菌毒素对肠道上皮细胞产生的毒性作用, 可诱发结肠炎等肠道疾病, 肠道屏障功能的损伤又会破坏免疫系统的稳态, 反复受损的、不能完全修复的黏膜上皮细胞就可发生癌变[36,48].
CRC是一种诱因和发病过程都十分复杂的疾病, 我们推测CRC的发生可能与多种肠道细菌及其微环境密切相关. 宿主的基因组相对稳定, 而肠道菌群的基因组则灵活多变; 通过改变不健康的饮食习惯、应用益生菌来平衡肠道菌群, 减少炎症发生, 可在一定程度上发挥预防或辅助治疗CRC的作用. 因此, 全面系统地研究肠道菌群微环境与CRC的相互关系, 可对CRC的预防、诊断、治疗和预后等产生重要的影响, 深入探讨肠道菌群微环境在CRC病理机制中的地位与作用, 将具有巨大理论和社会经济价值.
正常情况下, 依赖于肠道菌群微环境的稳定, 肠道可保持其免疫平衡状态; 但是当上述肠道菌群的稳定状态被打破后, 微生物就会在肠道引发长期慢性的炎症反应, 形成"损伤-修复-损伤"的恶性循环, 使肠道组织细胞出现病理损伤或癌变[39,49-51].
本文所涉及的研究均着眼于"在CRC的发生与发展过程中, 肠道菌群微环境发生了怎样的改变"以及"肠道菌群微环境的这种改变是如何影响CRC的发生与发展的"等两个主题. 我们相信, 如能彻底阐明上述的两个主题, 就可为CRC的预防、诊断、治疗和预后等提供新的思路和研发方向.
虽然对结直肠癌(colorectal cancer, CRC)的诊疗研究已取得了很大进展, 但有效的CRC预防和治愈方法仍然处在探索阶段. 近10余年来的研究结果表明: 肠道菌群微环境在CRC的自然发生过程中可能起着不可忽视的作用, 有可能成为CRC预防和治疗的新靶点.
最新的研究成果提示, 免疫功能调节基因可参与调控肿瘤的侵袭性, 并介导了宿主与菌群或病原体之间的相互作用. 进一步印证了免疫、菌群与肿瘤之间存在着密切关系, 值得深入研究.
本文系统阐述了肠道菌群微环境中肠道菌群失调、肠道炎症、肠道细菌毒素作用以及共生微生物失调等与CRC疾病进展的关系.
调节肠道菌群微环境、纠正肠道菌群失调、控制肠道炎症以及拮抗肠道细菌毒素作用, 在CRC的防治上具有潜在的应用前景.
肠道菌群: 是指寄居机体胃肠道中的各种微生物的总称;
肠道菌群微环境: 是指肠道菌群与宿主共同塑造的肠道免疫平衡微环境;
结直肠癌(CRC): 是指发生在机体下消化系统结肠部位的恶性肿瘤, 绝大多数为腺癌, 好发于乙状结肠, 其次是盲肠与升结肠.
王秀伶, 教授, 河北农业大学生命科学学院制药工程系; 陈淑珍, 研究员, 博士生导师, 中国协和医科大学•中国医学科学院医药生物技术研究所肿瘤室
肠道菌群是目前研究的热点, 本文对肠道菌群微环境与CRC的关系进行了较为全面的阐述, 作者紧扣肠道菌群和CRC的主题展开论述, 思路清晰, 书写流畅, 具有一定的理论意义和临床指导价值.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 于明茜 电编:胡珊
| 1. | Goodman AL, Gordon JI. Our unindicted coconspirators: human metabolism from a microbial perspective. Cell Metab. 2010;12:111-116. [PubMed] [DOI] |
| 2. | Pandey KR, Naik SR, Vakil BV. Probiotics, prebiotics and synbiotics- a review. J Food Sci Technol. 2015;52:7577-7587. [PubMed] [DOI] |
| 3. | Giannelli V, Di Gregorio V, Iebba V, Giusto M, Schippa S, Merli M, Thalheimer U. Microbiota and the gut-liver axis: bacterial translocation, inflammation and infection in cirrhosis. World J Gastroenterol. 2014;20:16795-16810. [PubMed] [DOI] |
| 4. | Larsen N, Vogensen FK, van den Berg FW, Nielsen DS, Andreasen AS, Pedersen BK, Al-Soud WA, Sørensen SJ, Hansen LH, Jakobsen M. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults. PLoS One. 2010;5:65. [PubMed] [DOI] |
| 5. | Li Y, Liu XY, Ma MM, Qi ZJ, Zhang XQ, Li Z, Cao GH, Li J, Zhu WW, Wang XZ. Changes in intestinal microflora in rats with acute respiratory distress syndrome. World J Gastroenterol. 2014;20:5849-5858. [PubMed] [DOI] |
| 6. | Biedermann L, Rogler G. The intestinal microbiota: its role in health and disease. Eur J Pediatr. 2015;174:151-167. [PubMed] [DOI] |
| 7. | Bellido F, Guinó E, Jagmohan-Changur S, Seguí N, Pineda M, Navarro M, Lázaro C, Blanco I, Vasen HF, Moreno V. Genetic variant in the telomerase gene modifies cancer risk in Lynch syndrome. Eur J Hum Genet. 2013;21:511-516. [PubMed] [DOI] |
| 8. | Donehower LA, Creighton CJ, Schultz N, Shinbrot E, Chang K, Gunaratne PH, Muzny D, Sander C, Hamilton SR, Gibbs RA. MLH1-silenced and non-silenced subgroups of hypermutated colorectal carcinomas have distinct mutational landscapes. J Pathol. 2013;229:99-110. [PubMed] [DOI] |
| 9. | Jobin C. Colorectal cancer: looking for answers in the microbiota. Cancer Discov. 2013;3:384-387. [PubMed] [DOI] |
| 10. | McCullough ML, Gapstur SM, Shah R, Jacobs EJ, Campbell PT. Association between red and processed meat intake and mortality among colorectal cancer survivors. J Clin Oncol. 2013;31:2773-2782. [PubMed] [DOI] |
| 11. | Kuiper JG, Phipps AI, Neuhouser ML, Chlebowski RT, Thomson CA, Irwin ML, Lane DS, Wactawski-Wende J, Hou L, Jackson RD. Recreational physical activity, body mass index, and survival in women with colorectal cancer. Cancer Causes Control. 2012;23:1939-1948. [PubMed] [DOI] |
| 12. | O'Callaghan NJ, Toden S, Bird AR, Topping DL, Fenech M, Conlon MA. Colonocyte telomere shortening is greater with dietary red meat than white meat and is attenuated by resistant starch. Clin Nutr. 2012;31:60-64. [PubMed] [DOI] |
| 13. | Chin CC, Kuo YH, Yeh CY, Chen JS, Tang R, Changchien CR, Wang JY, Huang WS. Role of body mass index in colon cancer patients in Taiwan. World J Gastroenterol. 2012;18:4191-4198. [PubMed] [DOI] |
| 14. | Jawad N, Direkze N, Leedham SJ. Inflammatory bowel disease and colon cancer. Recent Results Cancer Res. 2011;185:99-115. [PubMed] [DOI] |
| 15. | Terzić J, Grivennikov S, Karin E, Karin M. Inflammation and colon cancer. Gastroenterology. 2010;138:2101-2114.e5. [PubMed] [DOI] |
| 16. | Meyerhardt JA, Sato K, Niedzwiecki D, Ye C, Saltz LB, Mayer RJ, Mowat RB, Whittom R, Hantel A, Benson A. Dietary glycemic load and cancer recurrence and survival in patients with stage III colon cancer: findings from CALGB 89803. J Natl Cancer Inst. 2012;104:1702-1711. [PubMed] [DOI] |
| 17. | Szabo G, Bala S, Petrasek J, Gattu A. Gut-liver axis and sensing microbes. Dig Dis. 2010;28:737-744. [PubMed] [DOI] |
| 18. | Colussi D, Brandi G, Bazzoli F, Ricciardiello L. Molecular pathways involved in colorectal cancer: implications for disease behavior and prevention. Int J Mol Sci. 2013;14:16365-16385. [PubMed] [DOI] |
| 19. | Sobhani I, Tap J, Roudot-Thoraval F, Roperch JP, Letulle S, Langella P, Corthier G, Tran Van Nhieu J, Furet JP. Microbial dysbiosis in colorectal cancer (CRC) patients. PLoS One. 2011;6:e16393. [PubMed] [DOI] |
| 20. | Dahm CC, Keogh RH, Spencer EA, Greenwood DC, Key TJ, Fentiman IS, Shipley MJ, Brunner EJ, Cade JE, Burley VJ. Dietary fiber and colorectal cancer risk: a nested case-control study using food diaries. J Natl Cancer Inst. 2010;102:614-626. [PubMed] [DOI] |
| 21. | Fadhil W, Ibrahem S, Seth R, AbuAli G, Ragunath K, Kaye P, Ilyas M. The utility of diagnostic biopsy specimens for predictive molecular testing in colorectal cancer. Histopathology. 2012;61:1117-1124. [PubMed] [DOI] |
| 22. | Dovitinib synergizes with oxaliplatin in suppressing cell proliferation and inducing apoptosis in colorectal cancer cells regardless of RAS-RAF mutation status. Mol Cancer. 2014;13:21. [PubMed] [DOI] |
| 23. | Zoratto F, Rossi L, Verrico M, Papa A, Basso E, Zullo A, Tomao L, Romiti A, Lo Russo G, Tomao S. Focus on genetic and epigenetic events of colorectal cancer pathogenesis: implications for molecular diagnosis. Tumour Biol. 2014;35:6195-6206. [PubMed] [DOI] |
| 25. | Abraham RM, Zhang Q, Odum N, Wasik MA. The role of cytokine signaling in the pathogenesis of cutaneous T-cell lymphoma. Cancer Biol Ther. 2011;12:1019-1022. [PubMed] [DOI] |
| 26. | Zhu Q, Jin Z, Wu W, Gao R, Guo B, Gao Z, Yang Y, Qin H. Analysis of the intestinal lumen microbiota in an animal model of colorectal cancer. PLoS One. 2014;9:e90849. [PubMed] [DOI] |
| 27. | Ponzoni M, Ferreri AJ, Mappa S, Pasini E, Govi S, Facchetti F, Fanoni D, Tucci A, Vino A, Doglioni C. Prevalence of Borrelia burgdorferi infection in a series of 98 primary cutaneous lymphomas. Oncologist. 2011;16:1582-1588. [PubMed] [DOI] |
| 28. | Castillo-Carranza DL, Lasagna-Reeves CA, Kayed R. Tau aggregates as immunotherapeutic targets. Front Biosci (Schol Ed). 2013;5:426-438. [PubMed] [DOI] |
| 29. | Huang Y, Mucke L. Alzheimer mechanisms and therapeutic strategies. Cell. 2012;148:1204-1222. [PubMed] [DOI] |
| 30. | Potter H, Wisniewski T. Apolipoprotein e: essential catalyst of the Alzheimer amyloid cascade. Int J Alzheimers Dis. 2012;2012:489428. [PubMed] [DOI] |
| 31. | Chong ES. A potential role of probiotics in colorectal cancer prevention: review of possible mechanisms of action. World J Microbiol Biotechnol. 2014;30:351-374. [PubMed] [DOI] |
| 32. | Bazett M, Haston CK. Airway hyperresponsiveness in FVB/N delta F508 cystic fibrosis transmembrane conductance regulator mice. J Cyst Fibros. 2014;13:378-383. [PubMed] [DOI] |
| 33. | Dekkers JF, Wiegerinck CL, de Jonge HR, Bronsveld I, Janssens HM, de Winter-de Groot KM, Brandsma AM, de Jong NW, Bijvelds MJ, Scholte BJ. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nat Med. 2013;19:939-945. [PubMed] [DOI] |
| 34. | Tomasello G, Tralongo P, Damiani P, Sinagra E, Di Trapani B, Zeenny MN, Hussein IH, Jurjus A, Leone A. Dismicrobism in inflammatory bowel disease and colorectal cancer: changes in response of colocytes. World J Gastroenterol. 2014;20:18121-18130. [PubMed] [DOI] |
| 35. | Coyte KZ, Schluter J, Foster KR. The ecology of the microbiome: Networks, competition, and stability. Science. 2015;350:663-666. [PubMed] [DOI] |
| 36. | Heinig RL, Paaijmans KP, Hancock PA, Thomas MB. The potential for fungal biopesticides to reduce malaria transmission under diverse environmental conditions. J Appl Ecol. 2015;52:1558-1566. [PubMed] [DOI] |
| 37. | Edgar RC, Haas BJ, Clemente JC, Quince C, Knight R. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics. 2011;27:2194-2200. [PubMed] [DOI] |
| 38. | Hoffman LR, Pope CE, Hayden HS, Heltshe S, Levy R, McNamara S, Jacobs MA, Rohmer L, Radey M, Ramsey BW. Escherichia coli dysbiosis correlates with gastrointestinal dysfunction in children with cystic fibrosis. Clin Infect Dis. 2014;58:396-399. [PubMed] [DOI] |
| 39. | Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell. 2010;140:883-899. [PubMed] [DOI] |
| 40. | Rehman A, Sina C, Gavrilova O, Häsler R, Ott S, Baines JF, Schreiber S, Rosenstiel P. Nod2 is essential for temporal development of intestinal microbial communities. Gut. 2011;60:1354-1362. [PubMed] [DOI] |
| 41. | Fukata M, Abreu MT. Pathogen recognition receptors, cancer and inflammation in the gut. Curr Opin Pharmacol. 2009;9:680-687. [PubMed] [DOI] |
| 42. | Kahouli I, Tomaro-Duchesneau C, Prakash S. Probiotics in colorectal cancer (CRC) with emphasis on mechanisms of action and current perspectives. J Med Microbiol. 2013;62:1107-1123. [PubMed] [DOI] |
| 43. | Alkadhi S, Kunde D, Cheluvappa R, Randall-Demllo S, Eri R. The murine appendiceal microbiome is altered in spontaneous colitis and its pathological progression. Gut Pathog. 2014;6:25. [PubMed] [DOI] |
| 44. | Wilson JE, Petrucelli AS, Chen L, Koblansky AA, Truax AD, Oyama Y, Rogers AB, Brickey WJ, Wang Y, Schneider M. Inflammasome-independent role of AIM2 in suppressing colon tumorigenesis via DNA-PK and Akt. Nat Med. 2015;21:906-913. [PubMed] [DOI] |
| 45. | Sester DP, Sagulenko V, Thygesen SJ, Cridland JA, Loi YS, Cridland SO, Masters SL, Genske U, Hornung V, Andoniou CE. Deficient NLRP3 and AIM2 Inflammasome Function in Autoimmune NZB Mice. J Immunol. 2015;195:1233-1241. [PubMed] [DOI] |
| 46. | Brunden KR, Yao Y, Potuzak JS, Ferrer NI, Ballatore C, James MJ, Hogan AM, Trojanowski JQ, Smith AB, Lee VM. The characterization of microtubule-stabilizing drugs as possible therapeutic agents for Alzheimer's disease and related tauopathies. Pharmacol Res. 2011;63:341-351. [PubMed] [DOI] |
| 47. | Figueira ML, Ouakinin S. Gender-related endocrinological dysfunction and mental disorders. Curr Opin Psychiatry. 2010;23:369-372. [PubMed] [DOI] |
| 48. | Tellefsen CH, Vogt C. How important is placental examination in cases of perinatal deaths? Pediatr Dev Pathol. 2011;14:99-104. [PubMed] [DOI] |
| 49. | Chang KT, Keating S, Costa S, Machin G, Kingdom J, Shannon P. Third-trimester stillbirths: correlative neuropathology and placental pathology. Pediatr Dev Pathol. 2011;14:345-352. [PubMed] [DOI] |