修回日期: 2016-07-29
接受日期: 2016-08-01
在线出版日期: 2016-09-08
探究小鼠酒精性肝损伤中的病理表现.
健康昆明小鼠♂30只, 随机分为对照组(n = 10), 模型组(n = 20), 对照组于0 wk处死, 取肝脏; 模型组进行适应性喂养1 wk后, 给予56度白酒灌胃(0.15 ml/20 g•d), 连续8 wk, 于4 wk和8 wk, 颈椎脱臼处死小鼠, 取其肝脏待用, 制备石蜡切片和冰冻切片, 采用HE染色和油红O染色, 观察酒精性肝损伤中的脂滴表达变化, 采用Image-ProPlus6.0对病理切片样本进行累计光密度(integral optical density, IOD)定量分析.
与对照组比较, 第4周脂滴含量开始增加(20.29±7.07 vs 8.06±2.06, P<0.01), 第8周末脂滴含量明显增多(34.88±15.33 vs 8.06±2.06, P<0.01), 8 wk与4 wk相比, 脂滴的表达量呈上升趋势(34.88±15.33 vs 20.29±7.07, P<0.05).
8 wk末成功建立了酒精性脂肪肝模型, 可以用来评估酒精性脂肪肝治疗药物的预后作用; 在小鼠酒精性肝损伤中, 随着脂肪变性的发生, 脂滴含量不断增加.
核心提要: 小鼠酒精性肝损伤过程中肝组织脂滴的变化与肝细胞的凋亡有密切关系. 实验通过酒精诱导的慢性肝脏损伤动物模型, 观察并分析得出脂滴的表达变化, 随着脂肪变性的发生呈上升趋势, 并与肝脏的损伤修复密切相关, 对今后研究酒精性肝病的发生发展有一定理论意义.
引文著录: 卢华杰, 李三强, 张勇勇, 王善龙, 乔新杰, 霍旭磊, 李小苹, 侯松林. 脂滴在小鼠酒精性肝损伤过程中的表达变化. 世界华人消化杂志 2016; 24(25): 3683-3688
Revised: July 29, 2016
Accepted: August 1, 2016
Published online: September 8, 2016
To investigate the pathological changes in the process of alcoholic liver injury.
Thirty healthy male Kunming mice were randomly divided into a control group (n = 10) and a model group (n = 20). The control group was executed to take the liver tissue at 0 wk. The model group was treated with alcohol of 56 degrees (0.15 ml/20 g•d) for 8 wk, and then executed to take the liver tissue at four and 8 wk. The expression changes of lipid droplets during alcoholic liver injury were assessed by hematoxylin and eosin staining and oil red O staining. The integral optical density of histology samples was analyzed with Image-ProPlus6.0 software.
The content of lipid drops began to increase at 4 wk (20.29 ± 7.07 vs 8.06 ± 2.06, P < 0.01), and significantly increased at 8 wk (34.88 ± 15.33 vs 8.06 ± 2.06, P < 0.01). Compared to that at 4 wk, the amount of expression of lipid droplets showed a rising trend at 8 wk (34.88 ± 15.33 vs 20.29 ± 7.07, P < 0.05).
The levels of lipid droplets show a growing trend along with the aggravation of hepatic steatosis during alcoholic liver injury in mice.
- Citation: Lu HJ, Li SQ, Zhang YY, Wang SL, Qiao XJ, Huo XL, Li XP, Hou SL. Expression changes of lipid droplets during alcohol-induced liver injury in mice. Shijie Huaren Xiaohua Zazhi 2016; 24(25): 3683-3688
- URL: https://www.wjgnet.com/1009-3079/full/v24/i25/3683.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i25.3683
酒精依赖被认为是一个世界性的公共卫生问题, 与酒精性肝病的发生发展有直接因果关系. 随着社会的发展, 酒精性肝病成为世界范围内发病率和死亡率持续攀升的主要原因之一, 临床上主要包括: 脂肪肝、酒精性肝炎、酒精性肝纤维化、酒精性肝硬化、肝细胞癌(hepatocellular carcinoma, HCC)[1]. 大约60%-90%的人, 每天饮酒超过60 g, 已经被证实有脂肪变性[2]. 近年来人们生活水平提高, 在国内, 酒精性肝脏疾病的发病率呈现年轻化及上升趋势[3]. 其发病原因比较复杂, 包括炎症反应、氧自由基、凋亡等. 其中, 细胞凋亡在慢性肝病的发病机制中扮演重要角色[4]. 脂肪肝变性是酒精性肝病的最早最普遍的表现, 最终可能进展为脂肪肝. 本实验主要通过小鼠酒精灌胃来模拟人类酒精性肝损伤, 并对肝组织进行油红O染色和定量分析, 旨在观察在肝脏损伤的各个阶段发展过程中, 肝细胞内脂滴表达的变化规律.
SPF级昆明小鼠♂30只, 体质量20 g±5 g, 河南省实验动物科研中心提供, 许可证号: SCXK(豫)2015-0004. 56度北京红星二锅头(生产于北京红星股份有限公司); 油红O(北京索莱宝科技有限公司); 伊红(北京索莱宝科技有限公司); 多聚赖氨酸(北京索莱宝科技有限公司). 载玻片(江苏世泰实验器材有限公司); 石蜡切片机(德国Leica); 切片石蜡(上海标本模型厂); Motic 102M光学显微镜, Moticam Pro 285A显微照相机(生产于麦克奥迪中国实业有限公司); DW-HW50 -80 ℃超低温冰箱(购自中科美菱低温科技有限公司).
1.2.1 小鼠酒精性肝损伤模型的建立及取材: 健康♂小鼠30只, 随机分为对照组(n = 10), 模型组(n = 20), 每天给予正常饮食饮水, 0 wk颈椎脱臼处死对照组, 取肝脏备用; 饲养1 wk后, 模型组进行酒精灌胃, 每日1次, 每次0.15 mL/20 g, 分别于第4周和第8周取材, 备用.
1.2.2 HE染色观察各组小鼠酒精性肝损伤过程中肝组织的病理学变化: 取各组肝组织于10%中性甲醛固定, 常规步骤制作石蜡切片; 切片厚度5 μm, 捞片, 烤片; 常规脱蜡至水, 并进行苏木素染液2 min, 盐酸酒精分化30 s, 自来水返蓝, 伊红染液1 min, 蒸馏水洗3 min, 乙醇梯度酒精脱水, 二甲苯透明, 中性树胶封片, 拍照.
1.2.3 油红染色检测各组小鼠酒精性肝损伤过程中脂滴的表达变化: 取各组小鼠肝组织于液氮环境固定, 并制作冰冻切片, 厚度10 μm, 将切片置于涂有多聚赖氨酸的载玻片上, 并放入10%的甲醛固定液中, 固定10 min; 用蒸馏水稍洗, 待切片干燥, 将切片置于油红工作液中浸染8-10 min; 用60%乙醇分色; 蒸馏水稍洗; 苏木素淡染细胞核30 s; 自来水泛蓝; 用滤纸把周围水分吸干, 甘油明胶封片; 在光学显微镜下观察各组肝组织中脂滴含量的变化, 并按照照相软件统一参数进行拍照, 运用Image-ProPlus6.0软件对图片进行分析.
统计学处理 运用SPSS16.0软件对数据进行分析, 资料以mean±SD表示, 多组间的比较用ANOVA分析, 以P<0.05为差异具有统计学意义, P<0.01为差异具有显著统计学意义.
对照组小鼠精神状态良好, 皮毛有光泽, 行动轻便灵活, 进食量及大便正常; 模型组小鼠表现精神萎靡、活动量减少、消瘦、皮毛粗糙和缺少光泽, 到第4周共有5只死亡, 其中4只死于夜间, 1只于灌胃后表现呼吸急促、眼球放大, 最终死亡, 到第8周又有3只死亡, 1只死于晚上, 有被撕咬痕迹, 另外2只于灌胃后, 次日早上出现腹部膨隆, 呼吸困难而死.
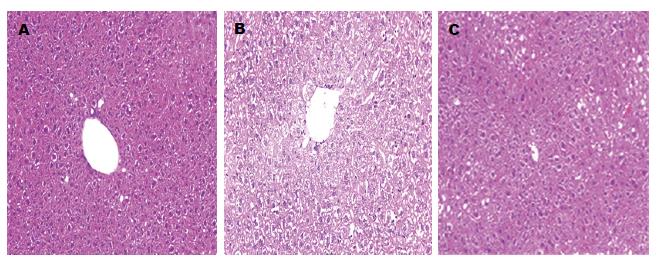
2.2.1 HE染色结果: 对照组在光学显微镜下, 肝脏形态结构完整, 肝小叶清晰可见, 肝细胞核排列整齐, 位于细胞中央, 肝索围绕中央静脉呈放射状排列(图1A); 模型组分为4 wk和8 wk, 其中4 wk时可见肝细胞核固缩, 并且排列紊乱, 胞质和胞核间空隙增大, 出现水样变, 部分可见炎症细胞浸润, 有局部灶状坏死, 并有脂肪空泡的形成(图1B); 当造模到第8周时, 可见肝细胞内出现大量的圆形脂肪空泡, 与4 wk相比明显增多, 肝小叶轮廓不清晰, 胞核被挤到一侧, 部分区域可见肝细胞核的再生和气球样变(图1C).
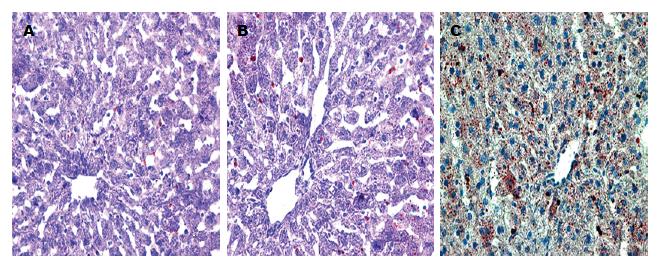
2.2.2 油红染色结果: 对照组在光学显微镜下观察可见肝细胞轮廓清晰, 肝索排列整齐, 呈射线状, 细胞内呈现的红色脂肪颗粒极少(图2A); 模型组(4 wk)可见红色脂肪颗粒有所增多, 汇管区出现炎症细胞浸润(图2B), 模型组(8 wk)可见肝细胞核出现明显水肿, 围绕中央静脉有炎细胞的浸润, 出现较多的红色脂肪颗粒聚集(图2C).
油红染色是反应肝细胞内脂肪含量高低的常用指标. 通过运用Image-Pro-Plus16.0软件对其表达的红色颗粒的累计光密度的测量, 并用SPSS16.0对其数据进行统计分析. 在小鼠酒精性肝损伤中, 对照组脂滴含量极低, 在第4周和第8周脂滴表达开始增多(20.29±7.07, 34.88±15.33 vs 8.06±2.06, P<0.01), 模型组8 wk与4 wk相比, 脂滴的表达量呈上升趋势.
酒精性肝病是长期饮酒导致的肝脏疾病, 生理条件下, 仅有一部分乙醇(10%)通过细胞色素P4502E1(CYP2E1)氧化为乙醛[4-8], 细胞的抗氧化能力, 是可以与产生的活性氧(reactive oxygen species, ROS)相抗衡的, 但长期酒精滥用, 可使CYP2E1表达增多, 从而使ROS产生增多, 一方面加速酒精的消除, 另外也破坏肝细胞的组织结构, 导致肝细胞损伤, 进而引起肝细胞脂肪变性[9,10]. 脂肪变性可能进展为脂肪肝, 脂肪肝的特点是肝细胞损伤, 炎症和纤维化. 并且随着脂肪变性加重, 细胞凋亡和肝纤维化程度也会增加[11]. 本实验采用56度白酒灌胃, 这种造模方式更符合人类的饮酒习惯, 能更好地模拟人类酒精性肝损伤.
酒精性肝病是一种进展性疾病, 在早期病理变化为肝细胞氧化损伤, 进一步可进展为酒精性脂肪肝, 到晚期则无法治愈, 因而在氧化损伤之前干预有重要作用[12-14]. 另外, 酒精过量摄入可造成肝细胞线粒体功能受损, 过氧化物酶增殖体的表达被抑制, 进一步抑制肝脏脂类的氧化利用, 最终导致肝脏TG沉积, 诱发脂代谢紊乱, 发生脂肪变性[15-17]. 该实验中采用HE染色和制作冰冻切片进行油红染色来观察及分析酒精性肝损伤中的脂滴变化规律, 显微镜下观, 模型组可见大量的圆的脂肪颗粒聚集, 并有大量炎细胞浸润, 肝细胞形态不规整. 而且冰冻切片制作方便, 可以节省时间, 病理切片也能更直观反映肝细胞的病理变化. 乙醇可能诱导了相关肝细胞炎症因子的表达增多, 促进了脂肪变性的发生, 该实验结果也与国内外的文献一致[18-22].
在酒精诱导的肝损伤模型中, LPS通过激活TLR-4表达, 激活下游信号通路, 最终激活转录因子, 如: 核因子-κB, 激活子蛋白-1, 进而诱发肝细胞炎症, 主要表现为肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白细胞介素-6、单核细胞趋化蛋白-1的释放[23-25]; TNF-α是酒精性肝损伤发生和发展的重要因素, 已有文献报道[26]TNF-α诱导了ROS的增加, 促使氧化应激发生, 在酒精性脂肪肝的发病历程中起到促进作用[27-29]; 在正常肝脏组织中, 脂质代谢保持一种稳定的平衡状态, 当肝脏长期遭受酒精的刺激, 就会打破这种平衡状态, 导致肝细胞内过多的脂肪积累, 增加肝脏负荷, 最终引起脂肪变性和酒精性肝损伤. 在该实验中, 肉眼观察可见对照组肝脏呈现鲜红色, 肝脏边缘较锐, 表面光滑; 模型组肝脏出现肿大, 颜色呈现暗红色, 肝脏边缘较钝, 表面出现白点, 缺少光泽. 油红染色结果提示, 模型组出现肝组织结构疏松和脂肪沉积, 提示随着脂肪变性的发生发展, 脂滴含量呈上升趋势, 并在第8周成功建立酒精性脂肪肝模型. 也有文献报道, 酒精刺激使小鼠肝细胞内磷酯酰肌醇3激酶(phosphoinositide-3-kinase, PI3K)及骨桥蛋白(osteopontin, OPN)表达增多, 而OPN和PI3K可能在肝组织脂肪变的发生发展中扮演重要角色[30,31]; 脂肪变性也可能与CYP2E1表达增多有关, 但具体影响机制尚需要进一步研究.
总之, 本实验通过酒精诱导的小鼠酒精性肝损伤模型, 观察分析得出随着脂肪变性发生, 脂滴含量呈现上升趋势, 并与肝脏的损伤修复密切相关, 对今后研究酒精性肝损伤的预防与治疗的关系有一定理论意义.
近年来随着经济社会发展, 人们生活压力增加, 酗酒的人数越来越多, 因而由酒精造成的肝损伤也在不断增多. 酒精性肝病已经成为继病毒性肝炎之后导致肝硬化肝癌的第二大病因. 肝细胞损伤是酒精性肝病的病理基础, 因此研究慢性酒精性肝损伤中的病理变化可为临床用药打下基础.
迟宝荣, 教授, 吉林大学第一医院消化内科
酒精性肝损伤的发病机制, 细胞凋亡, 治疗与预后是研究的热点, 但关于酒精性肝损伤后肝细胞的脂肪变及肝细胞的自我修复机制尚待研究.
王东风在D-柠檬烯对大鼠酒精性肝损伤脂质代谢紊乱的影响, 一文中提出"脂质代谢紊乱及脂肪变性是酒精性肝损伤的早期特征, 研究表明肿瘤坏死因子-α在酒精性肝损伤发病中起到促进作用", 为本文的研究提供了理论依据.
本文着重研究脂滴在酒精性肝损伤中的含量表达变化, 实验结果表明脂滴的含量变化与肝脏组织的损伤与修复密切相关, 但具体分子机制尚需进一步研究.
酒精性肝损伤早期变性出脂肪变性, 最终进展为脂肪肝, 而脂肪肝的特点是肝细胞损伤, 炎症和纤维化. 并且随着脂肪变性加重, 细胞凋亡和肝纤维化程度也会增加. 因此研究肝损伤早期脂滴的变化规律对于临床上及时阻断酒精性肝病的进展有重要参考价值.
脂肪变性: 指除脂肪细胞外的实质细胞内出现脂滴或脂滴明显增多的现象, 脂滴主要是中性脂肪, 也可有磷脂或胆固醇等.
本文成功建立了酒精性脂肪肝的小鼠模型, 试验设计合理, 书写规范, 图文并茂, 通过病理学的分析, 在一定程度上可反映脂滴在慢性酒精性肝损伤过程中的变化规律.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Miller AM, Horiguchi N, Jeong WI, Radaeva S, Gao B. Molecular mechanisms of alcoholic liver disease: innate immunity and cytokines. Alcohol Clin Exp Res. 2011;35:787-793. [PubMed] [DOI] |
| 2. | Becker U, Deis A, Sørensen TI, Grønbaek M, Borch-Johnsen K, Müller CF, Schnohr P, Jensen G. Prediction of risk of liver disease by alcohol intake, sex, and age: a prospective population study. Hepatology. 1996;23:1025-1029. [PubMed] [DOI] |
| 4. | Miranda-Mendez A, Lugo-Baruqui A, Armendariz-Borunda J. Molecular basis and current treatment for alcoholic liver disease. Int J Environ Res Public Health. 2010;7:1872-1888. [PubMed] [DOI] |
| 5. | Bruha R, Dvorak K, Petrtyl J. Alcoholic liver disease. World J Hepatol. 2012;4:81-90. [PubMed] [DOI] |
| 6. | Bell LN, Temm CJ, Saxena R, Vuppalanchi R, Schauer P, Rabinovitz M, Krasinskas A, Chalasani N, Mattar SG. Bariatric surgery-induced weight loss reduces hepatic lipid peroxidation levels and affects hepatic cytochrome P-450 protein content. Ann Surg. 2010;251:1041-1048. [PubMed] [DOI] |
| 7. | Jaeschke H. Inflammation in response to hepatocellular apoptosis. Hepatology. 2002;35:964-966. [PubMed] [DOI] |
| 9. | Kong L, Ren W, Li W, Zhao S, Mi H, Wang R, Zhang Y, Wu W, Nan Y, Yu J. Activation of peroxisome proliferator activated receptor alpha ameliorates ethanol induced steatohepatitis in mice. Lipids Health Dis. 2011;10:246. [PubMed] [DOI] |
| 10. | Larter CZ, Yeh MM, Van Rooyen DM, Brooling J, Ghatora K, Farrell GC. Peroxisome proliferator-activated receptor-α agonist, Wy 14, 643, improves metabolic indices, steatosis and ballooning in diabetic mice with non-alcoholic steatohepatitis. J Gastroenterol Hepatol. 2012;27:341-350. [PubMed] [DOI] |
| 13. | Wang Y, Liu Y, Kirpich I, Ma Z, Wang C, Zhang M, Suttles J, McClain C, Feng W. Lactobacillus rhamnosus GG reduces hepatic TNFα production and inflammation in chronic alcohol-induced liver injury. J Nutr Biochem. 2013;24:1609-1615. [PubMed] [DOI] |
| 14. | Bertola A, Park O, Gao B. Chronic plus binge ethanol feeding synergistically induces neutrophil infiltration and liver injury in mice: a critical role for E-selectin. Hepatology. 2013;58:1814-1823. [PubMed] [DOI] |
| 15. | Xu R, Huang H, Zhang Z, Wang FS. The role of neutrophils in the development of liver diseases. Cell Mol Immunol. 2014;11:224-231. [PubMed] [DOI] |
| 16. | Meadows GG, Zhang H. Effects of Alcohol on Tumor Growth, Metastasis, Immune Response, and Host Survival. Alcohol Res. 2015;37:311-322. [PubMed] |
| 17. | 韩 向晖, 陈 珺明, 张 莉, 王 淼, 王 磊, 郑 培永, 季 光. 清肝活血方对酒精性肝损伤大鼠内质网应激反应性凋亡基因表达的影响. 世界华人消化杂志. 2009;17:1279-1285. [DOI] |
| 19. | Szabo G. Gut-liver axis in alcoholic liver disease. Gastroenterology. 2015;148:30-36. [PubMed] [DOI] |
| 20. | Bala S, Marcos M, Gattu A, Catalano D, Szabo G. Acute binge drinking increases serum endotoxin and bacterial DNA levels in healthy individuals. PLoS One. 2014;9:e96864. [PubMed] [DOI] |
| 21. | Byun JS, Jeong WI. Involvement of hepatic innate immunity in alcoholic liver disease. Immune Netw. 2010;10:181-187. [PubMed] [DOI] |
| 22. | Sahai A, Pan X, Paul R, Malladi P, Kohli R, Whitington PF. Roles of phosphatidylinositol 3-kinase and osteopontin in steatosis and aminotransferase release by hepatocytes treated with methionine-choline-deficient medium. Am J Physiol Gastrointest Liver Physiol. 2006;291:G55-G62. [PubMed] [DOI] |
| 27. | Szabo G, Petrasek J. Inflammasome activation and function in liver disease. Nat Rev Gastroenterol Hepatol. 2015;12:387-400. [PubMed] [DOI] |
| 28. | Wang HJ, Gao B, Zakhari S, Nagy LE. Inflammation in alcoholic liver disease. Annu Rev Nutr. 2012;32:343-368. [PubMed] [DOI] |
| 29. | Donohue TM. Alcohol-induced steatosis in liver cells. World J Gastroenterol. 2007;13:4974-4978. [PubMed] [DOI] |