修回日期: 2015-10-07
接受日期: 2015-10-12
在线出版日期: 2015-10-28
目的: 观察骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs)在刀豆蛋白A(concanavalin A, ConA)诱导小鼠急性肝损伤中的治疗效果, 并对其可能的治疗机制进行探讨.
方法: 将C57BL/6小鼠的股骨骨髓进行分离、培养、鉴定并体外标记获得BMMSCs; 小鼠尾静脉注射不同浓度ConA, 选择最适剂量建立急性肝损伤模型; 小鼠模型分别经尾静脉注射移植不同剂量(1×105、5×105、1×106、1×107)的氯甲基苯甲酰胺(CM-Dil)标记的BMMSCs, 对照组给予等量磷酸盐缓冲液. 治疗后24 h检测血清样本中谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)的水平, 酶联免疫吸附分析法检测血清中肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、干扰素γ(interferon-γ, IFN-γ)及白介素-4(interleukin-4, IL-4)的水平, 取肝脏的病理, 荧光显微镜下观察BMMSCs在肝组织内的定植情况, 并进行肝脏炎症活动度Knodell评分.
结果: 小鼠BMMSCs体外培养及鉴定后符合BMMSCs的特征, CM-DiL体外标记率可达90%以上; 随着ConA注射剂量的增加, 小鼠肝组织损伤严重程度增加, 15 mg/kg是诱导C57BL/6小鼠急性肝损伤的最合适剂量; Ⅱ组、Ⅲ组小鼠血清ALT、AST、TNF-α、IFN-γ、IL-4的水平以及肝脏Knodell评分均明显低于对照组(P<0.05). 肝组织内可见到植入的被标记的BMMSCs, 而在心、脾、肺等重要脏器并未观察到标记的BMMSCs.
结论: BMMSCs可治疗ConA诱导的小鼠急性肝损伤, 其机制可能是通过降低TNF-α、IFN-γ及IL-4而实现.
核心提示: 免疫介导的肝损伤是导致急性肝衰竭、慢性炎症与纤维化的重要机制之一, 寻找一种有效控制免疫性肝炎的新的治疗方法至关重要. 本实验旨在证实骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs)治疗刀豆蛋白A诱导的急性肝损害的有效性, 并对其可能的机制进行探讨, 为临床上利用BMMSCs的应用提供实验依据.
引文著录: 王丹娜, 郭海英, 刘应莉, 孙朝侠, 徐元富, 刘文天. 骨髓间充质干细胞治疗ConA诱导的小鼠急性肝损伤的作用及机制. 世界华人消化杂志 2015; 23(30): 4800-4807
Revised: October 7, 2015
Accepted: October 12, 2015
Published online: October 28, 2015
AIM: To assess the therapeutic action of bone marrow mesenchymal stem cells (BMMSCs) on concanavalin A (ConA)-induced acute liver injury in mice.
METHODS: BMMSCs were isolated from bone tissues of C57BL/6 mice, cultured, identified, and labeled with CM-Dil in vitro. C57BL/6 mice were injected with different doses of ConA to find the optimal concentration to generate a mouse model of ConA-induced hepatitis. C57BL/6 mice were randomly divided into groups I-IV and a control group. Groups I-IV were injected with CM-Dil labeled BMMSCs at 1 × 105, 5 × 105, 1 × 106, and 1 × 107, respectively. The control group was injected with PBS. Serum levels of liver enzymes [alanine transaminase (ALT) and aspartate transaminase (AST)], cytokines [tumor necrosis factor-α (TNF-α), interferon-γ (IFN-γ), and interleukin-4 (IL-4)], histopathology, and localization of BMMSCs were investigated at 24 h after injection.
RESULTS: We collected cells in line with the characteristics of BMMSCs, and the rate of CM-Dil labeling was over 90%. With increasing doses of ConA, the severity of liver injury increased, and 15 mg/kg was the optimal dose for inducing acute liver injury in C57BL/6 mice. Serum levels of ALT, AST, TNF-α, IFN-γ, IL-4 and Knodell score were significantly reduced in groups II and III as compared with the control group (P < 0.05). Injected CM-Dil labeled BMMSCs were located in the liver of ConA-injected mice, but were not detected in the heart, lung or spleen.
CONCLUSION: The therapeutic efficacy of BMMSCs for ConA-induced hepatitis is defined. It is possible that BMMSCs migrate to the inflammatory sites and reduce the production of TNF-α, IFN-γ and IL-4 to alleviate liver injury induced by ConA.
- Citation: Wang DN, Guo HY, Liu YL, Sun CX, Xu YF, Liu WT. Therapeutic effects of transplantation of bone marrow mesenchymal stem cells on ConA-induced acute liver injury in mice. Shijie Huaren Xiaohua Zazhi 2015; 23(30): 4800-4807
- URL: https://www.wjgnet.com/1009-3079/full/v23/i30/4800.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i30.4800
免疫介导的肝损伤是导致急性肝衰竭、慢性炎症与纤维化的重要机制之一[1], 因此, 寻找一种有效控制甚至根治免疫性肝炎的新的治疗方法至关重要. 骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs)是来源于骨髓基质的一类具有自我更新能力及多向分化潜能的干细胞, 多种自身免疫性疾病存在着骨髓间充质干细胞的缺陷[2,3], 同时在动物模型的研究中也发现间充质干细胞的移植可以明显改善多种自身免疫性疾病的病情[4,5]. 已有多篇文献报道[4,6]BMMSCs对刀豆蛋白A(concanavalin A, ConA)诱导的急性肝损害的小鼠模型有很好的治疗作用, 本实验前期研究[7]也证实BMMSCs移植治疗ConA诱导的急性肝损害可改善一般状况、降低肝功能损伤和缓解肝脏炎性细胞浸润等. 本实验旨在证实BMMSCs治疗ConA诱导的急性肝损害的有效性及安全性, 并对其可能的作用机制进行初步探讨, 为临床上利用BMMSCs的应用提供实验依据.
C57BL/6 ♂小鼠, 5-6周龄, 购自中国医学科学院血液病研究所, 体质量20 g±5 g. 饲养于中国医学科学院血液病研究所动物实验室, 恒温, 恒湿条件下自由摄食摄水, 饲养1 wk. 实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准. BD公司CantoⅡ流式细胞仪、Sigma公司ConA(白色冻干粉)、BD公司Cytofix/CytopermTM Plus、欣博盛ELISA反应试剂盒等、上海涡旋混合器厂XW-80Y型微型漩涡混合仪器.
1.2.1 C57BL/6小鼠BMMSCs的分离、培养、鉴定及标记: 采用冲骨髓法[8]以C57BL/6小鼠的股骨骨髓作为BMMSCs的供体来源, 应用骨髓贴壁法[9]对其进行体外培养, 当培养至第3代, 采用流式细胞仪对其细胞表型进行鉴定, 并采用油红O和茜素红染色对其成脂及成骨分化能力进行鉴定[10]. 将生长状态较好的第3代BMMSCs移入CM-DiL溶液中进行标记, 荧光显微镜下观察并计数其细胞标记率.
1.2.2 肝损伤模型建立与标本采集: 将C57BL/6 ♂小鼠随机分组, 实验组A、B、C及对照组各5只, 分别经尾静脉注射200 μL ConA, 剂量分别为10、15、20 mg/kg, 对照组注射等体积的磷酸盐缓冲液. 8 h后麻醉小鼠, 眼球取血, 检测血清样本中谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)的水平. 处死小鼠后, 取其肝脏做病理切片, 并行HE染色, 观察肝组织的病理变化并参考Knodell肝炎活动指数评分系统对肝组织的炎症程度做出评分. 从中选择最合适的ConA的计量再次建立小鼠急性肝损伤模型.
1.2.3 尾静脉移植CM-Dil标记的BMMSCs, 观察其对急性肝损伤模型的影响: 将造模成功的C57BL/6 ♂小鼠随机分组, 于ConA输注30 min后模型Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组各5只, 分别经尾静脉注射1×105、5×105、1×106、1×107个CM-Dil标记的BMMSCs的细胞悬液, 对照组注射等量的磷酸盐缓冲液. 24 h后麻醉小鼠, 眼球取血, 检测血清样本中ALT、AST的水平. 酶联免疫吸附法检测血清肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、干扰素γ(interferon-γ, IFN-γ)及白介素-4(interleukin-4, IL-4)等细胞因子的水平. 处死小鼠后, 取肝组织行HE染色并对其炎症程度做出Knodell评分; 取模型组小鼠心、肝、脾、肺组织在荧光显微镜下观察冰冻切片组织荧光分布情况.
统计学处理 采用SPSS18.0分析软件分析, 对计数资料采取χ2检验或Fisher确切概率法, P<0.05为差异有统计学意义.
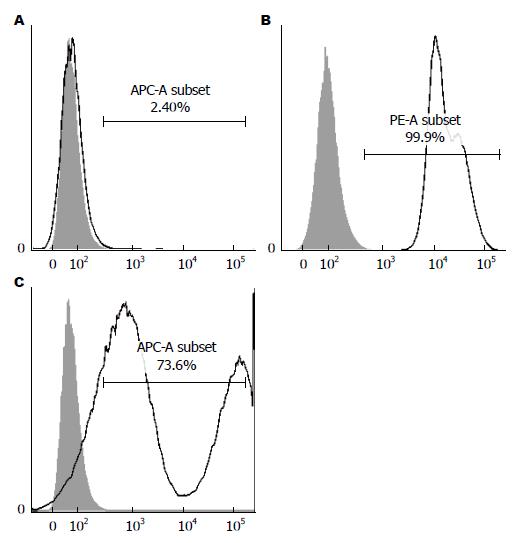
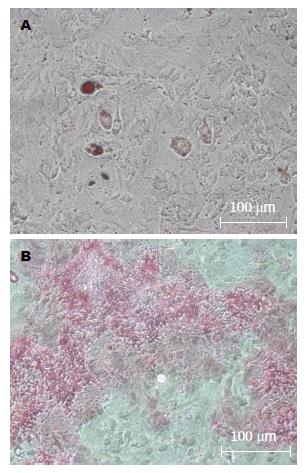
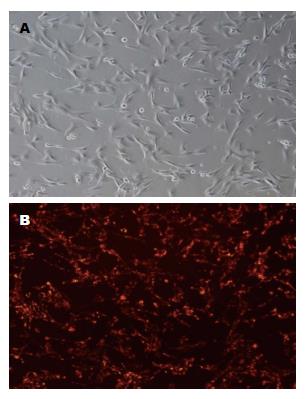
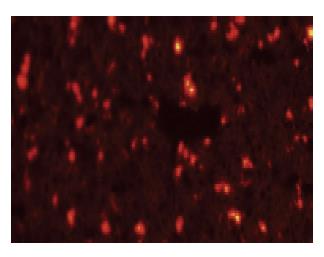
造血细胞来源的标志抗原CD34呈阴性表达, 而间充质干细胞来源的有关标志抗原CD29、CD90表达阳性, 表明培养细胞符合BMMSCs表面特征(图1); 小鼠的第3代BMMSCs加入成脂诱导剂14 d后成功分化为脂肪细胞, 经成骨诱导培养液培养21 d后成功分化为成骨细胞(图2), 可见贴壁培养法分离获得的BMMSCs具有多向分化能力, 细胞活性较好; 荧光显微镜下CM-Dil标记后的BMMSCs发出红色荧光, 且能保持细胞较好的形态(图3), 标记率可达90%以上, 该方法简单、方便、稳定、无毒性, 不影响标记细胞的存活、生长, 标记时间长[11], 可清晰地显示被标记的BMMSCs的分布.
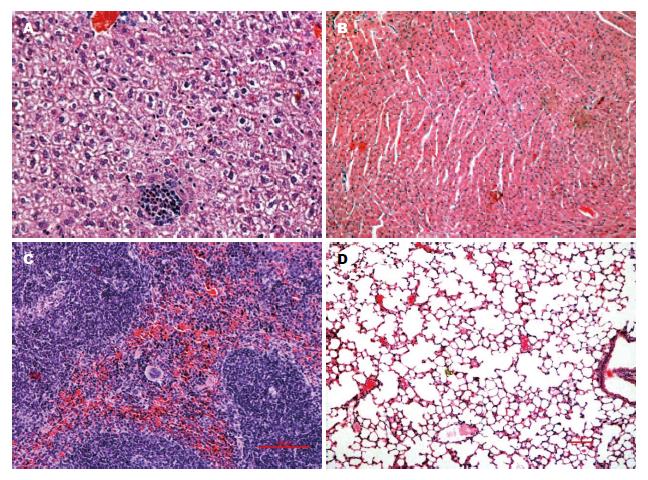
注射ConA 8 h后, 实验组小鼠血清ALT、AST的水平及处死后肝脏Knodell评分均明显高于对照组(P<0.05), 且随ConA注射剂量的增加而增高(表1). 实验组病理显示肝实质内及汇管区炎症细胞浸润以及肝细胞的点状坏死、局灶坏死及大范围坏死等病理变化, 心、脾、肺等组织未见损伤(图4), 且随着ConA注射剂量的增加肝组织坏死及炎细胞浸润的程度逐渐加重, 而对照组小鼠镜下肝小叶结构正常, 肝实质内未见肝细胞坏死及汇管区炎症细胞浸润. 因此15 mg/kg为ConA诱导C57BL/6小鼠急性肝损伤模型的合适剂量, 这与Zhu等[12]、董魁等[13]以♀小鼠为研究对象建立的模型所选用的ConA剂量是一致的.
| 分组 | ALT(U/L) | AST(U/L) | Knodell评分(分) |
| A组 | 390.2±85.3a | 380.2±70.3a | 2.3±1.3a |
| B组 | 637.0±95.9ac | 748.9±75.2ac | 3.1±0.5ac |
| C组 | 859.6±116.1ace | 969.7±110.1ace | 4.1±0.5ace |
| 对照组 | 62.3±5.4 | 82.3±8.4 | 0 |
| 模型Ⅰ组 | 620.2±10.3 | 730.2±11.4 | 2.9±1.1 |
| 模型Ⅱ组 | 397.1±15.1g | 390.2±10.2g | 2.0±0.3g |
| 模型Ⅲ组 | 179.6±46.1gi | 169.7±61.1gi | 1.5±0.5gi |
| 模型对照组 | 632.3±115.4 | 742.3±118.4 | 3.8±0.5 |
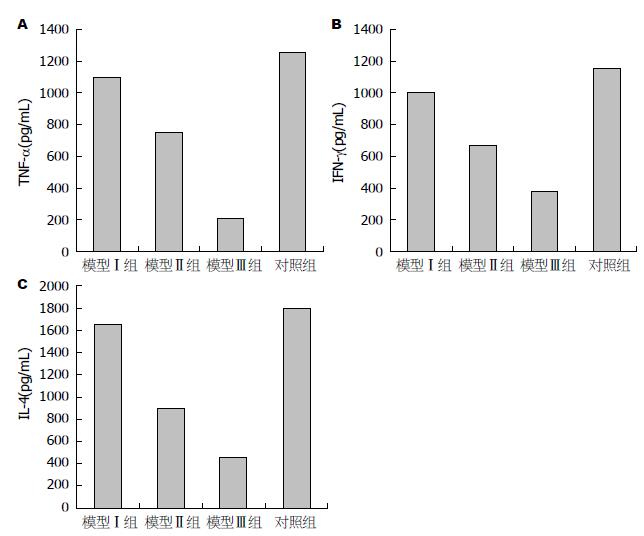
2.3 BMMSCs对ConA诱导的急性肝损伤治疗效果及可能的作用机制 接受BMMSCs输注治疗后, 模型Ⅳ组小鼠出现4只死亡(因此模型Ⅳ组小鼠未能进行血清学各项指标的检测), 其余各组小鼠未见死亡. 小鼠血清ALT、AST的水平及肝脏Knodell评分: Ⅱ组和Ⅲ组均明显低于对照组, 差异有统计学意义(P<0.05); 而Ⅲ组和Ⅱ组相比较, 差异亦有统计学意义(P<0.05); Ⅰ组与对照组比较无显著性差异(表1). 小鼠血清TNF-α、IFN-γ及IL-4的水平: Ⅱ组和Ⅲ组明显低于空白对照组(P<0.05)(图5). 荧光显微镜下在受损的肝组织内可以观察到植入的被标记的BMMSCs发出红色荧光(图6), 而在心、脾、肺等重要脏器并未观察到标记的BMMSCs.
以往用于BMMSCs移植示踪的技术主要有5-溴脱氧尿嘧啶核苷、绿色荧光蛋白和磁性标记法等, 但均存在操作复杂, 成功率低等缺点[14-16]. 四甲基吲哚羰基花青高酸盐(1,1'-dioctadecy1-3,3,3',3'-tetramethylindo carbocyanine perchlorate, Dil)是一种标记细胞膜的新型亲脂羰花青类荧光活体染料[17], 表达稳定, 无细胞毒性, 荧光衰减慢而且Dil不会从标记细胞扩散到非标记细胞, 避免了交叉染色[18], 有实验报道[19]Dil可标记肝细胞、骨髓基质干细胞. CM-Dil是在传统Dil的基础上增加了一个硫醇氯甲基, 对丙酮或醛类固定的组织及石蜡包埋的组织能够进行稳定地标记, 而且CM-Dil保留了传统Dil无细胞毒性, 不影响标记细胞的存活、生长. 本实验应用CM-Dil标记C57BL/6小鼠的第3代BMMSCs, 整个标记过程用时30 min, 24 h后荧光显微镜下观察, 细胞发出红色荧光, 标记率可达90%以上, 标记后的BMMSCs在小鼠的肝脏组织可以清晰地显示红色荧光, 可明确的分辨出BMMSCs且不影响其特性. 其染色方法简单、方便、稳定、无毒性, 荧光标记持续时间较长, 为BMMSCs体内、体外示踪的有效方法.
ConA又名刀豆素, 通过激活CD4+ T细胞和自然杀伤T细胞介导而诱发特异性肝损害[20], 类似人类自身免疫性肝炎[21], 1992年, Tiegs等[22]首次成功的应用ConA诱发了小鼠特异性免疫性肝损伤. 本实验前期研究[23]也显示ConA模型呈急性病程, 造模时间短, 操作简单, 可重复性强. 对于最合适的诱导急性肝损伤模型ConA的用量, 文献报道并不一致, 我们实验中应用10、15、20 mg/kg 3种不同的剂量, 结果显示小鼠肝损害的程度随药物剂量的加大而加重. 当剂量达20 mg/kg时, 已有实验小鼠死亡. 因此, 15 mg/kg是诱导C57BL/6小鼠急性肝损伤模型的合适剂量. 此外, 我们研究发现ConA静脉注射后8 h, 组织学检查未发现心、肺、脾等肝外器官的损伤, 表明ConA诱导的组织损伤具有肝脏特异性, 其原因还有待于进一步研究.
目前研究认为自身免疫性肝炎的发病过程可能涉及到遗传易感性、环境诱发因素、自身抗原、免疫紊乱等多种因素之间的相互作用, 最终引起免疫耐受机制受损, 产生了针对肝脏自身抗原的免疫反应, 从而破坏肝细胞导致肝脏炎症坏死, 并可能进展为肝脏纤维化和肝硬化[24], 传统治疗方案是单用糖皮质激素或联合免疫抑制剂硫唑嘌呤治疗, 但研究[25]发现约10%的患者在高剂量的泼尼松治疗下仍无组织学缓解或出现激素相关的不良反应, 而且长期应用硫唑嘌呤还存在骨髓抑制和增加肿瘤发生率的危险. MSCs不仅具有多分化潜能, 还具有免疫调节功能[26], 近年有研究[27]报道BMMSCs对ConA诱导的急性肝损害的小鼠模型有很好的治疗作用, BMMSCs能够特定的迁移到免疫器官, 并集中聚集在受损组织和炎症反应部位[4], 明显减轻小鼠肝损害的严重程度. 本实验将体外扩增培养的BMMSCs经尾静脉移植入ConA诱导的急性肝损伤模型小鼠体内, 对标记移植的细胞进行体内示踪, 结果在受损的肝组织观察到植入的BMMSCs, 而在心、脾、肺等重要脏器并未观察到标记的BMMSCs, 这与文献[28]中报道的BMMSCs能够特定的迁移到免疫器官是一致的, 这种作用对治疗ConA诱导的急性肝损伤更具特异性而不影响其他器官功能. 本实验也证实ConA诱导的急性肝损伤模型小鼠经BMMSCs治疗后血清肝酶的水平减低, 肝脏组织病理损伤减轻, 证明BMMSCs治疗ConA诱导的急性肝损伤模型小鼠是有效的.
免疫性肝炎患者的肝脏内有大量的CD4+的辅助型T细胞和CD8+的细胞毒型T细胞浸润. CD4+的辅助型T细胞激活后可以分化成Th1和Th2两个亚型, Th1细胞主要分泌TNF-α和IFN-γ等细胞因子, Th2细胞分泌多种白介素, 如IL-4、IL-10等, 前者可以促进细胞毒性T细胞增殖, 从而上调细胞免疫反应, 损伤肝细胞, 后者促进B细胞分泌免疫球蛋白, 上调体液免疫反应, 杀伤肝细胞[29], 可以证实TNF-α、IFN-γ及IL-4在免疫性肝炎中发挥着重要作用[30]. 本实验给予ConA诱导的急性肝损伤小鼠模型尾静脉输注培养扩增的BMMSCs, 治疗后小鼠ALT、AST的水平及肝脏Knodell评分均明显减低, 且血中TNF-α、IFN-γ、IL-4的水平亦明显减低. 由此推测, BMMSCs可能是通过降低炎症因子的水平, 从而抑制细胞免疫及体液免疫发挥治疗ConA诱导的急性肝损伤的作用. 这与Chen等[31]研究结果BMMSCs移植可通过其免疫抑制作用缓解AIH的肝细胞损伤一致.
总之, BMMSCs已成为近年来医学和生物学领域中最引人注目的研究热点之一, 对ConA诱导的急性肝损伤的治疗安全有效, 将具有极为广阔的应用前景.
本研究主要对刀豆蛋白A(concanavalin A, ConA)诱导的急性肝损伤的合适剂量及骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs)治疗急性肝损伤的剂量和表型进行摸索. 为急性肝损伤模型的建立及BMMSCs的临床应用提供更为准确的实验依据.
李瀚旻, 教授, 主任医师, 湖北省中医院, 湖北中医药大学附属医院; 张进祥, 副教授, 华中科技大学同济医学院附属协和医院
目前, 探索免疫性肝炎的新的治疗方法至关重要. 多种自身免疫性疾病存在着BMMSCs的缺陷, 同时在动物模型的研究中也发现间充质干细胞的移植可以明显改善病情. 本研究观察BMMSCs在ConA诱导小鼠急性肝损伤中的治疗效果, 并对其可能的治疗机制进行探讨.
MSC通过影响脾脏CD4+ T淋巴细胞亚群降低Th1、Th2细胞比例, 导致外周血中后者分泌的细胞因子(肿瘤坏死因子-α、干扰素-γ及白介素-4)水平下降; 升高Treg比例, 降低Th17比例, 维持Th17与Treg平衡, 进而起到治疗ConA诱导的小鼠急性免疫性肝损伤的作用. 该文献更深入的研究了MSC治疗急性肝损伤的机制, 为免疫性肝炎的治疗提供了有力的依据.
本研究主要对ConA诱导的急性肝损伤的合适剂量及BMMSCs治疗急性肝损伤的剂量和表型进行摸索.
本文为临床采用骨髓间充质干细胞治疗免疫性肝损伤提供了实验依据, 有一定学术意义和临床价值.
本文主要对剂量和表型进行摸索, 设计合理, 结果分析整理规整, 结果足够支持推论.
编辑: 于明茜 电编:闫晋利
| 1. | 翁 书强, 姚 群燕, 李 希, 涂 传涛, 沈 锡中. 槲皮素对刀豆蛋白A诱导小鼠急性肝损伤的保护作用. 胃肠病学和肝病学杂志. 2015;24:40-44. |
| 2. | Bacigalupo A, Valle M, Podestà M, Pitto A, Zocchi E, De Flora A, Pozzi S, Luchetti S, Frassoni F, Van Lint MT. T-cell suppression mediated by mesenchymal stem cells is deficient in patients with severe aplastic anemia. Exp Hematol. 2005;33:819-827. [PubMed] [DOI] |
| 3. | Del Papa N, Quirici N, Soligo D, Scavullo C, Cortiana M, Borsotti C, Maglione W, Comina DP, Vitali C, Fraticelli P. Bone marrow endothelial progenitors are defective in systemic sclerosis. Arthritis Rheum. 2006;54:2605-2615. [PubMed] [DOI] |
| 4. | Zappia E, Casazza S, Pedemonte E, Benvenuto F, Bonanni I, Gerdoni E, Giunti D, Ceravolo A, Cazzanti F, Frassoni F. Mesenchymal stem cells ameliorate experimental autoimmune encephalomyelitis inducing T-cell anergy. Blood. 2005;106:1755-1761. [PubMed] [DOI] |
| 5. | Zhang J, Li Y, Chen J, Cui Y, Lu M, Elias SB, Mitchell JB, Hammill L, Vanguri P, Chopp M. Human bone marrow stromal cell treatment improves neurological functional recovery in EAE mice. Exp Neurol. 2005;195:16-26. [PubMed] [DOI] |
| 6. | Ryu KH, Kim SY, Kim YR, Woo SY, Sung SH, Kim HS, Jung SC, Jo I, Park JW. Tonsil-derived mesenchymal stem cells alleviate concanavalin A-induced acute liver injury. Exp Cell Res. 2014;326:143-154. [PubMed] [DOI] |
| 9. | León D, Albasanz JL, Ruíz MA, Iglesias I, Martín M. Effect of chronic gestational treatment with caffeine or theophylline on Group I metabotropic glutamate receptors in maternal and fetal brain. J Neurochem. 2005;94:440-451. [PubMed] [DOI] |
| 10. | Zhu H, Guo ZK, Jiang XX, Li H, Wang XY, Yao HY, Zhang Y, Mao N. A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone. Nat Protoc. 2010;5:550-560. [PubMed] [DOI] |
| 11. | Hemmrich K, Meersch M, von Heimburg D, Pallua N. Applicability of the dyes CFSE, CM-DiI and PKH26 for tracking of human preadipocytes to evaluate adipose tissue engineering. Cells Tissues Organs. 2006;184:117-127. [PubMed] [DOI] |
| 12. | Zhu X, He B, Zhou X, Ren J. Effects of transplanted bone-marrow-derived mesenchymal stem cells in animal models of acute hepatitis. Cell Tissue Res. 2013;351:477-486. [PubMed] [DOI] |
| 14. | Burns TC, Ortiz-González XR, Gutiérrez-Pérez M, Keene CD, Sharda R, Demorest ZL, Jiang Y, Nelson-Holte M, Soriano M, Nakagawa Y. Thymidine analogs are transferred from prelabeled donor to host cells in the central nervous system after transplantation: a word of caution. Stem Cells. 2006;24:1121-1127. [PubMed] [DOI] |
| 16. | Kobayashi T, Ochi M, Yanada S, Ishikawa M, Adachi N, Deie M, Arihiro K. A novel cell delivery system using magnetically labeled mesenchymal stem cells and an external magnetic device for clinical cartilage repair. Arthroscopy. 2008;24:69-76. [PubMed] [DOI] |
| 17. | 王 美华, 胡 锴勋, 邱 泽武. 改良小鼠骨髓间充质干细胞培养方法及长效荧光标记的可行性. 中国组织工程研究与临床康复. 2009;13:8929-8934. |
| 18. | Markus PM, Koenig S, Krause P, Becker H. Selective intraportal transplantation of DiI-marked isolated rat hepatocytes. Cell Transplant. 1997;6:455-462. [PubMed] [DOI] |
| 19. | 李 东, 崔 磊, 舒 朝锋, 柳 向东, 张 英, 柴 岗, 刘 伟, 曹 谊林. 荧光活性染料DiI标记观察人骨髓基质干细胞与部分脱钙骨粘附的实验研究. 中华创伤骨科杂志. 2004;6:311-314. |
| 20. | Hong F, Jaruga B, Kim WH, Radaeva S, El-Assal ON, Tian Z, Nguyen VA, Gao B. Opposing roles of STAT1 and STAT3 in T cell-mediated hepatitis: regulation by SOCS. J Clin Invest. 2002;110:1503-1513. [PubMed] [DOI] |
| 21. | Tu CT, Han B, Yao QY, Zhang YA, Liu HC, Zhang SC. Curcumin attenuates Concanavalin A-induced liver injury in mice by inhibition of Toll-like receptor (TLR) 2, TLR4 and TLR9 expression. Int Immunopharmacol. 2012;12:151-157. [PubMed] [DOI] |
| 22. | Tiegs G, Hentschel J, Wendel A. A T cell-dependent experimental liver injury in mice inducible by concanavalin A. J Clin Invest. 1992;90:196-203. [PubMed] [DOI] |
| 26. | Constantin G, Marconi S, Rossi B, Angiari S, Calderan L, Anghileri E, Gini B, Bach SD, Martinello M, Bifari F. Adipose-derived mesenchymal stem cells ameliorate chronic experimental autoimmune encephalomyelitis. Stem Cells. 2009;27:2624-2635. [PubMed] [DOI] |
| 28. | Kubo N, Narumi S, Kijima H, Mizukami H, Yagihashi S, Hakamada K, Nakane A. Efficacy of adipose tissue-derived mesenchymal stem cells for fulminant hepatitis in mice induced by concanavalin A. J Gastroenterol Hepatol. 2012;27:165-172. [PubMed] [DOI] |
| 30. | Trautwein C, Rakemann T, Brenner DA, Streetz K, Licato L, Manns MP, Tiegs G. Concanavalin A-induced liver cell damage: activation of intracellular pathways triggered by tumor necrosis factor in mice. Gastroenterology. 1998;114:1035-1045. [PubMed] [DOI] |
| 31. | Chen Y, Chen S, Liu LY, Zou ZL, Cai YJ, Wang JG, Chen B, Xu LM, Lin Z, Wang XD. Mesenchymal stem cells ameliorate experimental autoimmune hepatitis by activation of the programmed death 1 pathway. Immunol Lett. 2014;162:222-228. [PubMed] [DOI] |