修回日期: 2014-12-04
接受日期: 2014-12-15
在线出版日期: 2015-01-28
目的: 肿瘤深部热疗联合全身化疗对复发转移胃癌总生存期的影响, 探讨个体化治疗预测因素.
方法: 分析99例复发转移胃癌患者, 其中热化疗组42例, 进行肿瘤深部热疗+全身化疗; 单纯化疗组57例, 单纯接受全身化疗, 作为对照. 统计两组患者的生存期, 并将其统计结果使用SPSS16.0统计软件进行统计学分析.
结果: 热化疗组中位生存期(18 mo)显著长于单纯化疗组生存期(12.8 mo)((P = 0.003); 热化疗组中白蛋白(albumin, ALB)≥35 g/L患者的生存期(19 mo)显著长于ALB<35 g/L患者的生存期(10 mo)((P = 0.027); 热化疗组中, 中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio, NLR)<4.558患者的生存期(33 mo)显著长于NLR≥4.558患者的生存期(10 mo)((P = 0.007).
结论: 深部热化疗治疗复发转移胃癌患者可提高患者的生存期, 正常血清ALB和NLR低值可进一步个体化预测其生存获益; 而低血清ALB及高NLR值有损生存期, 不建议这类患者做肿瘤深部热化疗.
核心提示: 综合性治疗是肿瘤治疗学的发展趋势, 随着热疗技术的发展, 热疗已经成为肿瘤治疗的方法之一. 本文主要研究肿瘤深部热化疗对复发转移胃癌患者的生存期影响, 以及年龄、白蛋白水平、中性粒细胞/淋巴细胞比值等预测因素分析.
引文著录: 张志影, 徐海燕, 陈彬, 杨懿瑾, 张玲, 王蒙, 徐迎春, 张凤春. 肿瘤深部热化疗对复发转移胃癌生存期的影响及其预测因素. 世界华人消化杂志 2015; 23(3): 438-444
Revised: December 4, 2014
Accepted: December 15, 2014
Published online: January 28, 2015
AIM: To investigate the effect of tumor deep hyperthermia combined with systemic chemotherapy on overall survival (OS) of recurrent gastric cancer patients, and to explore the predictors of response to the treatment.
METHODS: Ninety-nine patients with recurrent gastric cancer were divided into either a thermo-chemotherapy group (n = 42) or a control group (n = 57). The thermo-chemotherapy group was treated by deep tumor hyperthermia and chemotherapy, and the control group received systemic chemotherapy alone. The OS was compared for the two groups, and the predictors of response to individualized treatment was analyzed.
RESULTS: The median OS was significantly longer in the thermo-chemotherapy group than in the control group (18 mo vs 12.8 mo. (P = 0.003). In the thermo-chemotherapy group, the OS of patients with albumin (ALB) ≥ 35 g/L (19 mo) was better than that of patients with ALB < 35g/L (10 mo) ((P = 0.027); and the OS of patients with a neutrophil/lymphocyte ratio (NLR) < 4.558 (33 mo) was superior than that of patients with an NLR ≥ 4.558 (10 mo) ((P = 0.007).
CONCLUSION: For recurrent gastric cancer patients, thermotherapy combined with chemotherapy may be a more effective treatment option. Patients with normal serum ALB and an NLR < 4.558 may have a better prognosis. For patients with ALB < 35 g/L and an NLR ≥ 4.558, deep tumor hyperthermia combined with systemic chemotherapy is not recommended.
- Citation: Zhang ZY, Xu HY, Chen B, Yang YJ, Zhang L, Wang M, Xu YC, Zhang FC. Influence of deep hyperthermia combined with systemic chemotherapy on overall survival of recurrent gastric cancer patients: Predictors of response to treatment. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 438-444
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/438.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.438
胃癌是全世界肿瘤相关死亡的第二大常见病因[1], 是我国最常见的肿瘤之一. 胃癌患者的死亡率呈上升趋势[2]仅次于肺癌[3]. 胃癌的早期诊断率较低, 诊断时多为晚期无法手术; 即使手术, 术后复发率较高, 生存期短. 目前复发转移胃癌最佳治疗方案的中位生存期仅为10-13 mo. 采用肿瘤深部热疗联合化疗治疗胃癌的研究已有报道[4], 但多以研究临床缓解率和不良反应为主, 而对生存期的报道较少, 特别是对生存期的预测因素尚未见报道. 本研究主要探索肿瘤深部热疗联合全身化疗对复发转移胃癌患者总生存期(overall survival, OS)的影响及其预测因素, 为深部热化疗提供个体化治疗的依据.
选取2010-04/2014-04在上海交通大学附属苏州九龙医院及上海交通大学附属仁济医院肿瘤科收治的99例胃癌患者, 男性76例, 女性23例, 中位年龄62岁. 患者纳入标准包括: (1)经组织病理学诊断为胃癌, 复发转移Ⅳ期; (2)无化疗及热疗禁忌症; (3)预计生存期>3 mo. 所有患者分为两组. 热化疗组: 42例, 接受深部热疗+全身化疗, 作为研究组(热疗技术为国家卫生部批准的第三类临床技术, 获得了临床准入. 本研究得到了上海交通大学医学院苏州九龙医院伦理委员会的批准); 单纯化疗组: 57例, 仅接受全身化疗, 作为对照组. 两组患者的一般情况如表1, 经统计学比较, 两组患者在年龄、性别、病理类型、脏器转移等方面均差异无统计学意义(均P>0.05), 具有可比性.
| 基本参数 | 热化疗组 | 化疗组 | P值 |
| n | 42 | 57 | |
| 年龄(岁) | 0.333 | ||
| <65 | 24(57.1) | 38(66.7) | |
| ≥65 | 18(42.9) | 19(33.3) | |
| 性别 | 0.070 | ||
| 男 | 36(85.7) | 40(70.2) | |
| 女 | 6(14.3) | 17(29.8) | |
| 病理类型 | 0.215 | ||
| 腺癌 | 38(90.1) | 55(96.5) | |
| 非腺癌 | 4(9.9) | 2(3.5) | |
| 病理分级 | 0.774 | ||
| 中高分化 | 6(16.2) | 7(14.0) | |
| 低分化 | 31(83.8) | 43(86.0) | |
| ALB(g/L) | 0.587 | ||
| <35 | 13(37.1) | 19(43.2) | |
| ≥35 | 22(62.9) | 25(56.8) | |
| NLR | 0.903 | ||
| <4.558 | 24(63.2) | 29(64.4) | |
| ≥4.558 | 14(26.8) | 16(35.6) | |
| 转移情况 | |||
| 肝 | 18(42.9) | 20(35.1) | 0.432 |
| 肺 | 5(11.9) | 15(26.3) | 0.078 |
| 骨 | 4(9.5) | 5(8.8) | 0.898 |
| 淋巴结 | 29(69.0) | 33(57.9) | 0.257 |
| 腹水情况 | 0.148 | ||
| 有 | 16(38.1) | 14(24.6) | |
| 无 | 26(61.9) | 43(75.4) |
1.2.1 肿瘤深部热疗: 采用由吉林迈达公司生产的NRL-003型内生物高频热疗机, 频率50 Hz, 双组圆形极板, 直径20 era, 采用肛内测温法, 计算机实时计算功率温度, 精确度为0.1 ℃. 目标温度为40.5 ℃-42.0 ℃, 首次治疗45 min, 其后每次热疗60 min(治疗参数参照NRL-003型体外高频热疗机使用说明), 每周2-3次. 热疗于化疗药物输注前或后1 h内进行. 化疗方案: 紫杉醇+替吉奥为主的化疗方案, 热化疗组的化疗方案与单纯化疗组相同. 自患者出院后, 每隔3 mo随访1次, 末次随访时间为2014-06. (1)随访过程中出现死亡的视为终点事件; (2)失访患者视为死亡, 以该患者的末次随访时间作为死亡时间; (3)截止至末次随访时间患者仍存活且预计生存时间>3 mo的视为生存.
1.2.2 观察指标: 主要观察终点是总生存期, 计算方法为: (1)首次诊断转移不适手术的患者的总生存期: 死亡患者总生存期为确诊时间至死亡时间; 生存患者总生存期为确诊时间至末次随访随时间; (2)术后复发转移患者的总生存期: 死亡患者总生存期为复发时间至死亡时间, 生存患者总生存期为复发时间至末次随访随时间. 次要终点是治疗前年龄、治疗前外周血白蛋白(albumin, ALB)水平及治疗前外周血中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio, NLR)对两组患者OS的影响.
统计学处理 应用SPSS16.0统计学软件处理数据, 计数资料比较采用χ2检验或秩和检验, 采用Kaplan-Meier法计算生存率, 生存率的比较采用Log-rank检验. P<0.05为差异具有统计学意义.
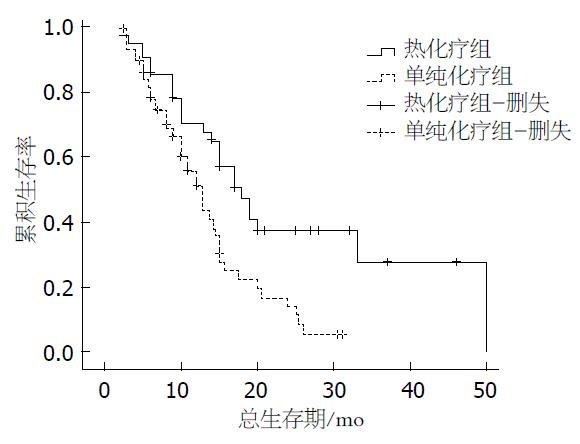
热化疗组中位生存期(18.0 mo)显著长于单纯化疗组生存期(12.8 mo)((P = 0.003); 在全部患者中, ALB≥35 g/L患者的生存期(21.770 mo±2.915 mo)显著长于ALB<35 g/L患者的生存期(13.032 mo±1.203 mo)((P = 0.040); NLR<4.558的患者的生存期(22.726 mo±2.819 mo)显著长于NLR≥4.558的患者的生存期(12.584 mo±1.291 mo)((P = 0.008)(表2, 图1).
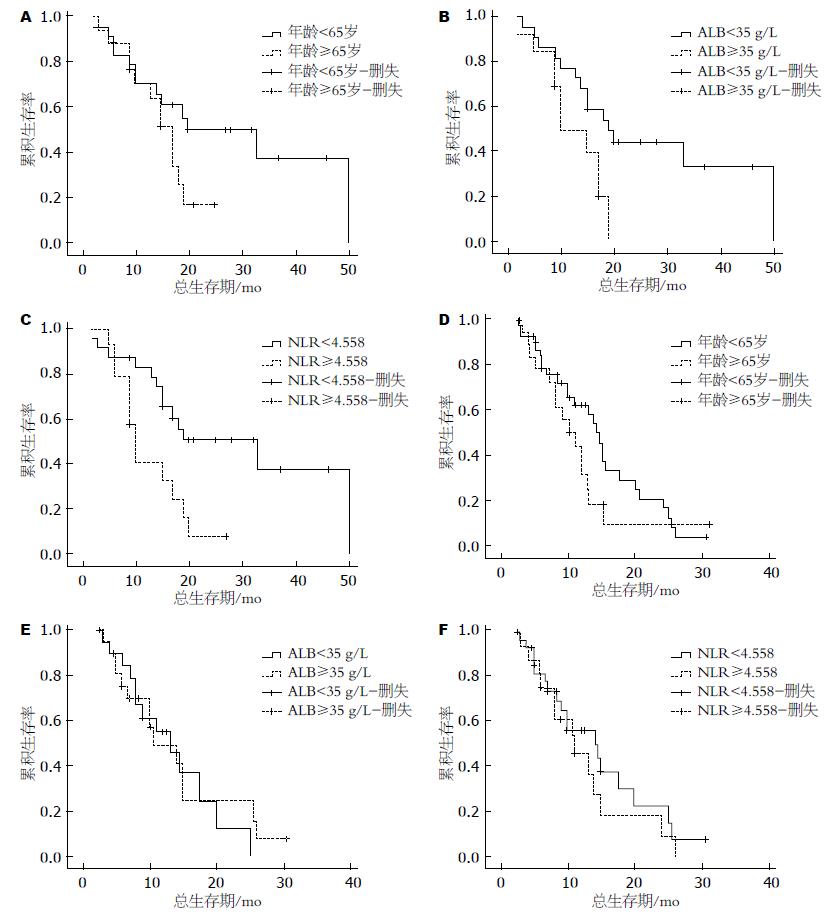
热化疗组中ALB≥35 g/L患者的生存期显著长于ALB<35 g/L患者的生存期((P = 0.027); 而单纯化疗组中ALB≥35 g/L患者的生存期与ALB<35 g/L患者的生存期差异无统计学意义((P = 0.738); 热化疗组中NLR<4.558的患者的生存期显著长于NLR≥4.558的患者的生存期((P = 0.007), 差异具有统计学意义, 而单纯化疗组NLR<4.558的患者的生存期虽优于NLR≥4.558的患者((P = 0.423), 但差异无统计学意义(表3, 图2).
| 分组 | 中位生存期(mo) | 95%CI | P值 |
| 热化疗组 | |||
| ALB(g/L) | 0.027 | ||
| ≥35 | 19.000 | 11.833-26.167 | |
| <35 | 10.000 | 4.077-15.923 | |
| NLR | 0.007 | ||
| <4.558 | 33.000 | 10.450-55.550 | |
| ≥4.558 | 10.000 | 8.370-11.630 | |
| 年龄(岁) | 0.141 | ||
| <65 | 33.000 | 12.364-53.636 | |
| ≥65 | 17.000 | 13.621-20.379 | |
| 单纯化疗组 | |||
| ALB(g/L) | 0.738 | ||
| ≥35 | 10.700 | 4.524-16.876 | |
| <35 | 13.000 | 8.178-17.822 | |
| NLR | 0.423 | ||
| <4.558 | 14.615 | 14.500-3.961 | |
| ≥4.558 | 11.000 | 5.716-16.284 | |
| 年龄(岁) | 0.186 | ||
| <65 | 14.100 | 12.164-16.036 | |
| ≥65 | 10.000 | 6.087-13.913 |
目前, 复发转移胃癌的治疗方法主要包括化疗、化疗联合靶向治疗及化疗联合放疗. 以紫杉醇类为主的方案治疗复发转移胃癌的中位生存期为12 mo[5]; 胃癌二期临床研究[6]显示, 西妥昔单抗联合替吉奥和奥沙利铂治疗复发转移胃癌的中位生存期为12.8 mo. 目前, Toga试验[7]结果示胃癌唯一有效的靶向治疗药物赫赛汀与化疗联合治疗晚期胃癌患者生存期为13.8 mo. 近年来的研究表明对复发转移胃癌患者的治疗均未取得明显进展, 延长复发转移胃癌患者的生存期是亟待解决的问题.
综合性治疗是肿瘤治疗学的发展趋势, 本研究所采用的内生场热疗系统是一种较先进的加热设备, 在肿瘤局部区域能诱导出内生差频场, 并产生内生热量, 从而实现对肿瘤病灶均匀加温(如使深部肿瘤温度达到43 ℃), 同时避免体表灼伤, 弥补了以往热疗时容易造成热疗部位皮下脂肪结节等不足. 研究[8]显示, 热疗与化疗联用具有协同作用, 其作用机制包括: (1)肿瘤组织通常对热较敏感, 热疗通过直接细胞杀伤作用、诱导细胞凋亡、破坏肿瘤血管生成来抑制肿瘤细胞生长; (2)热疗可改变肿瘤细胞膜结构, 提高其通透性, 使进入肿瘤细胞内的药物增多并增强药效, 逆转耐药; (3)由于肿瘤血管网发育不良, 容易形成低氧、低pH值状态, 并且肿瘤组织热量消散较正常组织慢, 故更容易遭受热损伤[9]; (4)热疗有助于恢复机体对肿瘤细胞的免疫应答反应[10]; (5)最新研究[11]发现热疗还可以下调肿瘤干细胞相关干性基因的表达, 减少肿瘤的复发转移. 近期研究证实热疗可以通过下调血管上皮生长因子(vascular endothelial growth factor, VEGF)及其受体的表达来抑制荷瘤小鼠的肿瘤生长从而延长其生存期[12]. 在结直肠癌的治疗方面, 含纳米颗粒的高频磁场热疗可以增加化疗药物多柔比星脂质体对癌细胞的细胞不良反应, 这种热化疗联合可以更有效的杀伤结直肠癌细胞[13].
Golse等[14]采用肿瘤细胞减灭术联合腹腔热灌注化疗治疗30例腹膜复发的晚期胃癌患者, 结果示无复发生存期为16.2 mo, 5年生存率为65%. 晚期胃癌术后腹腔热灌注化疗具有较好的协同增效作用, 可明显提高患者的5年生存率[13]. 回顾性分析101例进展期胃癌患者[4], 其中49例患者仅接受化疗[多西紫杉醇+5-氟尿嘧啶(5-fluorouracil, 5-Fu)+甲酰四氢叶酸+顺铂], 52例患者接受化疗联合腹腔热灌注治疗. 结果示化疗组的临床有效率为65.3%, 热化疗联合组的临床有效率为82.7%; 并且两组患者的不良反应相当. 在胃癌治疗方面, 国外研究[4,14]多倾向联合手术及腹腔热灌注治疗进展期胃癌患者, 而采用深部热疗联合化疗治疗复发转移胃癌患者则少见报道. 本研究采用以紫杉醇和替吉奥为主的化疗联合深部热疗与单纯以紫杉醇和替吉奥为主的化疗方案对比, 结果显示局部深部热疗联合全身化疗可明显延长复发转移胃癌患者的中位生存期, 长达18 mo, 显著长于单纯全身化疗者.
ALB是肿瘤患者一种重要的血清蛋白, 他反映了患者的营养状况. 肿瘤分期与术前ALB水平也密切相关. 早期患者ALB水平较高, 说明肿瘤侵犯范围小、淋巴结转移少、对脏器功能和机体代谢的损害轻微, 机体可维持ALB的正常水平, 保持较好的营养状况和免疫功能; 晚期患者肿瘤体积大, 常伴有脏器侵犯和淋巴结转移、机体代谢紊乱、消耗增加、脏器功能障碍, 最终导致低蛋白血症和营养不良. 现有研究[15,16]表明, ALB<35 g/L是胃肠癌、肺癌、卵巢癌、乳腺癌以及鼻咽癌预后差的独立预测因素. 而我们的研究发现在热化疗组中ALB≥35 g/L患者的生存期明显优于ALB<35 g/L患者的生存期, 提示正常水平血清ALB可预测复发转移胃癌患者对深部热化疗治疗具有良好的反应, 可获得良好的生存获益; 而低水平血清ALB正常水平反应差, 降低生存期. 改善患者机体营养状态, 纠正ALB接近正常水平, 可以增加热化疗的疗效, 从而有效延长复发转移胃癌患者的生存期.
在肿瘤患者体内, 中性粒细胞产生的细胞活素及其他一些炎症介质可促进有利于肿瘤细胞生长的微环境的形成. 而淋巴细胞计数减少提示宿主免疫机制异常、抗肿瘤的免疫能力下降. 肿瘤部位淋巴细胞浸润增多提示预后良好[17]. NLR是肿瘤患者全身性炎症的生物标志物, 研究表明NLR升高与肿瘤的不良预后密切相关[18,19]. 我们研究发现在热化疗组中, NLR低值组患者的生存期也明显优于NLR高值组患者的生存期, 认为NLR也可以作为复发转移胃癌患者对热化疗治疗的有效性及OS的预测因素. 复发转移的胃癌患者, 如在治疗前调整NLR, 也可以增加深部热化疗的疗效, 有效延长患者的生存期.
在单纯化疗组中未发现ALB、NLR对生存期的有效预测作用, 可能与所选病例及病例数相对较少有关. 可进一步扩大样本例数, 以更好的证实本实验的研究结果.
总之, 本研究结果表明, 深部热化疗治疗复发转移胃癌患者可进一步提高患者的生存期, 并且无不可耐受的不良反应, 具有较大的临床应用价值; 正常血清ALB和NLR低值可个体化预测复发转移胃癌患者对深部热化疗治疗具有良好的生存获益; 而低血清ALB及高NLR值复发转移的胃癌患者对深部热化疗有损生存期, 并且能使患者乏力, 影响生活质量, 故不建议这类患者做肿瘤深部热化疗.
近年来的研究表明对复发转移胃癌患者的治疗均未取得明显进展, 延长复发转移胃癌患者的生存期是亟待解决的问题. 目前复发转移胃癌患者的治疗手段主要为化疗、放疗、内分泌治疗、靶向治疗和热疗, 并且热疗的疗效确切, 越来越受到研究者的关注.
葛海燕, 教授, 同济大学附属第十人民医院普通外科; 王健生, 教授, 西安交通大学医学院第一附属医院肿瘤外科
肿瘤热疗已经成为肿瘤常规治疗方法之一, 腹腔热灌注化疗、含纳米颗粒的高频磁场热疗已取得明确的疗效, 但是剂量、温度控制以及如何更好的配合肿瘤其他治疗方法来提高疗效延长肿瘤患者的生存期需要更进一步的研究.
一项回顾性分析显示, 101例进展期胃癌患者, 其中49例患者仅接受化疗[多西紫杉醇+5-氟尿嘧啶(5-fluorouracil, 5-Fu)+甲酰四氢叶酸+顺铂], 52例患者接受化疗联合腹腔热灌注治疗. 结果示化疗组的临床有效率为65.3%, 热化疗联合组的临床有效率为82.7%; 并且两组患者的不良反应相当.
热化疗可以显著延长复发转移胃癌患者的生存期; 正常血清ALB和NLR低值可个体化预测复发转移胃癌患者对深部热化疗治疗具有良好的生存获益; 而低血清ALB及高NLR值复发转移的胃癌患者对深部热化疗有损生存期, 并且能使患者乏力, 影响生活质量, 故不建议这类患者做肿瘤深部热化疗.
肿瘤深部热化疗可以提高复发转移胃癌患者的疗效, 延长患者的生存期, 并且无不可耐受的不良反应, 对复发转移肿瘤患者的治疗很大的意义; 正常血清ALB和NLR低值可个体化预测复发转移胃癌患者对深部热化疗治疗具有良好的生存获益.
肿瘤深部热疗: 采用物理方法使肿瘤、肿瘤所在区域的温度升高, 通过一系列生物学效应, 使肿瘤细胞损伤(非凝固性坏死), 联合放疗或化疗进行治疗的技术;
中性粒细胞/淋巴细胞比值: 外周血象中, 中性粒细胞与淋巴细胞的比值, 与多种人体病理状态有关联, 其中包括肿瘤.
本文研究了肿瘤深部热疗联合全身化疗对复发转移胃癌总生存期的影响, 并且探讨了这两种疗法的个体化治疗预测因素, 给临床治疗复发转移胃癌患者提供了一定指导意义.
编辑: 郭鹏 电编:都珍珍
| 1. | Robb WB, Mariette C. Predicting the response to chemotherapy in gastric adenocarcinoma: who benefits from neoadjuvant chemotherapy? Recent Results Cancer Res. 2012;196:241-268. [PubMed] [DOI] |
| 2. | Yin XD, Huang WB, Lü CY, Zhang L, Wang LW, Xie GH. A preliminary study on correlations of triple-phase multi-slice CT scan with histological differentiation and intratumoral microvascular/lymphatic invasion in gastric cancer. Chin Med J (Engl). 2011;124:347-351. [PubMed] |
| 3. | Liu J, Chen L. Current status and progress in gastric cancer with liver metastasis. Chin Med J (Engl). 2011;124:445-456. [PubMed] |
| 4. | Zhibing W, Qinghua D, Shenglin M, Ke Z, Kan W, Xiadong L, Pengjun Z, Ruzhen Z. Clinical study of cisplatin hyperthermic intraperitoneal perfusion chemotherapy in combination with docetaxel, 5-flourouracil and leucovorin intravenous chemotherapy for the treatment of advanced-stage gastric carcinoma. Hepatogastroenterology. 2013;60:989-994. [PubMed] [DOI] |
| 5. | Zhang XL, Hu AB, Cui SZ, Wei HB. Thermotherapy enhances oxaliplatin-induced cytotoxicity in human colon carcinoma cells. World J Gastroenterol. 2012;18:646-653. [PubMed] [DOI] |
| 6. | Yuan M, Yang Y, Lv W, Song Z, Zhong H. Paclitaxel combined with capecitabine as first-line chemotherapy for advanced or recurrent gastric cancer. Oncol Lett. 2014;8:351-354. [PubMed] [DOI] |
| 7. | Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, Lordick F, Ohtsu A, Omuro Y, Satoh T. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376:687-697. [PubMed] [DOI] |
| 8. | Kim SY, Lee DH, Song X, Bartlett DL, Kwon YT, Lee YJ. Role of Bcl-xL/Beclin-1 in synergistic apoptotic effects of secretory TRAIL-armed adenovirus in combination with mitomycin C and hyperthermia on colon cancer cells. Apoptosis. 2014;19:1603-1615. [PubMed] [DOI] |
| 9. | Zhang ZD, Kong Y, Yang W, Zhang B, Zhang YL, Ma EM, Liu HX, Chen XB, Hua YW. Clinical evaluation of cetuximab combined with an S-1 and oxaliplatin regimen for Chinese patients with advanced gastric cancer. World J Surg Oncol. 2014;12:115. [PubMed] [DOI] |
| 10. | Frey B, Weiss EM, Rubner Y, Wunderlich R, Ott OJ, Sauer R, Fietkau R, Gaipl US. Old and new facts about hyperthermia-induced modulations of the immune system. Int J Hyperthermia. 2012;28:528-542. [PubMed] [DOI] |
| 11. | Gao F, Ye Y, Zhang Y, Yang J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 2013;46:1747-1750. [PubMed] [DOI] |
| 12. | Wang G, Xu D, Chai Q, Tan X, Zhang Y, Gu N, Tang J. Magnetic fluid hyperthermia inhibits the growth of breast carcinoma and downregulates vascular endothelial growth factor expression. Oncol Lett. 2014;7:1370-1374. [PubMed] |
| 13. | Hardiansyah A, Huang LY, Yang MC, Liu TY, Tsai SC, Yang CY, Kuo CY, Chan TY, Zou HM, Lian WN. Magnetic liposomes for colorectal cancer cells therapy by high-frequency magnetic field treatment. Nanoscale Res Lett. 2014;9:497. [PubMed] [DOI] |
| 14. | Golse N, Bakrin N, Passot G, Mohamed F, Vaudoyer D, Gilly FN, Glehen O, Cotte E. Iterative procedures combining cytoreductive surgery with hyperthermic intraperitoneal chemotherapy for peritoneal recurrence: postoperative and long-term results. J Surg Oncol. 2012;106:197-203. [PubMed] [DOI] |
| 15. | Gupta D, Lis CG. Pretreatment serum albumin as a predictor of cancer survival: a systematic review of the epidemiological literature. Nutr J. 2010;9:69. [PubMed] [DOI] |
| 16. | Li G, Gao J, Liu ZG, Tao YL, Xu BQ, Tu ZW, Zhang XP, Zeng MS, Xia YF. Influence of pretreatment ideal body weight percentile and albumin on prognosis of nasopharyngeal carcinoma: Long-term outcomes of 512 patients from a single institution. Head Neck. 2014;36:660-666. [PubMed] [DOI] |
| 17. | Kishi Y, Kopetz S, Chun YS, Palavecino M, Abdalla EK, Vauthey JN. Blood neutrophil-to-lymphocyte ratio predicts survival in patients with colorectal liver metastases treated with systemic chemotherapy. Ann Surg Oncol. 2009;16:614-622. [PubMed] [DOI] |
| 18. | Proctor MJ, Morrison DS, Talwar D, Balmer SM, Fletcher CD, O'Reilly DS, Foulis AK, Horgan PG, McMillan DC. A comparison of inflammation-based prognostic scores in patients with cancer. A Glasgow Inflammation Outcome Study. Eur J Cancer. 2011;47:2633-2641. [PubMed] [DOI] |
| 19. | Proctor MJ, McMillan DC, Morrison DS, Fletcher CD, Horgan PG, Clarke SJ. A derived neutrophil to lymphocyte ratio predicts survival in patients with cancer. Br J Cancer. 2012;107:695-699. [PubMed] [DOI] |