修回日期: 2015-08-18
接受日期: 2015-08-26
在线出版日期: 2015-09-28
目的: 探讨四君子汤对溃疡性结肠炎(ulcerative colitis, UC)小鼠模型肠黏膜屏障的作用机制.
方法: 50只♂BALB/c小鼠, 体质量18-20 g, 随机分为正常组、模型组、四君子汤低剂量组(2.25 g/kg)、中剂量组(4.50 g/kg)、高剂量组(9.01 g/kg). 正常组自由饮用蒸馏水, 其余4组给予3%葡聚糖硫酸钠(dextran sulphate sodium, DSS)溶液7 d诱导建立UC模型. 第8天起, 正常组、模型组予蒸馏水灌胃, 四君子汤各组按不同剂量四君子汤灌胃, 每天进行疾病活动指数(disease active index, DAI)评分. 第15天处死小鼠, ELISA法测量血浆中D-乳酸水平, 免疫组织化学法检测结肠黏膜occludin蛋白的表达.
结果: 与正常组相比, 模型组、四君子汤各组DAI评分和结肠组织病理评分升高(P<0.01), 而四君子汤中、高剂量组DAI评分和结肠组织病理评分较模型组下降(P<0.01). 模型组结肠黏膜充血糜烂, 而四君子汤能改善结肠黏膜损伤. 模型组血浆D-乳酸含量明显增加, 四君子汤各组较模型组减少. 免疫组织化学结果提示模型组occludin蛋白表达较正常组减少, 四君子汤中、高剂量组较模型组表达增多. 四君子汤低剂量组DAI评分、结肠组织病理评分、occludin蛋白与模型组比较差异无统计学意义.
结论: 四君子汤可以改善DSS诱导的UC小鼠的临床表现、镜下表现, 同时降低血浆D-乳酸含量、增加肠黏膜occludin蛋白的表达, 其作用机制可能与改善肠黏膜屏障的通透性、保护肠黏膜屏障有关.
核心提示: 紧密连接蛋白是肠黏膜屏障的重要组成部分, 保护肠黏膜屏障对治疗溃疡性结肠炎(ulcerative colitis, UC)至关重要. 本实验研究发现中药四君子汤能够保护UC小鼠的肠黏膜屏障功能, 缓解UC小鼠的临床症状, 为四君子汤治疗UC提供理论基础.
引文著录: 黄婧渝, 农辉, 裴羡, 黄雪, 谭至柔, 覃蒙斌, 李卉, 张钰琴. 四君子汤对溃疡性结肠炎小鼠模型肠黏膜屏障的作用机制. 世界华人消化杂志 2015; 23(27): 4326-4334
Revised: August 18, 2015
Accepted: August 26, 2015
Published online: September 28, 2015
AIM: To investigate the effect of Sijunzi decoction (SJZD) on the intestinal mucosal barrier of mice with dextran sulphate sodium (DSS)-induced ulcerative colitis and the underlying mechanism.
METHODS: Fifty male BALB/c mice were randomly divided into five groups, including a normal group, a DSS group, and low-, medium- and high-dosage SJZD groups. Except the normal group, the other four groups were given distilled water containing 3% DSS for 7 d to induce experimental colitis. From day 8 to day 14, the normal group and DSS group were given distilled water (0.3 mL/d) by gavage, and the three SJZD groups were treated with different dosages of SJZD (2.25, 4.50 and 9.01 g/kg, respectively). Disease active index (DAI) scores were calculated. On day 15, plasma and colon tissue samples were taken from mice to measure levels of plasma D-lactate by ELISA, and expression of occludin by immunohistochemistry, respectively.
RESULTS: Compared with the normal group, the DAI and histological scores were significantly elevated in the DSS group and the three SJZD groups (P < 0.01). However, DAI and histologic scores were significantly decreased in the medium- and high-dosage SJZD groups when compared with the DSS group (P < 0.01). DSS-induced murine colitis showed ulcer, hyperemia, interstitial edema, and infiltration of inflammatory cells. Different dosages of SJZD significantly reduced histopathological injury. Plasma D-lactate was significantly increased in the DSS group, but was decreased in the three SJZD groups compared with the DSS group. Compared with the DSS group, the expression of occludin in the medium- and high-dosage SJZD groups was improved; the mean density of occludin was significantly lower in the DSS group than in the normal group, but was significantly increased in the medium- and high-dosage groups compared with the DSS group. There were no significant differences in DAI, histological score or the expression of occludin between the DSS group and the low-dosage SJZD group.
CONCLUSION: SJZD can ameliorate the clinical manifestations and the microscopic changes of ulcerative colitis in mice, decrease plasma D-lactate, and increase the expression of occludin, and these mechanisms may be related to the effect of SJZD in improving the permeability of intestinal mucosal barrier and protecting the intestinal mucosal barrier.
- Citation: Huang JY, Nong H, Pei X, Huang X, Tan ZR, Qin MB, Li H, Zhang YQ. Mechanism underlying effect of Sijunzi decoction on intestinal mucosal barrier of mice with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2015; 23(27): 4326-4334
- URL: https://www.wjgnet.com/1009-3079/full/v23/i27/4326.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i27.4326
溃疡性结肠炎(ulcerative colitis, UC)是一种直肠与结肠的慢性非特异性炎症性疾病. 肠黏膜屏障在UC发病机制中占重要地位, 紧密连接蛋白是肠黏膜屏障的主要组成部分, 维持紧密连接的完整性、保护肠黏膜屏障对治疗UC至关重要. 过去, UC在亚洲地区发病率较低, 但近年来, 我国乃至亚洲地区的UC发病率呈逐年上升趋势[1,2]. UC不仅病情易反复, 而且严重影响患者工作生活质量. 传统药物治疗UC存在一定的局限性, 而一部分学者发现使用中药如四君子汤(Sijunzi decoction, SJZD)治疗UC取得了一定的效果[3-5]. SJZD能够调节肠道免疫、肠道菌群平衡[6], 但其对UC的具体作用机制仍不明确. 本研究以3%浓度的葡聚糖硫酸钠(dextran sulphate sodium, DSS)制备UC小鼠模型, 予不同剂量SJZD进行干预, 观察SJZD对UC小鼠的疗效, 探讨SJZD对UC小鼠肠黏膜屏障的影响及对紧密连接occludin的作用, 揭示SJZD在UC中的可能机制.
实验动物BALB/c♂小鼠50只, 体质量18-20 g, 清洁级, 由广西医科大学实验动物中心提供, 实验动物生产许可证号: SCXK桂2014-0002; DSS购自美国MP公司; SJZD以人参、山药、白术、茯苓按体质量比10:9:9:6混合, 蒸馏水浸泡2 h, 煎煮2次, 每次40 min, 过滤, 合并2次滤液, 浓缩至生药含量为1 g/mL, 所有药材均购自老百姓大药房; 血浆D-乳酸检测试剂盒购自苏州卡尔文公司; 免疫组织化学SP法试剂盒、DAB试剂盒购自中杉金桥公司; occludin蛋白一抗购自博奥森公司; 大便隐血试纸由美利泰格诊断试剂(嘉庆)有限公司提供; EP管、盖玻片等其他试剂耗材购自南宁市艾玛特生物公司.
1.2.1 造模: 50只♂BALB/c小鼠, 随机分为正常组、模型组、SJZD低剂量组、SJZD中剂量组、SJZD高剂量组, 每组10只. 除正常组自由饮用蒸馏水外, 其余各组自由饮用3%浓度的DSS溶液7 d. 第8天起, 模型组和SJZD低、中、高剂量组改为自由饮用蒸馏水, 并进行灌胃给药干预. 正常组、模型组予灌胃蒸馏水, 根据参考文献[7]进行剂量换算, SJZD低剂量组、SJZD中剂量组、SJZD高剂量组分别按2.25、4.50、9.01 g/kg灌胃给药, 每次灌胃体积0.3 mL, 1次/d, 连续7 d.
1.2.2 DAI评分: 每天观察并记录所有小鼠的一般情况、体质量变化、大便性状、大便隐血情况, 按照疾病活动指数(disease active index, DAI)表进行评分. DAI评分包括体质量下降(%)、大便性状、大便隐血/肉眼血便, 以下为各项具体评分标准, 体质量下降(%): 0, 计0分; 1-5, 计1分; 6-10, 计2分; 11-15, 计3分; >15, 计4分; 大便性状: 正常(成形大便), 计0分; 松散(不黏附于肛门的糊状、半成形大便), 计2分; 稀便(可黏附于肛门的稀水样便), 计4分; 大便隐血/肉眼血便: 正常, 计0分; 隐血阳性, 计2分; 肉眼血便, 计4分; DAI = (体质量下降评分+大便性状评分+大便隐血情况评分)/3.
1.2.3 血浆D-乳酸的检测: 第15天, 腹腔注射水合氯醛麻醉小鼠, 进行心脏采血, 按ELISA试剂盒说明书操作检测血浆D-乳酸含量, 结果用μmol/L表示.
1.2.4 结肠组织形态学观察: 沿矢状线正中切开腹部, 迅速分离小鼠结肠, 测量结肠长度, 沿肠系膜纵轴剪开肠腔, 冰生理盐水冲洗污物, 肉眼观察结肠充血溃疡情况, 截取病变明显处结肠组织, 长约1 cm, 于40 g/L甲醛溶液固定, 行常规HE染色, 观察结肠黏膜形态学变化, 采用结肠组织病理评分表进行评分. 结肠组织病理评分包括炎症、损伤深度、隐窝损伤、炎症范围(%), 以下为各项具体评分标准, 炎症: 无, 计0分; 轻度, 计1分; 中度, 计2分; 重度, 计3分; 损伤深度: 黏膜层, 计2分; 黏膜及黏膜下层, 计3分; 全层, 计4分; 隐窝损伤: 无, 计0分; 基底部1/3隐窝破坏, 计1分; 基底部2/3隐窝破坏, 计2分; 仅表面上皮完整, 计3分; 全部隐窝和上皮破坏, 计4分; 炎症范围(%): 1-25, 计1分; 26-50, 计2分; 51-75, 计3分; 76-100, 计4分; 结肠组织病理评分 = 炎症评分+损伤深度评分+隐窝损伤评分+炎症范围(%)评分.
1.2.5 结肠黏膜上皮occludin蛋白检测: 切片后按照免疫组织化学SP试剂盒的方法进行免疫组织化学操作, 采用Image Pro Plus6.0图像分析系统显微镜下分析免疫组织化学结果(×400), 对各切片中抗体光密度测定, 数据用mean±SD表示.
统计学处理 应用SPSS16.0软件进行统计学分析, 各组数据采用方差分析, 数据采用mean±SD表示, P<0.05为差异有统计学意义.
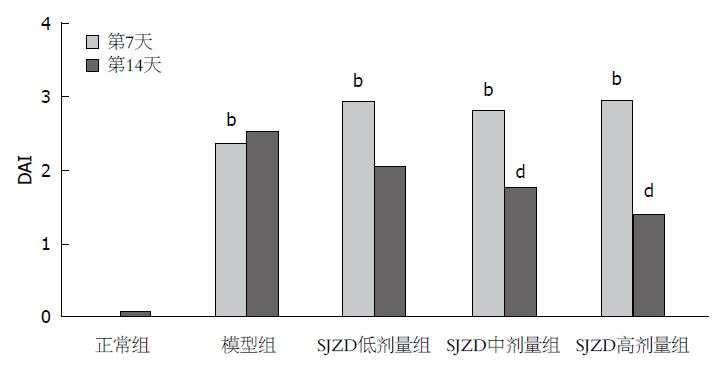
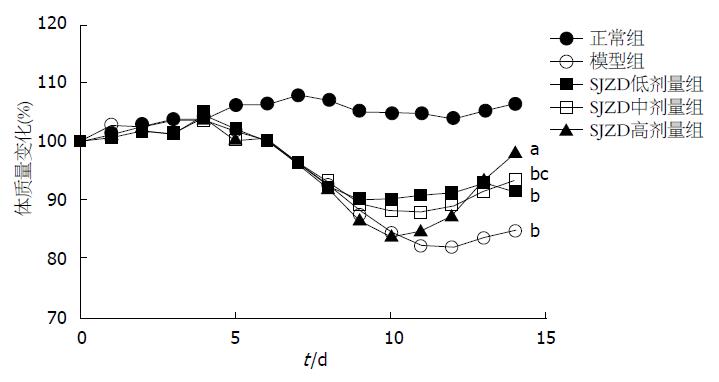
正常组小鼠饮水、饮食、活动正常, 体质量逐渐增加, 大便性状及大便隐血情况正常. 其余各组小鼠在摄入3%浓度DSS后, 逐渐出现大便隐血阳性、不黏附于肛门的半成形大便. 第4-5天, 小鼠精神萎靡、喜扎堆、毛发色泽暗淡, 部分小鼠出现肉眼血便和稀水样便, 体质量下降. 第7天, 可观察到小鼠有不同程度的肉眼血便和稀水样便, 体质量明显下降, 活动减少, 与正常组相比, 其余各组的DAI评分增加(P<0.01). 第8-14天, 模型组仍有大便隐血阳性, SJZD各组在给药干预后症状均有不同程度的缓解, 体质量较前增加, 便血、稀水样便明显改善, 其中SJZD中、高剂量组便血例数明显减少, 大便性状、隐血情况甚至恢复正常. 与正常组相比, 模型组、SJZD各组DAI评分升高(P<0.01); 与模型组相比, SJZD中、高剂量组的DAI评分降低(P<0.01), 而SJZD低剂量组与模型组差异无统计学意义(表1, 图1, 2).
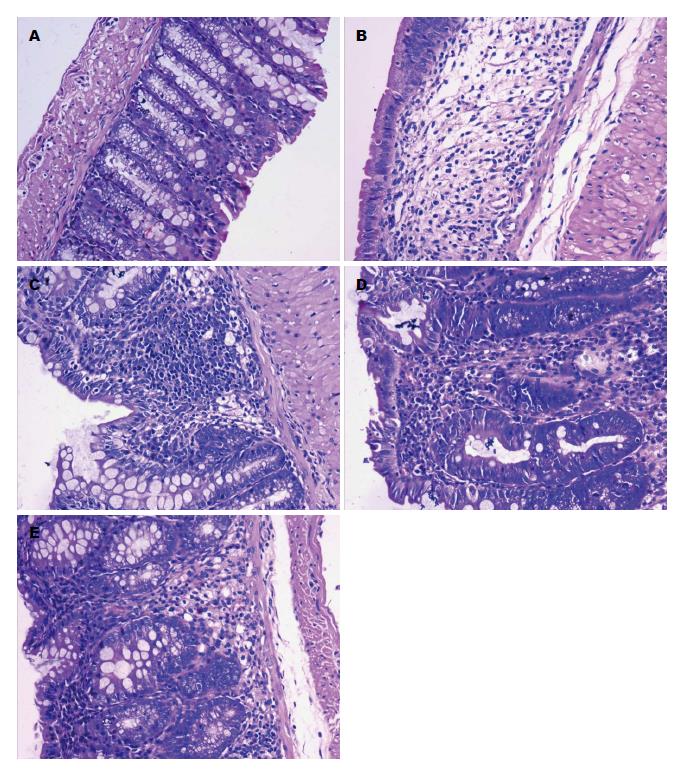
正常组: 黏膜腺体排列整齐, 黏膜上皮完整, 偶见炎细胞浸润. 模型组: 结肠黏膜溃疡形成, 腺体结构扭曲、杯状细胞消失, 黏膜充血糜烂, 伴大量炎细胞浸润. SJZD各组: 结肠黏膜溃疡处不同程度修复, 腺体、杯状细胞较模型组增多, 黏膜层仍有炎细胞浸润, 其中SJZD高剂量组的恢复情况明显优于SJZD低、中剂量组. 与正常组相比, 其余各组结肠组织病理评分升高(P<0.01). 其中, SJZD中、高剂量组的结肠组织病理评分较模型组降低(P<0.01), 与模型组相比, SJZD低剂量组的差异无统计学意义(表1, 图3).
与正常组相比, 模型组血浆D-乳酸含量明显升高(P<0.01), 而SJZD各组与正常组无显著差异. 与模型组比较, SJZD低、中、高剂量组的D-乳酸含量有不同程度的下降(P<0.01), 其中SJZD高剂量组下降最为明显(表1).
UC属于炎症性肠病(inflammatory bowel disease, IBD)的一种, 临床表现以腹泻、腹痛、黏液脓血便为主. 现今治疗UC的药物包括氨基水杨酸类、糖皮质激素、免疫抑制剂、生物制剂等, 当UC患者对药物耐受或是无应答, 可以逐渐进行"升阶"治疗[8]. 采用"升阶"治疗后, UC患者仍然面临着对药物耐受或无应答的风险和越来越重的经济负担. 当下研究IBD的治疗热点常与肠道菌群微生物、肠道病毒、肠黏膜屏障等有关[9-11], 在此研究基础上出现了治疗IBD的新方法, 如肠道菌群移植[12], 然而, 这些新方法至现今仍缺乏大型的临床试验支持, 疗效成功与否仍然存在争议.
中医上认为UC属于"久痢""肠癖"等范畴, 其与六淫邪气、七情内伤等有关, 病机以脾虚为本[13,14]. 通过辨证施治, 有学者使用中药方剂SJZD治疗UC患者, 治疗后患者的腹痛、腹泻、黏液脓血便等临床症状得到改善[3-5]. SJZD为益气健脾的经典方剂, 其能够调节肠道免疫、肠道菌群平衡[6]. Liu等[15]观察到SJZD的有效成分SJZD多糖促进受损肠上皮细胞的再生和重建. 张燕翔等[16]通过动物实验发现SJZD可能通过改善抗氧自由基、细胞因子来缓解UC, 而另外的学者则指出SJZD可能参与调控端粒活性和修复肠黏膜屏障[17]. 虽然SJZD治疗UC取得了一定的效果, 但其对UC的具体作用机制仍没有达成一致的共识. 本实验中以3%浓度DSS法[18,19]诱导建立UC小鼠模型, 探讨SJZD对UC的可能机制. 第7天造模后的小鼠出现体质量下降, 肉眼血便、稀水样便, DAI评分较正常组升高(P<0.01). 经治疗后, SJZD中、高剂量组的DAI评分较模型组降低(P<0.01), 而SJZD低剂量组与模型组差异无统计学意义, 说明SJZD能有效缓解UC的临床症状, 在一定范围内有浓度依赖性, 浓度越高, 效果越好. 本实验中SJZD能够缓解UC小鼠的临床表现, 与张燕翔等[16]在UC大鼠中运用四君子汤的疗效结果基本一致.
肠黏膜屏障在UC中作用越来越得到人们的重视. 肠黏膜屏障是肠道防御机制最重要的环节, 当肠黏膜屏障被破坏后, 肠黏膜的渗透性发生改变, 之后诱发一系列炎症反应, 最终导致组织的损伤[20]. Schmitz等[21]研究发现UC患者的肠黏膜屏障功能受损. 肠黏膜屏障以机械屏障最为重要, 机械屏障包括完整的肠上皮细胞及细胞间连接[11], 其中紧密连接在机械屏障中起主导作用, 他具有屏障功能和栅栏功能[22,23], 紧密连接蛋白位于相邻细胞之间的顶端, 是细胞间最主要的连接方式, 他能封闭上皮细胞之间的间隙, 调控肠黏膜的通透性, 允许离子、小分子可溶性物质通过, 阻止肠腔内的细菌、内毒素等有害物质渗入肠黏膜下层[11]. Chen等[24]发现, 运用药物干预克罗恩和UC小鼠模型, 小鼠的症状得到改善, 而肠黏膜屏障中的紧密连接和肠黏膜渗透性也得到修复, 稳定紧密连接和维持黏膜屏障功能对治疗IBD患者可能有巨大的价值.
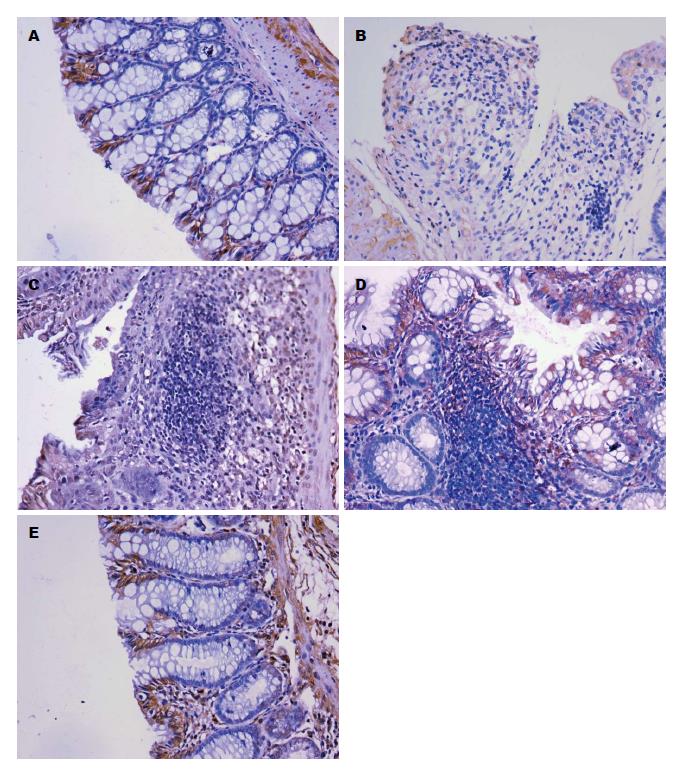
occludin蛋白[25]是构成紧密连接的主要蛋白[26,27]. 结构上, occludin蛋白有4个横跨膜区域、2个细胞外环和1个细胞内环. 功能上, 丝/苏氨酸磷酸化、细胞因子、Rho相关激酶等因素对occludin蛋白的作用进行调控, 进而对紧密连接的屏障功能发挥作用[22]. 在Caco-2细胞中敲除occludin蛋白后, 细胞间渗透性增加[28]. UC小鼠模型的结肠病变越严重, 相应地occludin蛋白表达亦越少[29]. 因此, occludin蛋白数量的变化在一定程度上提示了肠黏膜屏障功能的变化. 在本实验中, 模型组结肠黏膜上皮被破坏, occludin蛋白表达于残存的完整腺体之间及胞质内, 较正常组减少(P<0.01), 结肠组织病理评分升高(P<0.01); 而经SJZD治疗后, 损伤的结肠黏膜得到修复, SJZD中、高剂量组的occludin蛋白的表达较模型组增多(P<0.05, P<0.01), 且结肠组织病理评分下降(P<0.01), 而SJZD低剂量组结肠组织病理评分和occludin蛋白的表达与模型组比较无差异. Yamamoto-Furusho等[30]认为活动期UC患者occludin蛋白的表达高于缓解期UC患者和健康对照组, 然而, 在本次实验中我们发现UC模型小鼠occludin蛋白的表达低于治疗组. 本实验结果说明一定浓度的SJZD可能是通过增加occludin蛋白的表达, 从而修复肠黏膜上皮屏障, 维持肠黏膜的通透性.
当肠黏膜屏障被破坏, 肠黏膜通透性也随之增加. D-乳酸是肠道细菌发酵代谢的产物, 在正常情况下很少被吸收, 他一般通过肾脏排泄. 哺乳类动物不具备将其快速降解的酶系统, 当肠黏膜屏障被破坏, 肠道细菌代谢的D-乳酸可通过受损的黏膜进入血液循环系统, 使血液的D-乳酸水平升高. Song等[31]发现, UC患者血液中D-乳酸含量较正常人明显升高, 治疗后的D-乳酸含量较治疗前下降. 动物实验也发现肠黏膜损伤的小鼠血浆中D-乳酸明显升高[32]. 本实验发现, 模型组D-乳酸较正常组明显升高(P<0.01), SJZD干预后的D-乳酸含量较模型组下降(P<0.01), 提示SJZD能够改变肠黏膜通透性, 进一步说明SJZD能够恢复受损的肠黏膜屏障功能.
总之, SJZD可以改善DSS诱导的UC小鼠的临床表现、镜下表现, 降低血浆中的D-乳酸含量、增加肠黏膜occludin蛋白的表达, 其作用机制可能与改善肠黏膜屏障的通透性、保护肠黏膜屏障有关.
溃疡性结肠炎(ulcerative colitis, UC)是当今难治性疾病之一, 现今的治疗手段较为局限. 近年来研究发现中药四君子汤治疗UC取得一定疗效, 此外, 动物实验表明四君子汤可能通过修复受损的肠黏膜屏障对UC起作用. 肠黏膜屏障是肠道防御外界不良因素侵犯的重要屏障, 而紧密连接蛋白在肠黏膜屏障中起主导作用.
刘杰民, 副主任医师, 贵州省人民医院消化内镜科
肠黏膜屏障在UC中的作用及运用中药治疗UC越来越得到重视, 改善肠黏膜屏障的功能可能会逆转UC的病变. 虽然四君子汤已运用于UC的治疗, 但其对UC中肠黏膜屏障的具体作用机制仍不明确, 需进一步的研究.
Liu等发现, 在药物诱导下受损的大鼠肠上皮细胞中, 四君子汤多糖可以促进受损肠上皮细胞的再生和重建, 增强单层肠上皮细胞的迁移. 张燕翔等报道了四君子汤能够改善UC大鼠的炎症反应, 修复抗氧自由基的损伤, 降低抑制性神经递质γ-氨基丁酸受体的表达.
四君子汤对于UC肠黏膜屏障作用机制的研究十分有限. 本实验提示了四君子汤可以缓解UC小鼠的炎症表现, 对结肠上皮细胞间的紧密连接蛋白occludin有修复作用, 且改善了肠黏膜屏障的渗透性, 恢复了肠黏膜屏障功能.
本实验运用UC小鼠动物模型, 研究了四君子汤与UC肠黏膜屏障紧密连接蛋白的关系, 观察不同剂量四君子汤对UC的作用, 为进一步运用四君子汤治疗UC提供理论基础.
紧密连接: 由occludin蛋白、claudin蛋白、tricellulin、ZO、连接黏附分子等一系列蛋白相互作用所形成的复杂的蛋白体系, 他位于相邻细胞之间的顶端, 是细胞间最主要的连接方式.
本文初步探讨了四君子汤对肠黏膜屏障的作用机制, 为进一步研究中药治疗UC奠定了基础.
编辑: 于明茜 电编: 都珍珍
| 1. | Bernstein CN, Fried M, Krabshuis JH, Cohen H, Eliakim R, Fedail S, Gearry R, Goh KL, Hamid S, Khan AG. World Gastroenterology Organization Practice Guidelines for the diagnosis and management of IBD in 2010. Inflamm Bowel Dis. 2010;16:112-124. [PubMed] [DOI] |
| 2. | Yang H, Li Y, Wu W, Sun Q, Zhang Y, Zhao W, Lv H, Xia Q, Hu P, Li H. The incidence of inflammatory bowel disease in Northern China: a prospective population-based study. PLoS One. 2014;9:e101296. [PubMed] [DOI] |
| 7. | 赵 效国. 新编医学动物实验设计与方法. 北京: 科学出版社 2009; 79-80. |
| 8. | Bressler B, Marshall JK, Bernstein CN, Bitton A, Jones J, Leontiadis GI, Panaccione R, Steinhart AH, Tse F, Feagan B. Clinical practice guidelines for the medical management of nonhospitalized ulcerative colitis: the Toronto consensus. Gastroenterology. 2015;148:1035-1058.e3. [PubMed] [DOI] |
| 9. | Bernstein CN. Antibiotics, probiotics and prebiotics in IBD. Nestle Nutr Inst Workshop Ser. 2014;79:83-100. [PubMed] [DOI] |
| 10. | Norman JM, Handley SA, Baldridge MT, Droit L, Liu CY, Keller BC, Kambal A, Monaco CL, Zhao G, Fleshner P. Disease-specific alterations in the enteric virome in inflammatory bowel disease. Cell. 2015;160:447-460. [PubMed] [DOI] |
| 11. | Salim SY, Söderholm JD. Importance of disrupted intestinal barrier in inflammatory bowel diseases. Inflamm Bowel Dis. 2011;17:362-381. [PubMed] [DOI] |
| 12. | Grinspan AM, Kelly CR. Fecal Microbiota Transplantation for Ulcerative Colitis: Not Just Yet. Gastroenterology. 2015;149:15-18. [PubMed] [DOI] |
| 15. | Liu L, Han L, Wong DY, Yue PY, Ha WY, Hu YH, Wang PX, Wong RN. Effects of Si-Jun-Zi decoction polysaccharides on cell migration and gene expression in wounded rat intestinal epithelial cells. Br J Nutr. 2005;93:21-29. [PubMed] |
| 18. | Vowinkel T, Kalogeris TJ, Mori M, Krieglstein CF, Granger DN. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Dig Dis Sci. 2004;49:556-564. [PubMed] [DOI] |
| 19. | Okayasu I, Hatakeyama S, Yamada M, Ohkusa T, Inagaki Y, Nakaya R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 1990;98:694-702. [PubMed] |
| 20. | Lee SH. Intestinal permeability regulation by tight junction: implication on inflammatory bowel diseases. Intest Res. 2015;13:11-18. [PubMed] [DOI] |
| 21. | Schmitz H, Barmeyer C, Gitter AH, Wullstein F, Bentzel CJ, Fromm M, Riecken EO, Schulzke JD. Epithelial barrier and transport function of the colon in ulcerative colitis. Ann N Y Acad Sci. 2000;915:312-326. [PubMed] [DOI] |
| 22. | Krug SM, Schulzke JD, Fromm M. Tight junction, selective permeability, and related diseases. Semin Cell Dev Biol. 2014;36:166-176. [PubMed] [DOI] |
| 23. | Schulzke JD, Fromm M. Tight junctions: molecular structure meets function. Ann N Y Acad Sci. 2009;1165:1-6. [PubMed] [DOI] |
| 24. | Chen P, Bakke D, Kolodziej L, Lodolce J, Weber CR, Boone DL, Toback FG. Antrum Mucosal Protein-18 Peptide Targets Tight Junctions to Protect and Heal Barrier Structure and Function in Models of Inflammatory Bowel Disease. Inflamm Bowel Dis. 2015; Jul 18. [Epub ahead of print]. [PubMed] [DOI] |
| 25. | Cummins PM. Occludin: one protein, many forms. Mol Cell Biol. 2012;32:242-250. [PubMed] [DOI] |
| 26. | Ando-Akatsuka Y, Saitou M, Hirase T, Kishi M, Sakakibara A, Itoh M, Yonemura S, Furuse M, Tsukita S. Interspecies diversity of the occludin sequence: cDNA cloning of human, mouse, dog, and rat-kangaroo homologues. J Cell Biol. 1996;133:43-47. [PubMed] [DOI] |
| 27. | Chen Y, Zhang HS, Fong GH, Xi QL, Wu GH, Bai CG, Ling ZQ, Fan L, Xu YM, Qin YQ. PHD3 Stabilizes the Tight Junction Protein Occludin and Protects Intestinal Epithelial Barrier Function. J Biol Chem. 2015;290:20580-20589. [PubMed] [DOI] |
| 28. | Al-Sadi R, Khatib K, Guo S, Ye D, Youssef M, Ma T. Occludin regulates macromolecule flux across the intestinal epithelial tight junction barrier. Am J Physiol Gastrointest Liver Physiol. 2011;300:G1054-G1064. [PubMed] [DOI] |
| 29. | 李 茹柳, 迟 莉, 郭 文峰, 李 秋霞, 徐 颂芬, 陈 蔚文. 紧密连接蛋白occludin和claudin-1在大鼠溃疡性结肠炎的表达. 广州中医药大学学报. 2008;25:83-87. |
| 30. | Yamamoto-Furusho JK, Mendivil-Rangel EJ, Fonseca-Camarillo G. Differential expression of occludin in patients with ulcerative colitis and healthy controls. Inflamm Bowel Dis. 2012;18:E1999. [PubMed] [DOI] |
| 31. | Song WB, Lv YH, Zhang ZS, Li YN, Xiao LP, Yu XP, Wang YY, Ji HL, Ma L. Soluble intercellular adhesion molecule-1, D-lactate and diamine oxidase in patients with inflammatory bowel disease. World J Gastroenterol. 2009;15:3916-3919. [PubMed] |