修回日期: 2015-08-03
接受日期: 2015-08-10
在线出版日期: 2015-09-08
目的: 定量原发性肝癌(primary liver cancer, PLC)患者外周血中血管生成素-2(angiopoietin-2, Ang-2)和高尔基体蛋白73(Golgi protein 73, GP73)表达水平, 探讨对PLC诊断与鉴别的临床价值.
方法: 以酶联免疫吸附法(ELISA)检测急、慢性肝炎, 肝硬化及PLC患者外周血Ang-2和GP73浓度; 以免疫组织化学分析肝癌及癌周组织Ang-2和GP73表达, 并以Western blot证实.
结果: 肝癌组织中呈棕黄色或棕褐色颗粒的GP73和Ang-2阳性表达, 主要分布于胞浆或胞膜上, 并经Western blot证实癌组织均明显高于周围组织(P<0.001). PLC患者外周血Ang-2水平为40.8 ng/mL±3.5 ng/mL, GP73为87.3 ng/mL±78.4 ng/mL, 均显著高于正常对照、急性肝炎、慢性肝炎和肝硬化组(P<0.01); 且Ang-2与GP73改变呈显著正相关(r = 0.987, P = 0.013); 受试者工作特征曲线下面积Ang-2 = 0.915, GP73 = 0.899, 与甲胎蛋白(α-fetoprotein, AFP)联检对PLC具有互补诊断价值.
结论: Ang-2和GP73过表达与PLC进展密切相关, 且有助于PLC的临床诊断与鉴别诊断.
核心提示: 肝癌组织中分布于胞浆或胞膜的高尔基体糖蛋白-73(Golgi protein 73, GP73)和血管生成素-2(angiopoietin-2, Ang-2)过表达, 经Western blot证实癌组织显著高于癌周组织; 肝癌患者血Ang-2和GP73表达均显著高于健康对照、急慢性肝炎和肝硬化患者, 两者表达呈显著正相关关系; 经受试者工作特征曲线分析, 两者均是肝癌诊断与鉴别诊断的有用标志物.
引文著录: 赛文莉, 陈雯, 姚登福, 邱历伟, 吴玮, 王理, 杨君伶, 张海健, 郑文杰. 联合检测Ang-2和GP73对原发性肝癌诊断与鉴别的临床价值. 世界华人消化杂志 2015; 23(25): 4032-4040
Revised: August 3, 2015
Accepted: August 10, 2015
Published online: September 8, 2015
AIM: To detect the expression of circulating angiopoietin-2 (Ang-2) and Golgi protein 73 (GP73) in patients with primary liver cancer and to analyze their value in the diagnosis and differential diagnosis of primary liver cancer (PLC).
METHODS: The levels of circulating Ang-2 and GP73 expression were detected by ELISA in patients with PLC, acute hepatitis, chronic hepatitis, or liver cirrhosis. The expression of Ang-2 and GP73 in cancerous and surrounding noncancerous tissues was analyzed by immunohistochemistry and confirmed by Western blot.
RESULTS: Positive expression of hepatic GP73 and Ang-2 was characterized by the presence of brown granules in the cytoplasm or cytomembrane. Hepatic GP73 and Ang-2 expression was significantly higher in cancerous tissue than in surrounding noncancerous tissue (P < 0.01). The levels of circulating Ang-2 and GP73 in PLC patients (40.8 ng/mL ± 3.5 ng/mL and 87.3 ng/mL ± 78.4 ng/mL, respectively) were significantly higher (P < 0.01) than those in normal subjects and patients with acute hepatitis, chronic hepatitis, or liver cirrhosis. There was a positive correlation between Ang-2 and GP73 (r = 0.987, P = 0.013). The area under the receiver operating curve (ROC) for the diagnosis of PLC was 0.915 for Ang-2 and 0.899 for GP73.
CONCLUSION: The overexpression of Ang-2 and GP73 is associated with HCC development and may be useful biomarkers for PLC diagnosis or differential diagnosis.
- Citation: Sai WL, Chen W, Yao DF, Qiu LW, Wu W, Wang L, Yang JL, Zhang HJ, Zheng WJ. Diagnostic value of combined detection of angiopoietin-2 and Golgi protein 73 in primary liver cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(25): 4032-4040
- URL: https://www.wjgnet.com/1009-3079/full/v23/i25/4032.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i25.4032
原发性肝癌(primary liver cancer, PLC)早期诊断和有效治疗, 仍是医学界难题[1,2]. 位于8号染色体长臂上(8q23.1)的血管生成素-2(angiopoietin-2, Ang-2)主要由血管内皮细胞合成, 能激活癌血管内皮细胞增殖, 其表达异常与肝癌发生早期的血管生成密切相关[3,4]. 目前认为Ang-2可以竞争性抑制Ang-1的血管稳定作用, 使肿瘤血管的结构破坏, 消除血管基底膜以及血管周围细胞对血管形成的限制, 同时促使内皮细胞被激活, 迅速发生增殖、侵袭、迁徙, 新生血管芽生. 定位于基因组9q21.33的高尔基体糖蛋白-73(Golgi protein 73, GP73), 是存在于细胞高尔基体的一种跨膜蛋白, 是病毒感染的肝细胞内具有正调节作用的固有高尔基蛋白[5,6]. 有研究[5]报道表明, GP73在肝癌患者手术标本及外周血中的表达水平明显上调, 有可能成为临床诊断肝细胞癌(hepatocellular carcinoma, HCC)的肿瘤学新指标. 本文定量测定了良、恶性肝病患者外周血Ang-2和GP73浓度, 以探讨用于临床PLC诊断与鉴别诊断的价值.
外周血标本: 经医学伦理委员会同意, 于2012-02/2015-02在南通大学附属医院收集肝癌患者外周血(n = 141, 男117例, 女24例, 平均年龄57.5岁±11.6岁), 其中Child-Pugh分类分别有A级87例, B级34例和C级16例; 良性肝病患者(n = 84): 肝硬化(n = 35, 男15例, 女20例, 平均年龄54.5岁±12.9岁)、慢性肝炎(n = 28, 男22例, 女6例, 平均年龄41.1±12.7岁)、急性肝炎(n = 22, 男17例, 女5例, 平均年龄40.5岁±12.4岁); 并以健康体检人群的外周血为正常对照(n = 27, 男12例, 女15例, 平均年龄45.6岁±5.9岁)(表1). 经临床检查肝、肾功能均在正常参考范围, 且乙型肝炎病毒(hepatitis B virus, HBV)血清学标志均为阴性.
| 分组 | n | 性别 (男/女) | 年龄 (岁) | HBsAg (阳性/阴性) | AFP浓度(ng/mL) | ||
| ≤20 | 21-399 | ≥400 | |||||
| PLC | 141 | 117/20 | 33-85 | 110/27 | 45 | 56 | 40 |
| 肝硬化 | 35 | 15/20 | 20-82 | 22/13 | 27 | 5 | 3 |
| 慢性肝炎 | 28 | 22/6 | 18-63 | 21/5 | 22 | 6 | 0 |
| 急性肝炎 | 22 | 17/5 | 24-80 | 10/12 | 18 | 4 | 0 |
| 正常人 | 27 | 12/15 | 26-69 | 0/27 | 27 | 0 | 0 |
肝组织标本: 按照自身配对原则, 随机选取肝癌术后癌灶、癌旁(距癌灶边缘<3 cm)组织标本, 共38例, 平均年龄52.05岁±9.11岁. 患者术前均未接受过化疗、放疗或介入治疗. 以上所有病例均有完整病理诊断、住院记录和随访资料, 符合全国肝癌防治协作组制定的肝癌临床诊断标准[7].
血Ang-2检测采用双抗体夹心反向竞争ELISA法, 试剂盒购自ADL Biotech Dev Co., USA; 血GP73检测采用双抗体夹心法, 试剂盒购自ADL Biotech Dev Co., USA; 肝组织Ang-2及GP73蛋白抽提及浓度测定, 试剂盒购自上海碧云天生物技术研究所, 按使用说明书操作; PVDF膜购自Millipore公司; 羊抗人GP73单克隆抗体和HRP标记驴抗山羊IgG购自Santa Cruz公司; 抗Ang-2兔多克隆抗体以及HRP标记山羊抗兔IgG均为Abcam公司产品.
1.2.1 外周血Ang-2水平分析: 外周血中Ang-2的含量测定, 首先将Ang-2抗体包被于酶标板上, 待检标准品或者标本血清25 μL加入酶标板, 使Ang-2与连接于固相载体上的抗体特异性结合. 以洗涤液充分洗板后加入生物素化的Ang-2抗体; 洗板、拍干, 加入辣根过氧化物酶(horseradish peroxidase, HRP)标记的亲和素; 再次洗板、拍干并加入四甲基联苯胺(TMB). 经过氧化物酶的催化作用TMB转化成蓝色, 此时加入稀硫酸终止反应, 蓝色转为黄色, 在酶标仪上设定波长450 nm处检测样本吸光度A值. 样品中的Ang-2浓度与A450值成反比, 最后通过标准曲线计算出标本中Ang-2浓度.
1.2.2 定量检测外周血中GP73水平: 按照试剂盒操作说明配制S1-S7标准品, 浓度依次为3.12、6.25、12.50、25.00、50.00、100.00和200.00 ng/mL. 将GP73抗体包被于96孔微孔板中, 制成固相载体, 向微孔中依次加入标准品和血清标本, 洗板后加入生物素化的GP73抗体, 将未结合的生物素化抗体洗净后, 加入HRP标记的亲和素, 再次彻底洗涤后加入底物(TMB)显色. TMB在过氧化物酶的催化下转化成蓝色, 此时加稀硫酸终止反应, 转化成最终的黄色. 用酶标仪设定在450 nm处测吸光度(A值). 采用log-log双对数曲线拟合法, 以S1-S7浓度的对数值为横坐标, 相应各点A450值的对数值为纵坐标, 求得标准曲线公式及相关系数, 再根据样品中的GP73浓度与A450值成正比, 计算出标本中GP73含量.
1.2.3 免疫组织化学检测组织中Ang-2及GP73: 按照S-P试剂盒操作说明进行. 肝癌组织石蜡切片厚4 μm, 贴附于涂有白胶的载玻片上, 56 ℃, 烤片2 h. 用二甲苯脱蜡, 递减梯度乙醇水化. PBS液冲洗3次, 3 min/次. 加50 μL 3%过氧化酶, 室温孵育10 min灭活内源性过氧化酶的活性, ddH2O冲洗3次. 加50 μL 5%BSA封闭液, 室温孵育10 min. 加一抗(1:300)50 μL, 4 ℃过夜, PBS洗涤2 min×3次加50 μL生物素标记二抗(1:200), 37 ℃孵育30 min, PBS洗涤2 min×3次; 加50 μL链亲和素-过氧化酶溶液, 室温孵育10 min, 冲洗; 使用DAB显色试剂盒, 加100 μL新鲜配制DAB液, 3-10 min后终止反应, ddH2O冲洗, 苏木素浅染2 min, 冲淡返蓝, 递减梯度脱水干燥, 透明, 封固.
结果判断[8]: 设阴性空白对照(以PBS取代一抗), 同时阳性标本作对照. 镜下随机选取上、中、下、左、右五个视野, 对肝组织中Ang-2或GP73表达结果半定量分析: 以染色强度结合阳性细胞数百分比综合计分(两者乘积); 染色强度以多数细胞呈现的染色特性计分: 无着色计0分, 淡黄色计1分, 棕黄色计2分, 棕褐色计3分; 阳性细胞百分比即某类细胞在5个视野中计数阳性细胞平均数: 0-5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分.
1.2.4 Western blot检测Ang-2及GP73蛋白的表达: 准确称取湿质量100 mg肝癌组织或癌旁组织, 剪碎, 按照RIPA:PMSF = 100:1配制组织匀浆液, 取1 mL组织匀浆液加入匀浆器中, 在冰浴中充分匀浆. 匀浆后在冰浴中静置30 min, 全部吸取至1.5 mL离心管中, 于4 ℃冷冻离心机中离心12000 r/min×15 min, 分离出上清备用. 以蛋白标准品制标准曲线, BCA法测定肝组织蛋白浓度, 每个标本均以双复孔进行检测. 在酶标仪上设定波长562 nm处测定吸光度, 根据标准曲线计算出标本的蛋白浓度. 分别配制SDS聚丙烯酰胺10%分离胶及4%浓缩胶, 取30 μg待测蛋白样品+5×SDS上样缓冲液, 吹打混匀后于沸水浴100 ℃×5 min使蛋白充分变性. 离心后取上清上样. 将上样品均匀加入加样孔中进行电泳, 而后切胶、湿转至PVDF膜. 转膜结束后以TBST缓冲液洗5 min×3次, 配制含5%脱脂奶粉的TBST缓冲液室温下封闭1 h. 封闭结束以TBST在脱色摇床洗膜5 min×3次, 加入抗GP73山羊单克隆抗体(1:500稀释)或抗Ang-2兔多克隆抗体(1:500稀释), 置冰箱内4 ℃过夜. 洗膜5 min×3次, 对应加入HRP标记驴抗山羊IgG(1:1000稀释)或HRP标记山羊抗兔IgG(1:1000稀释, abcam公司), 置湿盒于室温孵育2 h; TBST洗膜5 min×3次, DAB显色, X光胶片曝光、显影、定影. PVDF膜用一抗、二抗去除液清洗后, 重新封闭, 以1:1000稀释的GAPDH单克隆抗体4 ℃孵育, 检测内参蛋白表达情况. Quantity one凝胶成像系统检查免疫印记图片, 以灰度值分析蛋白表达量.
统计学处理 用Graphapad Prism 5.0和Stata18.0统计分析软件进行绘图、处理和分析, 计量资料数据以mean±SD表示. 以受试者工作特征曲线(receiver operating curve, ROC)下面积分析、评价对肝癌诊断的灵敏度与特异性. 标本中样本均数两两比较, 采用独立样本t检验; 多样本均数比较, 采用单因素方差分析(One-way ANOVA)、t检验、Fisher确切概率和Pearson等级相关等方法进行分析. 比较Ang-2、GP73和甲胎蛋白(α-fetoprotein, AFP)作为肝癌标志物的敏感性、特异性以及对PLC的诊断效率, 敏感性 = 真阳性率/(真阳性率+假阴性率); 特异性 = 真阴性率/(真阴性率+假阳性率). P<0.05为差异有统计学意义.
良、恶性肝病患者外周血Ang-2和GP73表达的定量检测结果如表2. 可知PLC组外周血Ang-2和GP73平均表达水平, 明显高于良性肝病分类中的肝硬化组、慢性肝炎组、急性肝炎组及健康人群对照组. 从健康人群到肝炎、肝硬化、PLC, 两者表达逐渐上升. PLC患者血GP73和Ang-2均值分别为87.3 ng/mL和40.8 ng/mL, 分别达到正常对照检测值的3倍和2.3倍(P<0.001). 由表2对比可知, GP73和Ang-2的表达水平, 在不同的良性以及恶性肝病分组间差异均十分显著 (P<0.001).
结合临床病理特征分析发现, PLC患者外周血中Ang-2含量为40.8 ng/mL±3.5 ng/mL, 其阳性表达与性别、年龄未见明显相关; 与肿瘤组织大小、AFP浓度、HBsAg感染及肝外转移与否组间, 均未见明显的统计学差异. 肝癌患者外周血GP73水平为87.3 ng/mL±78.4 ng/mL, 与性别、年龄、肿瘤直径及AFP浓度间无明显差异, 与HBV感染、肝外转移组间差异显著(P<0.05)(表3).
| 病理学特征 | n | Ang-2 | t值 | P值 | GP73 | t值 | P值 |
| 性别 | 0.472 | 0.722 | 1.102 | 0.273 | |||
| 男 | 117 | 40.83±3.56 | 72.85±60.12 | ||||
| 女 | 24 | 40.56±2.92 | 89.28±92.41 | ||||
| 年龄(岁) | 1.570 | 0.118 | 1.204 | 0.231 | |||
| ≥50 | 111 | 40.55±3.16 | 74.63±60.48 | ||||
| <50 | 30 | 41.66±4.31 | 89.79±63.84 | ||||
| 肿瘤直径(cm) | 1.004 | 0.317 | 1.056 | 0.293 | |||
| ≥5.0 | 52 | 41.16±3.25 | 92.27±60.57 | ||||
| <5.0 | 89 | 40.56±3.52 | 79.51±51.09 | ||||
| AFP(ng/mL) | 0.250 | 0.803 | 1.001 | 0.318 | |||
| ≥400.0 | 40 | 40.68±3.55 | 91.08±65.17 | ||||
| <400.0 | 101 | 40.84±3.38 | 79.26±62.39 | ||||
| HBsAg | 0.904 | 0.368 | 2.228 | 0.028 | |||
| 阳性 | 107 | 40.64±3.46 | 98.51±62.74 | ||||
| 阴性 | 34 | 41.25±3.32 | 71.34±59.26 | ||||
| 肝外转移 | 1.485 | 0.140 | 2.087 | 0.039 | |||
| 有 | 57 | 41.30±3.52 | 78.40±77.23 | ||||
| 无 | 84 | 40.43±3.34 | 105.84±76.22 |
经相关性分析比较得出: 外周血中Ang-2与AFP水平明显相关(r = 0.984, P = 0.016); 同时检测出GP73与AFP水平明显相关(r = 0.961, P = 0.039), 并且GP73与Ang-2表达水平明显相关(r = 0.987, P = 0.013).
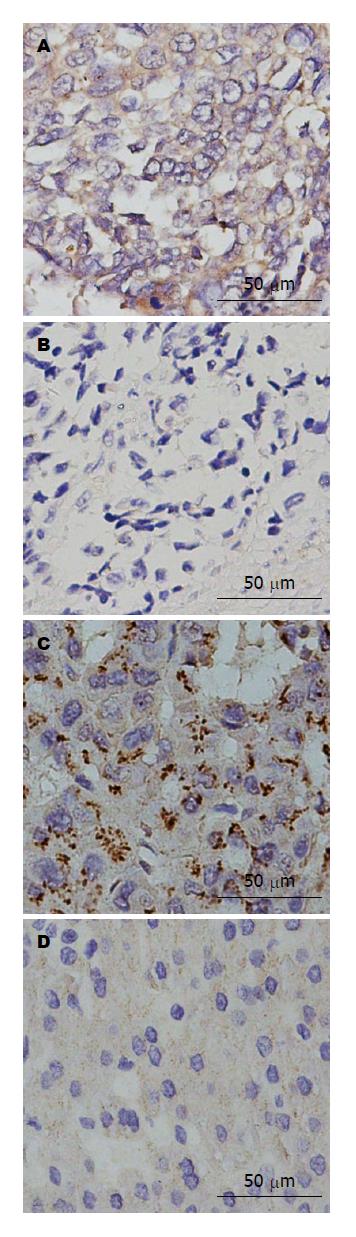
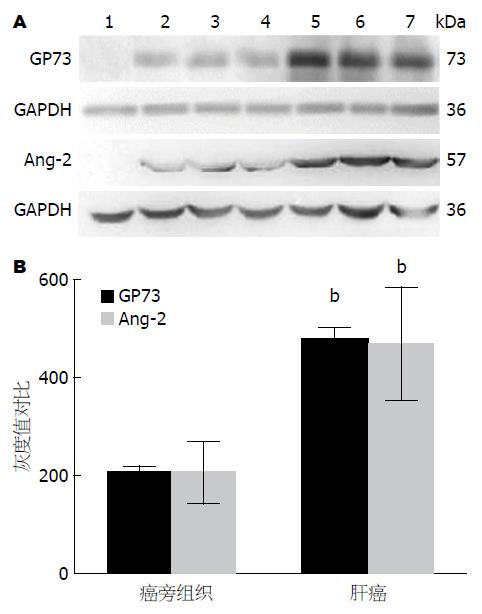
免疫组织化学分析发现, 肝癌组织中呈棕黄色或棕褐色颗粒GP73(图1A)呈强阳性表达, 其强度明显高于其癌周组织(图1B); Ang-2在肝癌组织中表达也呈棕黄色或棕褐色颗粒(图1C)的阳性表达, 癌组织明显高于癌周组织(图1D); 组织中两者的表达, 主要分布于胞浆或胞膜上. 经Western blot证实分子量为73 kDa的GP73和57 kDa的Ang-2(图2A)均呈强势表达; 相对定量分析显示癌组织GP73和Ang-2(图2B)表达均显著高于癌周组织(P<0.001).
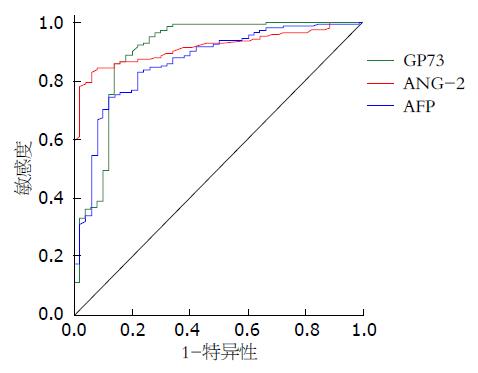
如图3显示, 在所分析的PLC患者中ROC曲线下面积分别是: ROCAng-2为0.915(95%CI: 0.876-0.954, P<0.05), ROCGP73为0.899(95%CI: 0.838-0.960, P<0.05), ROCAFP为0.864(95%CI: 0.805-0.923, P<0.05). 外周血Ang-2、GP73与AFP联检PLC灵敏度明显高于分别单独检测, 且联检对肝癌诊断具有较高的临床价值.
肝病组间血Ang-2、GP73和AFP表达存在明显差异, 以PLC患者表达水平最高, 若以Ang-2>35 ng/mL、GP73>70 ng/mL和AFP>50 ng/mL为界, 对PLC诊断的综合评价如表4. Ang-2诊断PLC敏感度、特异度和准确度均高于GP73和AFP; 若以Ang-2和AFP联合检查, 诊断PLC阳性率达98.6%(139/141).
| 指标 | Ang-2>35 ng/mL | GP73>70 ng/mL | AFP>50 ng/mL |
| 敏感度 | 95.0 | 77.7 | 67.5 |
| 特异度 | 98.4 | 76.9 | 86.2 |
| 真阳性 | 99.3 | 78.2 | 77.8 |
| 真阴性 | 89.7 | 61.3 | 64.6 |
| 准确度 | 96.1 | 88.0 | 84.4 |
Ang家族包括Ang-1、Ang-2、Ang-3和Ang-4. Ang-2由血管内皮细胞产生的一种分泌蛋白, 并存储在威贝尔-Palade小体, 在受到刺激后可以被迅速释放, 主要受体是血管内皮细胞表面的受体酪氨酸激酶2(Tie-2), 可调节内皮Tie-2活性, 用以快速控制血管反应[9,10]. Ang-1和Ang-2配体均是表达在内皮细胞上的Tie-2, 在血管发生中起关键作用[11-13]. Ang-2虽然与Ang-1同属Ang家族, 却是Ang-1的天然拮抗剂, 通过自分泌作用与血管内皮细胞以及管周细胞胞膜上的Tie-2受体结合, Ang-2可抑制Ang-1激活Tie-2. Ang-2主要作用是通过与Tie受体结合, 降低内皮细胞的稳定性, 激活内皮细胞, 破坏血管稳定性, 促进肝癌生长及转移[14,15]. 本文定量测定了良、恶性肝病患者外周血中Ang-2浓度, 并与GP73高表达阳性率进行比较, 以探讨对PLC诊断与鉴别诊断的临床价值.
在肝细胞癌变过程中, Ang-2浓度随着肝组织病理学改变呈动态增高, 提示肝细胞发生癌变使肿瘤对氧和营养物质的需求上升, 导致Ang-2合成增加, 促进新生血管形成. 定量分析良、恶性肝病患者血清Ang-2浓度, 表明血管形成相关因子动态增加与PLC进展关系密切[16,17]. 肝病患者外周血Ang-2表达, 随肝病发展逐步增加, 新血管形成给肿瘤组织提供足够养分, 利于癌细胞增殖及转移的发生[18]. Ang-2高表达水平时能抑制Ang-1的稳定血管作用, 导致新生血管管壁结构不完整, 渗透性增高. 通过细胞整合素激活黏着斑激酶(focal adhesion kinase, FAK)和c-jun氨基端激酶(c-jun N-terminal kinase, JNK), 能促进基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)表达与分泌, 引起内皮细胞迁移, 并形成新生血管, 为癌细胞的增殖和转移提供有利条件[19]. Ang-2激活癌血管内皮细胞增殖, 其表达异常与PLC进展密切相关. PLC患者Ang-2明显高于慢性肝炎和肝硬化患者, 提示Ang-2与血管增生与转移发生密切相关[20,21].
肝癌组织Ang-2及其受体表达明显高于癌旁组织, 其机制可能与拮抗Ang-1, 促进新血管形成及与肝癌生长和转移相关. 在肿瘤组织周围新发的血管重建区, 于毛细血管尚未形成时, 即可检测到Ang-2表达量增加, 参与新生血管构建起始及延续过程, 通过激活整联蛋白β1破坏血管稳定, 通过该蛋白沉积促进细胞骨架改变, 自分泌Ang-2信号令Tie-2沉默, 细胞间连接降低. 因Ang-2调节血管中含钙黏蛋白的内皮细胞间胞连接, 破坏血管稳定性, 加上血管内皮生长因子(vascular endothelial growth factor, VEGF)-A呈优势表达, 有利于促进血管新生和增强血管通透[22,23]. 近来研究[24,25]表明, GP73是近侧高尔基复合体的固有膜蛋白, 他在人的正常上皮细胞中优先表达, 与肝脏疾病关系密切, 尤其在肝细胞癌变时高度表达. 提示GP73与Ang-2的共同作用促进了肝癌进展.
在PLC患者中血清GP73、Ang-2和AFP表达水平明显高于正常对照组和良性肝病组, 可能在肝癌发生发展中起重要作用[26-28]. 且GP73表达与肝癌患者性别、年龄以及瘤体大小间无明显关联; 但与HBV感染与否、肿瘤发生转移或复发情况密切相关, 在急性肝细胞损伤和慢性肝病发展过程中发挥调控作用, 对肝癌转移和复发监测有临床意义[29,30]. 本研究结果表明, PLC患者血清中GP73表达量明显上调, 与正常对照组及良性肝病组间差异显著. 本组PLC病例中, HBsAg阳性率高达72.29%(107/147), 其中有HBV感染的PLC患者GP73水平明显升高, GP73与HBV感染与否的组间差异显著, 表明病毒感染肝细胞有促进GP73表达可能性, 但其具体机制尚不清楚, 有待进一步研究. 研究[31,32]发现, GP73、Ang-2和AFP表达呈正相关, 可能是由于肝细胞在受到病毒侵犯或细胞因子刺激后发生的宿主反应, 三者联检可提高PLC检出阳性率, 也是反映PLC侵袭生长及转移的有效指标.
肝组织血管生成素-2(angiopoietin-2, Ang-2)能激活癌血管内皮细胞增殖, 可使血管结构破坏, 消除血管基底膜以及血管周围细胞对血管形成的限制, 内皮细胞被激活迅速增殖、侵袭、迁徙, 新生血管芽生; 高尔基体糖蛋白-73(Golgi protein 73, GP73)使病毒感染后胞内具有正调节作用的固有高尔基蛋白表达明显上调, 有可能成为新的肝癌诊断与鉴别的有用标志物.
李孟森, 教授, 海南医学院/海南省肿瘤发生和干预重点实验室
国内、外研究主要集中在GP73对肝细胞癌(hepatocellular carcinoma, HCC)诊断方面, 尚无GP73在肝癌发生、发展机制的功能报道. 免疫组织化学技术发现GP73在肝癌组织表达明显高于癌旁组织, 与血管浸润、病理分期密切有关, 推测GP73与HCC侵袭、转移等恶性生物学特性相关.
以2-乙酰氨基芴喂饲大鼠诱发肝细胞癌变, 观察到随肝组织病理学改变, 肝细胞中GP73、Ang-2和VEGF表达、分布发生改变, 发现GP73、Ang-2及血管内皮生长因子(vascular endothelial growth factor, VEGF)表达进行性升高并呈正相关, 揭示GP73和Ang-2在肝癌发生发展过程中的动态表达规律.
尽管用于肝癌诊断与术后监测的标志物较多, 但在临床上发现其特异、实用、准确的生物标志尚不多, 根据外周血中GP73、Ang-2和AFP表达水平可改进肝癌阳性率的诊断, 且可用于肝癌转移复发的监测, 具有明显的临床应用前景.
GP73是近侧高尔基复合体的固有膜蛋白, Ang-2为血管生成相关因子, 在慢性肝病进展到肝癌过程中呈异常进行性表达. 与乙型肝炎病毒(hepatitis B virus, HBV)感染、肿瘤转移或复发密切相关, 两者与甲胎蛋白(alpha fetoprotein, AFP)表达呈正相关, 三者联检可提高原发性肝癌(primary liver cancer, PLC)诊断阳性率, 可反映PLC侵袭及转移.
Ang: 包括Ang-1、Ang-2、Ang-3和Ang-4. 位于8q23.1上Ang-2与Ang-1同属Ang家族, 互为拮抗, 是血管内皮细胞产生的一种分泌蛋白, 存储于威贝尔-Palade小体, 主要受体是血管内皮细胞表面的受体酪氨酸激酶2(Tie-2), 可调节内皮Tie-2活性, 以控制快速血管反应, 在血管发生中起关键作用.
该文的结果显示检测血清Ang-2和GP73表达, 预测肝癌发生的可能性, 对诊断肝癌发生有一定的指导价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Bruix J, Gores GJ, Mazzaferro V. Hepatocellular carcinoma: clinical frontiers and perspectives. Gut. 2014;63:844-855. [PubMed] [DOI] |
| 2. | Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet. 2012;379:1245-1255. [PubMed] [DOI] |
| 3. | El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology. 2012;142:1264-1273.e1. [PubMed] [DOI] |
| 4. | Benest AV, Kruse K, Savant S, Thomas M, Laib AM, Loos EK, Fiedler U, Augustin HG. Angiopoietin-2 is critical for cytokine-induced vascular leakage. PLoS One. 2013;8:e70459. [PubMed] [DOI] |
| 5. | Yang J, Li J, Dai W, Wang F, Shen M, Chen K, Cheng P, Zhang Y, Wang C, Zhu R. Golgi protein 73 as a biomarker for hepatocellular carcinoma: A diagnostic meta-analysis. Exp Ther Med. 2015;9:1413-1420. [PubMed] [DOI] |
| 6. | Jia Z, Wang L, Liu C, Yu Z, Chai L, Zhao M. Evaluation of α-fetoprotein-L3 and Golgi protein 73 detection in diagnosis of hepatocellular carcinoma. Contemp Oncol (Pozn). 2014;18:192-196. [PubMed] [DOI] |
| 8. | 王 以浪, 姚 登福, 吴 玮, 于 洪波, 赛 文莉, 钱 静, 李 姗姗, 卞 银珠. 肝癌组织核转录因子-κB表达与HBV复制及其临床病理学特征. 世界华人消化杂志. 2009;17:265-269. [DOI] |
| 9. | Matsubara T, Kanto T, Kuroda S, Yoshio S, Higashitani K, Kakita N, Miyazaki M, Sakakibara M, Hiramatsu N, Kasahara A. TIE2-expressing monocytes as a diagnostic marker for hepatocellular carcinoma correlates with angiogenesis. Hepatology. 2013;57:1416-1425. [PubMed] [DOI] |
| 10. | Ji Y, Wang Z, Li Z, Li K, Le X, Zhang T. Angiotensin II induces angiogenic factors production partly via AT1/JAK2/STAT3/SOCS3 signaling pathway in MHCC97H cells. Cell Physiol Biochem. 2012;29:863-874. [PubMed] [DOI] |
| 11. | Zhang ZL, Zhang JF, Yuan YF, He YM, Liu QY, Mao XW, Ai YB, Liu ZS. Suppression of angiogenesis and tumor growth in vitro and in vivo using an anti-angiopoietin-2 single-chain antibody. Exp Ther Med. 2014;7:543-552. [PubMed] |
| 12. | Carpizo DR, Gensure RH, Yu X, Gendel VM, Greene SJ, Moore DF, Jabbour SK, Nosher JL. Pilot study of angiogenic response to yttrium-90 radioembolization with resin microspheres. J Vasc Interv Radiol. 2014;25:297-306.e1. [PubMed] |
| 13. | Campillo A, Solanas E, Morandeira MJ, Castiella T, Lorente S, Garcia-Gil FA, Piazuelo E, de Martino A, Serrano MT. Angiogenesis and proliferation markers in adjacent cirrhotic tissue could predict hepatocellular carcinoma outcome after liver transplantation. Eur J Gastroenterol Hepatol. 2014;26:871-879. [PubMed] [DOI] |
| 14. | Li S, Yao D, Wang L, Wu W, Qiu L, Yao M, Yao N, Zhang H, Yu D, Ni Q. Expression characteristics of hypoxia-inducible factor-1α and its clinical values in diagnosis and prognosis of hepatocellular carcinoma. Hepat Mon. 2011;11:821-828. [PubMed] [DOI] |
| 15. | Miyahara K, Nouso K, Tomoda T, Kobayashi S, Hagihara H, Kuwaki K, Toshimori J, Onishi H, Ikeda F, Miyake Y. Predicting the treatment effect of sorafenib using serum angiogenesis markers in patients with hepatocellular carcinoma. J Gastroenterol Hepatol. 2011;26:1604-1611. [PubMed] [DOI] |
| 16. | Sharma BK, Srinivasan R, Kapil S, Singla B, Saini N, Chawla YK, Chakraborti A, Duseja A, Kalra N, Dhiman RK. Serum levels of angiogenic and anti-angiogenic factors: their prognostic relevance in locally advanced hepatocellular carcinoma. Mol Cell Biochem. 2013;383:103-112. [PubMed] [DOI] |
| 17. | Diaz-Sanchez A, Matilla A, Nuñez O, Lorente R, Fernandez A, Rincón D, Campos R, Bañares R, Clemente G. Serum angiopoietin-2 level as a predictor of tumor invasiveness in patients with hepatocellular carcinoma. Scand J Gastroenterol. 2013;48:334-343. [PubMed] [DOI] |
| 18. | Llovet JM, Peña CE, Lathia CD, Shan M, Meinhardt G, Bruix J. Plasma biomarkers as predictors of outcome in patients with advanced hepatocellular carcinoma. Clin Cancer Res. 2012;18:2290-2300. [PubMed] [DOI] |
| 19. | Hsieh MY, Lin ZY, Chuang WL. Serial serum VEGF-A, angiopoietin-2, and endostatin measurements in cirrhotic patients with hepatocellular carcinoma treated by transcatheter arterial chemoembolization. Kaohsiung J Med Sci. 2011;27:314-322. [PubMed] [DOI] |
| 20. | Miyahara K, Nouso K, Morimoto Y, Takeuchi Y, Hagihara H, Kuwaki K, Onishi H, Ikeda F, Miyake Y, Nakamura S. Pro-angiogenic cytokines for prediction of outcomes in patients with advanced hepatocellular carcinoma. Br J Cancer. 2013;109:2072-2078. [PubMed] [DOI] |
| 21. | Wang YH, Dong YY, Wang WM, Xie XY, Wang ZM, Chen RX, Chen J, Gao DM, Cui JF, Ren ZG. Vascular endothelial cells facilitated HCC invasion and metastasis through the Akt and NF-κB pathways induced by paracrine cytokines. J Exp Clin Cancer Res. 2013;32:51. [PubMed] [DOI] |
| 22. | Wu YY, Chen L, Wang GL, Zhang YX, Zhou JM, He S, Qin J, Zhu YY. Inhibition of hepatocellular carcinoma growth and angiogenesis by dual silencing of NET-1 and VEGF. J Mol Histol. 2013;44:433-445. [PubMed] [DOI] |
| 23. | Kaseb AO, Garrett-Mayer E, Morris JS, Xiao L, Lin E, Onicescu G, Hassan MM, Hassabo HM, Iwasaki M, Deaton FL. Efficacy of bevacizumab plus erlotinib for advanced hepatocellular carcinoma and predictors of outcome: final results of a phase II trial. Oncology. 2012;82:67-74. [PubMed] [DOI] |
| 24. | Wei H, Zhang J, Li H, Ren H, Hao X, Huang Y. GP73, a new marker for diagnosing HBV-ACLF in population with chronic HBV infections. Diagn Microbiol Infect Dis. 2014;79:19-24. [PubMed] [DOI] |
| 25. | Liu Y, Zou Z, Zhu B, Hu Z, Zeng P. CXCL10 decreases GP73 expression in hepatoma cells at the early stage of hepatitis C virus (HCV) infection. Int J Mol Sci. 2013;14:24230-24241. [PubMed] [DOI] |
| 26. | Xu WJ, Guo BL, Han YG, Shi L, Ma WS. Diagnostic value of alpha-fetoprotein-L3 and Golgi protein 73 in hepatocellular carcinomas with low AFP levels. Tumour Biol. 2014;35:12069-12074. [PubMed] [DOI] |
| 27. | Qiao Y, Chen J, Li X, Wei H, Xiao F, Chang L, Zhang R, Hao X, Wei H. Serum gp73 is also a biomarker for diagnosing cirrhosis in population with chronic HBV infection. Clin Biochem. 2014;47:216-222. [PubMed] [DOI] |
| 28. | Bröker ME, Ijzermans JN, Witjes CD, van Vuuren HJ, de Man RA. The predictive value of Golgi protein 73 in differentiating benign from malignant liver tumors. PLoS One. 2014;9:e100187. [PubMed] [DOI] |
| 29. | Wang NY, Wang C, Li W, Wang GJ, Cui GZ, He H, Zhao HJ. Prognostic value of serum AFP, AFP-L3, and GP73 in monitoring short-term treatment response and recurrence of hepatocellular carcinoma after radiofrequency ablation. Asian Pac J Cancer Prev. 2014;15:1539-1544. [PubMed] |
| 30. | Bao YX, Cao Q, Yang Y, Mao R, Xiao L, Zhang H, Zhao HR, Wen H. Expression and prognostic significance of golgiglycoprotein73 (GP73) with epithelial-mesenchymal transition (EMT) related molecules in hepatocellular carcinoma (HCC). Diagn Pathol. 2013;8:197. [PubMed] [DOI] |
| 31. | Hou SC, Xiao MB, Ni RZ, Ni WK, Jiang F, Li XY, Lu CH, Chen BY. Serum GP73 is complementary to AFP and GGT-II for the diagnosis of hepatocellular carcinoma. Oncol Lett. 2013;6:1152-1158. [PubMed] |
| 32. | Hu B, Tian X, Sun J, Meng X. Evaluation of individual and combined applications of serum biomarkers for diagnosis of hepatocellular carcinoma: a meta-analysis. Int J Mol Sci. 2013;14:23559-23580. [PubMed] [DOI] |