修回日期: 2014-10-04
接受日期: 2014-10-15
在线出版日期: 2014-11-28
目的: 探讨胰腺癌组织与癌旁非肿瘤组织中生存素(Survivin)、泛素特异性蛋白酶9X(ubiquitin-specific protease 9X, USP9X)的表达情况及其与生存期的关系, 研究Survivin与USP9X表达之间的关系.
方法: 应用SP法免疫组织化学染色技术检测55例手术切除的原发性胰腺癌组织与癌旁非肿瘤胰腺组织中Survivin、USP9X的表达情况, 结合临床资料进行相关预后分析, 并用相关性检验分析Survivin与USP9X表达之间的关系.
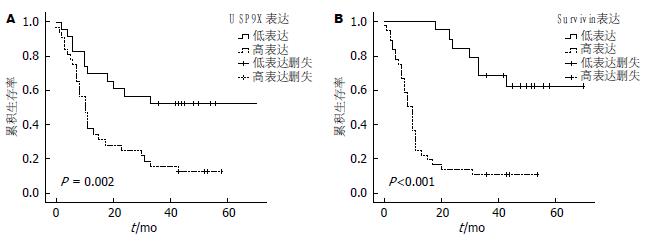
结果: 胰腺癌组织中Survivin、USP9X的高表达阳性率分别为65.5%(36/55)、58.2%(32/55), 癌旁非肿瘤组织中均为低表达. Survivin、USP9X的表达与患者的性别、年龄、肿瘤部位及肿瘤大小无关(P>0.05), 而与肿瘤分化程度、有无淋巴结转移及TNM分期显著相关(P<0.05). USP9X与Survivin在胰腺癌组织中的表达呈正相关性(r = 0.624, P<0.05). 生存分析显示, Survivin、USP9X高表达组患者的预后明显差于低表达组(P<0.05). Cox比例风险分析显示, 肿瘤分化程度、有无淋巴结转移、Survivin及USP9X表达均是影响预后的独立危险因素(P<0.05).
结论: 在胰腺癌的发生、发展中, Survivin与USP9X可能存在一定的相互协同作用, USP9X可能是抑制Survivin降解的去泛素化酶之一. Survivin、USP9X高表达的胰腺癌组织可能恶性程度更高, 预后更差.
核心提示: 本研究应用免疫组织化学染色技术检测55例手术切除的原发性胰腺癌组织与癌旁非肿瘤胰腺组织中Survivin、泛素特异性蛋白酶9X(ubiquitin-specific protease 9X, USP9X)的表达情况, 得出如下结论: 在胰腺癌的发生、发展中, Survivin与USP9X可能存在一定的相互协同作用, USP9X可能是抑制Survivin降解的去泛素化酶之一. Survivin、USP9X高表达的胰腺癌组织可能恶性程度更高, 预后更差.
引文著录: 任泽强, 张蓬波, 丁伟超, 张秀忠, 张冲. USP9X、Survivin在胰腺癌组织中的表达及临床意义. 世界华人消化杂志 2014; 22(33): 5164-5169
Revised: October 4, 2014
Accepted: October 15, 2014
Published online: November 28, 2014
AIM: To investigate the expression of Survivin and ubiquitin-specific protease 9X (USP9X) in pancreatic carcinoma, and to evaluate their correlation with the survival of patients.
METHODS: The expression of Survivin and USP9X was detected by streptavidin-peroxidase immunohistochemical method in 55 primary pancreatic carcinoma tissue specimens and adjacent non-tumorous pancreatic tissue specimens.
RESULTS: The rates of Survivin and USP9X high expression in 55 primary pancreatic carcinoma tissue specimens were 65.5% and 58.2%, and all adjacent non-tumorous pancreatic tissue specimens showed low Survivin and USP9X expression. The expression of Survivin and USP9X was not correlated with gender, age, tumor location or tumor size (P > 0.05), but was significantly correlated with tumor differentiation degree, lymph node metastasis and TNM stage (P < 0.05). Survivin expression was positively related to USP9X expression (r = 0.624, P < 0.05). Survival of the patients with high Survivin or USP9X expression was significantly poorer than those with low expression (P < 0.05). Multivariate analysis revealed that tumor differentiation degree, lymph node metastasis, Survivin expression and USP9X expression were independent risk factors for prognosis of pancreatic carcinoma (P < 0.05).
CONCLUSION: Pancreatic carcinoma with high Survivin or USP9X expression has a higher degree of malignancy and worse prognosis. Survivin and USP9X may interact with each other in the pathogenesis of pancreatic cancer. USP9X may be one of deubiquitinating enzymes that restrain the degradation of Survivin protein.
- Citation: Ren ZQ, Zhang PB, Ding WC, Zhang XZ, Zhang C. Clinical significance of expression of ubiquitin-specific protease 9X and Survivin in pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(33): 5164-5169
- URL: https://www.wjgnet.com/1009-3079/full/v22/i33/5164.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i33.5164
鉴于胰腺癌的致死率高, 且缺乏有效治疗手段[1], 分析研究胰腺癌的发病机制及内在分子生物学特性, 探索有效的早期诊断指标及预后评测指标, 从而为患者提供有效的诊断治疗手段以提高其生存率, 具有重要临床意义. Survivin是一类在胰腺癌的发生、发展中发挥重要作用的癌基因[2,3]. 作为去泛素化酶家族的亚家族泛素特异性蛋白酶(ubiquitin-specific proteases, USP)的成员之一, USP9X亦与一些肿瘤的生物学行为密切相关. 研究[4]证实与细胞内的其他蛋白一样, Survivin蛋白也是通过泛素-蛋白酶体途径降解的. 理论上, 去泛素化酶会抑制其降解[4]. 本研究应用免疫组织化学SP法, 对胰腺癌组织进行检测USP9X、Survivin, 旨在探讨胰腺癌组织中USP9X与Survivin的关系, 以及USP9X、Survivin的表达与胰腺癌的发生、发展及预后的关系.
收集徐州医学院附属医院2006-09/2010-12行根治性手术切除的胰腺癌标本55例, 所有患者均获随访, 随访日期截止至2013-12, 随访方式为电话、书信随访和/或门诊复查. 其中, 男32例, 女23例, 年龄43-85岁, 平均年龄61.76岁±9.97岁. 所有患者均经病理诊断为原发性胰腺导管腺癌, 且术前均未行放疗、化疗及免疫治疗等. 根据分化程度, 高、中、低分化腺癌分别为7例、34例及14例; 根据TNM分期[5], Ⅰ期、Ⅱ期、Ⅲ期及Ⅳ期分别为25例、28例、0例及2例. 选取距离肿瘤边缘2 cm以上的组织作为癌旁非肿瘤标本.
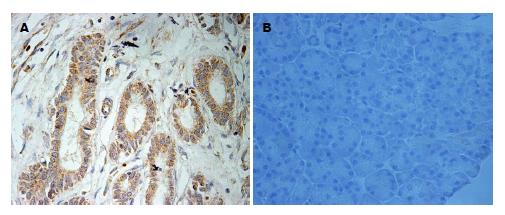
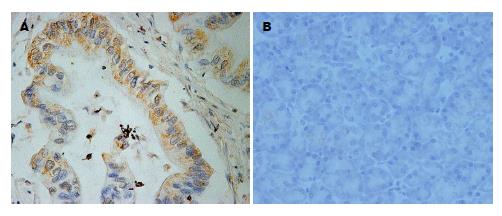
1.2.1 免疫组织化学检测: 采用SP法, 具体步骤按照说明书. Survivin及USP9X抗体工作浓度均为1:100. 兔抗人Survivin单克隆抗体、兔抗人USP9X单克隆抗体、免疫组织化学染色试剂盒、浓缩型DAB显色剂、PBS磷酸盐缓冲液、柠檬酸盐缓冲液均购于北京中杉金桥生物技术有限公司. 采用双盲法由2名病理科医生观察免疫组织化学染色的组织切片, 对切片上的同一患者的每对组织点随机选取5个高倍镜视野(×400)进行细胞计数, 当差异>5%时再次计数至一致, 结果以5个视野阳性细胞总数表示.
1.2.2 免疫组织化学结果判定: USP9X免疫组织化学结果判断[6]: 细胞质和/或细胞膜染成黄色或棕褐色为阳性. 免疫组织化学结果评分: 不着色计0分, 浅黄色计1分, 棕黄色计2分, 棕褐色计3分; 着色细胞占计数细胞的百分率为0计0分, ≤10%计1分, 10%-50%计2分, 51%-80%计3分, ≥80%计4分; 染色程度得分×染色细胞百分率得分 = 最后得分; ≤4分为低表达, >4分为高表达. Survivin免疫组织化学结果判断[7]: 细胞质和/或细胞膜染成棕黄色或棕褐色为阳性. 阳性细胞率≤10%为低表达, >10%为高表达.
统计学处理 应用SPSS16.0进行统计分析, 定性资料采用χ2检验, 定量资料统计描述以mean±SD表示. 相关性检验采用Spearman相关分析. 累计生存时间及累计生存率计算采用Kaplan-Meier法, 生存检验采用Log-rank检验, 单因素与多因素生存分析采用Cox比例风险模型(单因素分析中P<0.05的变量纳入多因素分析). P<0.05为差异有统计学意义.
全部胰腺癌组织中有32例USP9X高表达(图1)、36例Survivin高表达(图2), 阳性率分别为58.2%、65.5%, 癌旁非肿瘤组织均为低表达. 患者在的性别、年龄、肿瘤部位及肿瘤大小之间, USP9X、Survivin表达差异均无统计学意义(P>0.05), 但在肿瘤分化程度、有无淋巴结转移及TNM分期方面, 差异均有统计学意义(P<0.05)(表1).
| 临床病理指标 | n | USP9X高表达 | USP9X低表达 | χ2值 | P值 | Survivin高表达 | Survivin低表达 | χ2值 | P值 |
| n | 32 | 23 | 36 | 19 | |||||
| 性别(n) | 0.586 | 0.444 | 1.395 | 0.238 | |||||
| 男 | 32 | 20 | 12 | 23 | 9 | ||||
| 女 | 23 | 12 | 11 | 13 | 10 | ||||
| 年龄(岁) | 0.062 | 0.803 | 0.603 | 0.437 | |||||
| <60 | 25 | 15 | 10 | 15 | 10 | ||||
| ≥60 | 30 | 17 | 13 | 21 | 9 | ||||
| 肿瘤部位(n) | 2.168 | 0.141 | 0.223 | 0.637 | |||||
| 胰头部 | 37 | 19 | 18 | 25 | 12 | ||||
| 胰体尾部 | 18 | 13 | 5 | 11 | 7 | ||||
| 肿瘤大小(cm) | 1.260 | 0.262 | 0.028 | 0.868 | |||||
| <4.0 | 24 | 16 | 8 | 16 | 8 | ||||
| ≥4.0 | 31 | 16 | 15 | 20 | 11 | ||||
| 分化程度(n) | 7.891 | 0.019 | 6.897 | 0.032 | |||||
| 高分化 | 7 | 2 | 5 | 2 | 5 | ||||
| 中分化 | 34 | 18 | 16 | 22 | 12 | ||||
| 低分化 | 14 | 12 | 2 | 12 | 2 | ||||
| 淋巴结转移(n) | 9.290 | 0.002 | 8.374 | 0.004 | |||||
| 有 | 20 | 17 | 3 | 18 | 2 | ||||
| 无 | 35 | 15 | 20 | 18 | 17 | ||||
| TNM分期(n) | 10.227 | 0.006 | 7.238 | 0.027 | |||||
| Ⅰ期 | 25 | 9 | 16 | 12 | 13 | ||||
| Ⅱ期 | 28 | 22 | 6 | 23 | 5 | ||||
| Ⅳ期 | 2 | 1 | 1 | 1 | 1 |
USP9X与Survivin均为高表达的例数为29例, 占52.7%. Spearman等级相关分析显示, USP9X与Survivin在胰腺癌组织中的表达呈正相关性(r = 0.624, P = 0.000<0.05).
Kaplan-Meier法生存分析显示(图3), USP9X高表达组患者预后明显差于低表达组(P<0.05), Survivin高表达组患者预后亦明显差于低表达组(P<0.05). Cox比例风险分析, 发现肿瘤分化程度、有无淋巴结转移、USP9X表达及Survivin表达是影响预后的独立危险因素(P<0.05)(表2).
| 临床资料 | 单因素分析 | 多因素分析 | ||||
| 95%CI | 风险比 | P值 | 95%CI | 风险比 | P值 | |
| 性别(男vs女) | 0.278-1.185 | 0.574 | 0.134 | - | - | - |
| 年龄(<60岁vs≥60岁) | 0.620-2.689 | 1.291 | 0.495 | - | - | - |
| 肿瘤部位(胰头vs胰体尾) | 0.318-1.441 | 0.677 | 0.311 | - | - | - |
| 肿瘤大小(<4.0 cm vs≥4.0 cm) | 0.291-1.310 | 0.618 | 0.209 | - | - | - |
| TNM分期(Ⅰ期、Ⅱ期、Ⅳ期) | 0.768-2.967 | 1.509 | 0.233 | - | - | - |
| 分化程度(高、中、低分化) | 1.174-4.434 | 2.282 | 0.015 | 1.207-4.589 | 2.354 | 0.012 |
| 淋巴结转移(有vs无) | 1.289-7.934 | 3.198 | 0.012 | 1.405-7.233 | 3.187 | 0.006 |
| USP9X表达(高表达vs低表达) | 1.020-7.250 | 2.720 | 0.046 | 1.035-6.049 | 2.502 | 0.042 |
| Survivin表达(高表达vs低表达) | 1.210-9.910 | 3.463 | 0.021 | 1.267-9.077 | 3.391 | 0.015 |
本研究中Survivin蛋白的表达情况与既往文献报道[8]一致; 而USP9X在胰腺癌的表达情况既往报道罕见. 胰腺癌组织中Survivin、USP9X的高表达, 癌旁非肿瘤组织中的不表达或低表达, 提示Survivin、USP9X在胰腺癌的发生中发挥了重要作用. 胰腺癌组织中Survivin、USP9X表达与肿瘤TNM分期、分化程度及有无淋巴结转移有关, 提示Survivin、USP9X在胰腺癌的发展过程中也发挥重要作用, Survivin、USP9X高表达的胰腺癌组织可能恶性程度更高, 具有更强的侵袭性. 生存分析及Cox比例风险分析结果提示, USP9X、Survivin与胰腺癌的发生、发展及预后密切相关, 可作为判断胰腺癌及其预后的指标之一.
Survivin主要通过直接抑制凋亡终末效应酶Caspase3与Caspase7的活性[9], 或与CDK-2、CDK-4相互作用[10]等途径抑制细胞凋亡. 研究证实, Survivin与抗凋亡蛋白Mcl-1在肿瘤的形成过程中起协同作用, 其共同作用包括抑制Caspase-依赖的细胞凋亡[11], 并与CKD2相互作用[12]等. Schwickart等[13]研究证实, USP9X通过稳定Mcl-1, 从而促进肿瘤细胞的生长. Trivigno等[14]则证明, USP9X稳定Mcl-1, 可能和肿瘤的放疗耐受机制有关. Peddaboina等[15]则研究证实, USP9X的抑制剂WP1130能够下调Mcl-1, 并增加肿瘤细胞的化疗敏感性.
本研究显示, 胰腺癌组织中Survivin与USP9X的表达呈正相关(r = 0.624, P<0.05), 这提示在胰腺癌的发生、发展中二者可能存在一定的相互协同作用, 且研究表明[4]Survivin蛋白通过泛素-蛋白酶体途径降解, 去泛素化酶可以抑制其降解, 我们认为USP9X可能是抑制Survivin降解的去泛素化酶之一, 其具体作用尚需进一步研究. 另外, 如前所述, Mcl-1与Survivin在肿瘤的形成过程中起协同作用, USP9X亦如此. 由此可见, USP9X、Survivin及Mcl-1在肿瘤的发生发展中有密不可分的联系.
胰腺癌是一种恶性程度极高的消化系肿瘤, 具有早期难以发现、病情发展迅速、预后极差等特点, 且近年来其发病率已明显上升. 研究表明, 胰腺癌的发生、发展是一个多阶段的复杂过程, 与许多肿瘤相关基因表达失常和/或多种肿瘤抑制基因失活等密切相关.
夏时海, 副教授, 副主任医师, 武警后勤学院附属医院肝胆胰脾科(中心)
鉴于胰腺癌的致死率高, 且缺乏有效治疗手段, 分析研究胰腺癌的发病机制及内在分子生物学特性, 探索有效的早期诊断指标及预后评测指标, 从而为患者提供有效的诊断治疗手段以提高其生存率, 具有重要临床意义.
文献报道, Survivin蛋白几乎在所有人类肿瘤中高表达, 而在正常终末分化的成年细胞、组织中不表达或低表达. 既往研究发现, Survivin的高表达与恶性肿瘤的不良预后密切相关, 其中包括膀胱癌、非小细胞肺癌、乳腺癌等.
Survivin的表达情况与既往文献报道一致, 而USP9X在胰腺癌的表达情况既往报道罕见. 虽然有文献报道, 胰腺癌Survivin低表达组的生存期明显长于高表达组, 但详细报道较少见. 另外, 关于USP9X与胰腺癌的关系, 既往报道少见.
本研究应用免疫组织化学SP法, 对胰腺癌组织进行检测USP9X、Survivin, 旨在探讨胰腺癌组织中USP9X与Survivin的关系, 以及USP-9X、Survivin的表达与胰腺癌的发生、发展及预后的关系.
USP9X: 泛素特异性蛋白酶(USP)是去泛素化酶家族中种类最多并且结构最具多样化的一个亚家族, 包含50多个成员. 根据在酵母中克隆先后的顺序, USP可分为USP1、USP2、USP3......USP54和CYLD等. 作为USP的成员之一, 泛素特异性蛋白酶9X(USP9X)与一些肿瘤的生物学行为密切相关.
本文设计合理, 结果可靠, 结论有一定的参考价值.
编辑:郭鹏 电编:都珍珍
| 3. | Lopes RB, Gangeswaran R, McNeish IA, Wang Y, Lemoine NR. Expression of the IAP protein family is dysregulated in pancreatic cancer cells and is important for resistance to chemotherapy. Int J Cancer. 2007;120:2344-2352. [PubMed] |
| 6. | Peng J, Hu Q, Liu W, He X, Cui L, Chen X, Yang M, Liu H, Wei W, Liu S. USP9X expression correlates with tumor progression and poor prognosis in esophageal squamous cell carcinoma. Diagn Pathol. 2013;8:177. [PubMed] [DOI] |
| 7. | Xie H, Jiang W, Xiao SY, Liu X. High expression of survivin is prognostic of shorter survival but not predictive of adjuvant gemcitabine benefit in patients with resected pancreatic adenocarcinoma. J Histochem Cytochem. 2013;61:148-155. [PubMed] [DOI] |
| 8. | Liu BB, Wang WH. Survivin and pancreatic cancer. World J Clin Oncol. 2011;2:164-168. [PubMed] [DOI] |
| 9. | Xu JH, Wang AX, Huang HZ, Wang JG, Pan CB, Zhang B. Survivin shRNA induces caspase-3-dependent apoptosis and enhances cisplatin sensitivity in squamous cell carcinoma of the tongue. Oncol Res. 2010;18:377-385. [PubMed] |
| 11. | Jane EP, Premkumar DR, DiDomenico JD, Hu B, Cheng SY, Pollack IF. YM-155 potentiates the effect of ABT-737 in malignant human glioma cells via survivin and Mcl-1 downregulation in an EGFR-dependent context. Mol Cancer Ther. 2013;12:326-338. [PubMed] [DOI] |
| 12. | Faber AC, Chiles TC. Inhibition of cyclin-dependent kinase-2 induces apoptosis in human diffuse large B-cell lymphomas. Cell Cycle. 2007;6:2982-2989. [PubMed] |
| 13. | Schwickart M, Huang X, Lill JR, Liu J, Ferrando R, French DM, Maecker H, O'Rourke K, Bazan F, Eastham-Anderson J. Deubiquitinase USP9X stabilizes MCL1 and promotes tumour cell survival. Nature. 2010;463:103-107. [PubMed] [DOI] |
| 14. | Trivigno D, Essmann F, Huber SM, Rudner J. Deubiquitinase USP9x confers radioresistance through stabilization of Mcl-1. Neoplasia. 2012;14:893-904. [PubMed] |
| 15. | Peddaboina C, Jupiter D, Fletcher S, Yap JL, Rai A, Tobin RP, Jiang W, Rascoe P, Rogers MK, Smythe WR. The downregulation of Mcl-1 via USP9X inhibition sensitizes solid tumors to Bcl-xl inhibition. BMC Cancer. 2012;12:541. [PubMed] [DOI] |