修回日期: 2013-09-22
接受日期: 2013-10-20
在线出版日期: 2013-12-28
再神经内分泌肿瘤具有惰性生长特点, 但易早期发生肝转移. 手术仍是目前唯一可能根治神经内分泌肿瘤的治疗手段, 主张一次或多次尽可能切净原发灶与转移灶. 肝移植技术由于资源稀少, 筛选患者指征严格, 复发率高, 无法广泛开展. 针对肝脏的非手术治疗主要包括肝动脉介入栓塞/化疗、射频消融等, 目前应用广泛、安全性好. 药物治疗, 主要包括生长抑素类似物、靶向药物和化疗药物, 能有效延长部分患者的无病生存期与总生存期. 手术联合肝脏非手术治疗与药物治疗, 是神经内分泌肿瘤肝转移的治疗策略. 但是如何挑选最合适的时机确定最适宜的干预方式, 如何确定不同治疗的最适宜人群, 尚需要更多循证医学证据.
核心提示: 手术仍是目前唯一可能根治神经内分泌肿瘤的治疗手段, 主张一次或多次尽可能切净原发灶与转移灶. 非手术治疗主要包括肝动脉介入栓塞/化疗、射频消融等. 如何挑选最合适的时机确定最适宜的干预方式, 如何确定不同治疗的最适宜人群, 尚需要更多循证医学证据.
引文著录: 杜顺达, 王孜, 毛一雷. 神经内分泌肿瘤肝转移治疗的进展. 世界华人消化杂志 2013; 21(36): 4069-4074
Revised: September 22, 2013
Accepted: October 20, 2013
Published online: December 28, 2013
Although neuroendocrine neoplasms are characterized by slow progression and indolent biology, most patients develop early hepatic metastasis. Surgical resection is currently the only way to cure. One- or two-step procedures may be undertaken to remove the primary tumor and hepatic metastasis as thoroughly as possible. Liver transplantation is difficult to be widely applied due to resource scarcity. Other drawbacks include strict criteria for patient selection and high recurrence rate. Liver-directed therapies, mainly referring to TAE/TACE and RFA, are widely used in NET G1/G2 patients. Pharmacological therapies include somatostatin analogues, targeted therapy and systemic chemotherapy. Some clinical trials have demonstrated longer OS and PFS in experimental groups compared with placebo groups. Currently, a combined-modality approach including surgery, liver-targeted therapy and medication is the trend in treatment of NEN hepatic metastases. How to determine the most suitable strategy in specific clinical circumstances? Which subpopulation of patients will benefit most from a specific therapy? We expect more clinical evidence of high quality to answer these questions.
- Citation: Du SD, Wang Z, Mao YL. Therapeutic advances in neuroendocrine neoplasms with hepatic metastases. Shijie Huaren Xiaohua Zazhi 2013; 21(36): 4069-4074
- URL: https://www.wjgnet.com/1009-3079/full/v21/i36/4069.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i36.4069
神经内分泌肿瘤(neuroendocrine neoplasm, NEN)是一组起源于肽能神经元和内分泌细胞的异质性肿瘤. 内分泌细胞不仅在人体主要腺体(如甲状腺、甲状旁腺)聚集, 而且在胃肠道、呼吸道甚至卵巢、宫颈等腺体外部位也有分布. 来源于神经元细胞的NEN则主要包括嗜铬细胞瘤与副神经节瘤. 1963年Williams等[1]首次将NEN按其胚胎发育, 分为前肠型(肺、胸腺、食管、胃、十二指肠第一部分和胰腺)、中肠型(十二指肠第二部分、空肠、回肠、阑尾和升结肠)以及后肠型(横结肠、降结肠和直肠), 其中来源于前肠的胃肠胰神经内分泌肿瘤最为常见, 约占神经内分泌肿瘤的55%-70%. 北京协和医院近20年的数据显示, 住院NEN患者原发灶部位居前3位的分别是胰腺、胃和小肠[2].
神经内分泌肿瘤具有惰性生长、但易早期转移的特点. 肝脏是最常见的转移部位, 发生率高达44%-73%[3]. 大多数NEN肝转移患者原发灶相关临床症状并不特异, 患者常因体检发现肝占位或肝脏功能受损相关症状如黄疸、腹水等就诊.
长期以来, NEN在分类和分级方面缺乏能被医学界广泛接受的标准[2]. 2006年, 欧洲神经内分泌肿瘤协会(European Neuroendocrine Tumor Society, ENETS)修订了NEN的病理分级标准[4], 按细胞分裂指数及Ki-67阳性指数对肿瘤恶性程度进行分级(表1). 2008年Pape等[5]将基于ENETS分级系统分组进行回顾性病例研究提示: G1、G2和G3患者的5年生存率分别为95.7%、73.4%和27.7%. 该系统被WHO采纳为2010年最新分级标准.
| 分级 | 核分裂象数(10 HPF) | Ki-67阳性指数(%) |
| G1, 低级别 | 1 | <2 |
| G2, 中级别 | 2-20 | 3-20 |
| G3, 高级别 | >20 | >20 |
ENETS在2012年最新专家共识中对肝转移灶也做了分类[6]: (1)简单侵犯: 肝转移灶局限于一侧肝叶或相邻肝段, 可经标准术式切除. 见于20%-25%的病例; (2)复杂侵犯: 主要侵犯一处肝叶, 周围有多个卫星灶伴行. 见于10%-15%病例; (3)弥漫侵犯: 弥漫、多灶转移, 见于60%-70%病例.
神经内分泌肿瘤肝转移的治疗, 从传统的手术切除、到局部介入栓塞再到新兴的靶向治疗, 取得较大的进展. 本文将重点介绍近年来的研究进展.
胃肠胰神经内分泌肿瘤的预后相对较好, 在诊断和治疗上应采取比较积极的态度, 从而取得更长的生存期. 诊断分为定性诊断与定位诊断. 定性诊断可检测有功能神经内分泌肿瘤的血清相应激素水平, 包括胰岛素、胰高血糖素和胃泌素等. 血清嗜铬粒蛋白A(chromogranin A, CgA)则适用于所有神经内分泌肿瘤, 可用于疾病筛查和治疗后肿瘤监测, 目前已有多种成熟的商用检测试剂盒[7]. 定位诊断包括传统影像学技术, 如CT、超声与核磁. 更特异于神经内分泌肿瘤的检查技术为生长抑素受体显像, 其敏感度根据肿瘤类型有所不同, 对于胃肠胰神经内分泌肿瘤超过75%, 其中胰岛素瘤仅为中度敏感(40%-75%)[8].
手术切除是目前唯一可能根治神经内分泌肿瘤及其转移灶的方式, 能有效缓解症状, 部分患者能有效延长生存期. 手术包括对原发灶和肝转移灶的切除. Kleine等[9]进行的回顾性队列研究提示, 切除肝转移灶的胰腺NEN病例组与未切除组相比, 死亡率显著降低(HR = 9.24, P = 0.049), 且前者的疾病相关生存率与无肝转移病例组相似. Sarmiento等[10]对170例接受肝转移灶切除手术的患者研究显示: 5年生存率为61%, 10年生存率为35%; 在108例临床症状明显的患者中, 104例症状得到控制. 术后并发症发生率为14%. 目前广为接受的手术策略是: 应尽可能同时切除转移灶和原发灶; 如单次手术无法切除全部病灶, 可采用手术切除联合射频消融术; 如肿瘤巨大或患者身体状况受限制, 原发灶与转移灶可分期切除; 对于无法根治性切除的患者, 应建议行减瘤手术, 如能切除肿瘤负荷的90%以上, 无功能NEN患者生存时间将可能显著延长[9]. 北京协和医院对1例无功能性胰腺神经内分泌肿瘤(G2)肝多发转移患者, 行原发灶联合部分转移灶切除、剩余转移灶分期切除, 获得了较好的效果. 此外, 减瘤手术还能控制功能性NEN患者的临床症状, 改善生活质量. 一般认为, 手术切除适用于病理分级低(NET G1/G2)、转移灶单一或能一次切除的患者[6], 高级别原发灶患者(NET G3)接受根治性手术或是减瘤手术, 远期生存是否依然获益, 还有待更多病例的研究数据.
关于原发灶和转移灶切除先后的问题, 应视具体情况; 有时可先切除转移灶, 再切除原发灶. De Jong等[11]的研究结果发现, 如先行胰十二指肠切除, 再二期切除肝脏, 肝脓肿的发病率明显升高, 因此建议先行肝转移灶切除术, 再二期行胰十二指肠切除术.
除此之外, NEN肝转移灶手术切除遇到的最大问题是高复发率. Mayo等[12]发现, 尽管手术切除能够有效延长生存时间, 但高达94%的患者会在5年内复发. 高复发率可能与NEN本身独特的生物学特性相关, 这为改良手术方式、手术联合其他治疗以期降低复发率提供了理论基础.
原发灶局限伴广泛肝转移的患者, 综合分析其全身情况、转移灶分布等情况, 可以考虑行原发灶切除+同种异体肝移植. 肝移植目前只在较少的医学中心开展, 规模最大的研究由Lehnert[13]完成, 包括103例病例, 其2年生存率是60%, 5年生存率是47%, 但是无瘤5年生存率不超过24%. 肝移植创伤大、后续治疗复杂、治疗费用昂贵、且复发率高, 并不建议用于NET肝转移患者的常规治疗. 中华医学会外科学分会胰腺外科学组[14]提出PNET肝转移行肝移植的指征包括: (1)神经内分泌肿瘤肝脏转移, 无肝外转移和区域淋巴结转移; (2)胰腺和原发病灶可完整切除, 肝脏双侧叶不可切除的多发转移灶; (3)肿瘤Ki-67指数<10%; (4)存在无法用药物控制的、明显影响患者生命质量的症状, 无其他肝移植禁忌证. 但如此高度选择的适应证人群移植后也不一定能获得长期生存.
针对肝脏的非手术治疗包括肝动脉介入栓塞(transcatheter arterial embolization, TAE)、肝动脉介入化疗栓塞(transcatheter arterial chemoembolization, TACE)、射频消融(radiofrequency ablation, RFA)等, 能有效减少肝脏转移灶的肿瘤负荷.
较大的肝转移灶主要由肝动脉供血, 这是TAE/TACE治疗NET肝转移的理论基础. 如肝转移灶数目较少、体积较大, 可使用微导管进行超选择栓塞; 如肝转移灶数目众多或无明显增粗的供血动脉, 则将导管插到肝固有动脉水平进行栓塞. 肝内广泛转移的患者原则上不是TAE/TACE的适应证, 如需进行, 应分次栓塞, 以免发生急性肝功能衰竭和严重并发症. 栓塞剂通常采用超液态碘油10-20 mL与表阿霉素或链脲霉素20-40 mg的混合乳剂, 栓塞程度控制在动脉血流速度明显减慢、肿瘤染色基本消失[15]. TAE/TACE常应用于治疗NET G1/G2肝转移的患者, 操作可多次重复, 但短期内可能行肝移植的患者应避免行TAE/TACE, 以免损伤动脉正常结构. 绝对禁忌证包括完全性门脉栓塞、肝功能失代偿. TAE/TACE主要不良反应包括胆囊坏死、肝肾综合征、胰腺炎、肝脓肿和动脉瘤形成, 这和操作者的经验和术中判断有较大的关系. 行Whipple术式切除原发灶的患者也应避免TAE/TACE, 因为可能增加胰腺炎、肝脓肿等并发症几率[16]. 关于TAE与TACE孰优孰劣, 以及何种化疗药物能更有效的抑制肿瘤生长, 由于缺乏大规模临床试验证据, 尚无定论.
RFA在肝脏肿瘤治疗领域应用广泛, 包括冷冻消融、无水乙醇注射和RFA. 其中以RFA最具备发展前景, 且临床应用经验最为丰富. RFA技术可单独应用, 也可与手术治疗联合, 作为手术切除的补充治疗手段. 根据病变部位和转移的广泛程度, 可选择经皮和腹腔镜下两种电极入路方式. 目前, RFA在许多中心已经成为局部治疗的首选, 部分研究显示其在缓解症状和控制转移两方面都能获得较好的效果. 一项入组63例病例的前瞻性研究[17]显示: RFA组患者70%达到完全或部分症状缓解, 维持时间为11 mo±2.3 mo. 但RFA完全消灭转移灶的可能性随转移灶体积增大而减低. RFA不适用于直径>5 cm的病灶, 且对于肿瘤数目也有限制[18]. 在安全性方面, RFA围手术期并发症发生率与操作者的经验密切相关, 平均约5%, 术后30 d内无死亡事件报道.
当神经内分泌肿瘤为低分化(NET G3), 或肝内弥漫转移时, 药物治疗成为选择. 药物治疗并不是特异针对肝脏, 可以作用于所有转移灶. 选择方案要结合分级分期信息和肿瘤原发灶的位置(前肠、中肠、后肠).
长效的生长抑素类似物奥曲肽和兰乐肽最初应用于减轻类癌症状, 如潮热或水样泻. 但是, 最近越来越多的证据证明他们也有抗肿瘤生长、稳定肿瘤的作用[19]. 生长抑素受体有5种亚型, 奥曲肽和兰乐肽与SST2和SST5亲和力最高, SST3稍低, 表2总结了不同胃肠胰神经内分泌肿瘤细胞表面的生长抑素受体分布情况[20,21].
| SSTR1 | SSTR2 | SSTR3 | SSTR4 | SSTR5 | |
| 胰岛素瘤 | 33 | 100 | 33 | 100 | 67 |
| 胃泌素瘤 | 33 | 50 | 17 | 83 | 50 |
| 胰高血糖素瘤 | 67 | 100 | 67 | 67 | 67 |
| VIP瘤 | 100 | 100 | 100 | 100 | 100 |
| 无功能NET | 80 | 100 | 40 | 100 | 60 |
德国研究小组于2009年报告了PROMID多中心的前瞻性研究结果, 发现接受奥曲肽长效制剂和安慰剂治疗中肠神经内分泌肿瘤患者的中位无进展生存时间分别为14.3和6.0 mo, 显示了统计学差异, 但两组总体生存期无显著性差异[22]. 生长抑素类似物的弊端是易产生耐药性, 且有部分患者对治疗无应答. 作用受体谱更广泛的新型药物正在研究中, 如SOM230或帕西瑞泰, 其对SST1、SST2、SST3和SST5有更高的亲和力, 其中对SS1和SS5的亲和力是奥曲肽和兰乐肽的30-40倍[23].
靶向治疗是近年来NEN药物治疗的亮点之一, 主要药物有: 血管内皮生长因子(vascular epithelial grow factor, VEGF)抑制剂(包括多靶点酪氨酸激酶抑制剂)、哺乳动物雷帕霉素受体(mammalian target of rapamycin, mTOR)抑制剂.
肿瘤组织免疫组织化学方法已经证实, NEN肿瘤血供丰富, 细胞表面同样表达VEGF及其受体. 2007年Zhang等[24]的试验证实, NEN肿瘤的VEGF表达数量与肿瘤大小还有转移倾向呈明显正相关, VEGF的过度表达通过刺激新生血管形成而促进肿瘤发展. VEGF抑制剂的代表药物为VEGF单克隆抗体贝伐单抗和酪氨酸激酶抑制剂舒尼替尼. 二者抗NEN肿瘤增殖和改善预后已经由临床试验证实. Kulke等[25]用2-甲氧雌二醇联合贝伐珠单抗治疗31例NET患者, 68%患者的影像学检查提示肿瘤缩小, 中位无进展生存期为11.3 mo. 2011年新英格兰医学杂志发表了关于舒尼替尼的Ⅲ期临床试验结果: 对于进展期胰腺NEN患者, 试验组每日口服舒尼替尼37.5 mg, 中位无进展生存期为11.4 mo, 而安慰组为5.5 mo(HR = 0.42, P<0.001). 与安慰组相比, 服用舒尼替尼组的无进展生存期、总生存期均获得显著提高. VEGF抑制剂主要的不良反应包括腹泻、恶心、呕吐和乏力[26]. 由于目前的试验证据主要只针对胰腺NEN, NCCN仅正式推荐舒尼替尼用于胰腺NEN的治疗.
mTOR抑制剂是一个保守的丝氨酸/苏氨酸激酶, 与调控细胞凋亡相关, 代表药物是依维莫司. 磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶/mTOR通路能够影响胰岛素样生长因子受体、血管内皮生长因子受体和表皮生长因子受体等下游靶点, 调节细胞生长和代谢. 已有的文献显示, 胃肠胰神经内分泌肿瘤细胞的mTOR信号通路处于失控状态, 使细胞生长代谢无序, 这是mTOR抑制剂治疗的基础. mTOR抑制剂能抑制该通路活性, 从而阻滞肿瘤生长[27]. Ⅲ期临床研究RADIANT-3显示, 依维莫司能延长进展期胰腺NET患者的无病生存期[28].
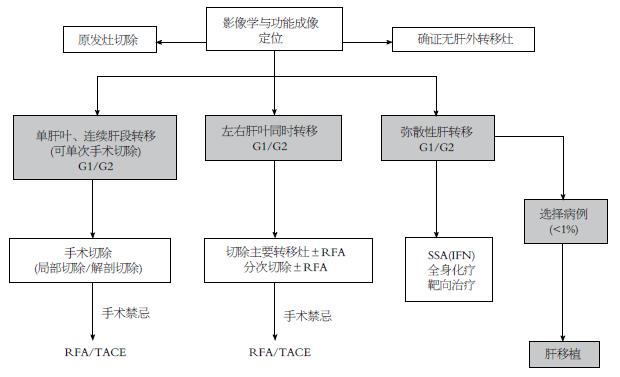
欧洲神经内分泌肿瘤协会2012年对于原发灶病例分级为NET G1/G2、无肝外转移的患者颁布了治疗方案的专家共识[6](图1). 与实体瘤不同, 对于有肝转移的NEN患者, 我们首先依然要尽可能切除原发灶, 再根据肝转移情况, 分别进行个体化的干预治疗: 弥漫性肝转移患者主要选择药物治疗, 对于可切除的肝转移灶, 可同期或分期切除, 手术切除联合RFA、TACE联合手术切除等.
神经内分泌肿瘤虽然容易早期肝转移, 但其具有惰性生长特点, 合理利用病史、症状、血清学检查、肿瘤标志物等提高早期诊断, 将能有效提高手术切除率, 达到治愈的目的. 在明确诊断后, 治疗主要分两个方向, 一是控制症状, 提高生活质量; 二是延长生存期. 合理的治疗能够有效改善症状, 延长患者生存期. 在各种治疗手段中, 手术是目前唯一可能根治的治疗手段, 但并不能涵盖所有病例, 且术后存在高复发. 针对肝脏的非手术治疗和针对全身的药物治疗, 能有效的弥补单一手术的不足, 近年来发展迅速. 手术联合非手术、药物治疗, 是神经内分泌肿瘤肝转移的治疗策略, 但如何在最合适的时机选择手术、选择何种手术、是否分期手术、是否联合非手术、术后选择何种药物治疗等, 尚需更多的循证医学研究.
神经内分泌肿瘤(neuroendocrine neoplasm, NEN)近年发病率逐渐增高, 早期诊断困难, 目前尚缺乏统一的诊疗标准. 治疗方面, 手术仍是唯一可治愈的方法, 介入治疗、生长抑素类似物等新方法不断涌现.
吕凌, 副教授, 江苏省人民医院肝脏外科
不同治疗手段对预后的影响, 目前缺乏前瞻性临床研究证据.
NEN近年发病率逐渐增高, 早期诊断困难, 目前尚缺乏统一的诊疗标准, 故该综述内容较为重要. 其引用的文献证据较为充分和新颖, 反应了NEN的诊疗新进展.
编辑:田滢 电编:闫晋利
| 1. | Williams ED, Sandler M. The classification of carcinoid tum ours. Lancet. 1963;1:238-239. [PubMed] |
| 3. | Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer. 2003;97:934-959. [PubMed] [DOI] |
| 4. | Rindi G, Klöppel G, Alhman H, Caplin M, Couvelard A, de Herder WW, Erikssson B, Falchetti A, Falconi M, Komminoth P. TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch. 2006;449:395-401. [PubMed] [DOI] |
| 5. | Pape UF, Jann H, Müller-Nordhorn J, Bockelbrink A, Berndt U, Willich SN, Koch M, Röcken C, Rindi G, Wiedenmann B. Prognostic relevance of a novel TNM classification system for upper gastroenteropancreatic neuroendocrine tumors. Cancer. 2008;113:256-265. [PubMed] [DOI] |
| 6. | Pavel M, Baudin E, Couvelard A, Krenning E, Öberg K, Steinmüller T, Anlauf M, Wiedenmann B, Salazar R. ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary. Neuroendocrinology. 2012;95:157-176. [PubMed] [DOI] |
| 7. | Rindi G, Wiedenmann B. Neuroendocrine neoplasms of the gut and pancreas: new insights. Nat Rev Endocrinol. 2012;8:54-64. [PubMed] [DOI] |
| 8. | 李 景南. 胃肠胰神经内分泌肿瘤的诊断. 中华医学会第九次全国消化系统疾病学术会议论文集. 2009;. |
| 9. | Kleine M, Schrem H, Vondran FW, Krech T, Klempnauer J, Bektas H. Extended surgery for advanced pancreatic endocrine tumours. Br J Surg. 2012;99:88-94. [PubMed] [DOI] |
| 10. | Sarmiento JM, Heywood G, Rubin J, Ilstrup DM, Nagorney DM, Que FG. Surgical treatment of neuroendocrine metastases to the liver: a plea for resection to increase survival. J Am Coll Surg. 2003;197:29-37. [PubMed] |
| 11. | De Jong MC, Farnell MB, Sclabas G, Cunningham SC, Cameron JL, Geschwind JF, Wolfgang CL, Herman JM, Edil BH, Choti MA. Liver-directed therapy for hepatic metastases in patients undergoing pancreaticoduodenectomy: a dual-center analysis. Ann Surg. 2010;252:142-148. [PubMed] [DOI] |
| 12. | Mayo SC, de Jong MC, Pulitano C, Clary BM, Reddy SK, Gamblin TC, Celinksi SA, Kooby DA, Staley CA, Stokes JB. Surgical management of hepatic neuroendocrine tumor metastasis: results from an international multi-institutional analysis. Ann Surg Oncol. 2010;17:3129-3136. [PubMed] [DOI] |
| 13. | Lehnert T. Liver transplantation for metastatic neuroendocrine carcinoma: an analysis of 103 patients. Transplantation. 1998;66:1307-1312. [PubMed] |
| 15. | 李 晓光, 金 征宇, 潘 杰, 张 晓波, 石 海峰, 孙 昊, 王 志伟, 周 慷. 肝动脉化疗或栓塞治疗胰腺神经内分泌肿瘤肝转移的疗效分析. 介入放射学杂志. 2010;442-446. |
| 16. | Ahlman H, Wängberg B, Jansson S, Friman S, Olausson M, Tylén U, Nilsson O. Interventional treatment of gastrointestinal neuroendocrine tumours. Digestion. 2000;62 Suppl 1:59-68. [PubMed] |
| 17. | Mazzaglia PJ, Berber E, Milas M, Siperstein AE. Laparoscopic radiofrequency ablation of neuroendocrine liver metastases: a 10-year experience evaluating predictors of survival. Surgery. 2007;142:10-19. [PubMed] [DOI] |
| 18. | Elias D, Baton O, Sideris L, Boige V, Malka D, Liberale G, Pocard M, Lasser P. Hepatectomy plus intraoperative radiofrequency ablation and chemotherapy to treat technically unresectable multiple colorectal liver metastases. J Surg Oncol. 2005;90:36-42. [PubMed] [DOI] |
| 19. | Demirkan BH, Eriksson B. Systemic treatment of neuroendocrine tumors with hepatic metastases. Turk J Gastroenterol. 2012;23:427-437. [PubMed] |
| 20. | Appetecchia M, Baldelli R. Somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine tumours, current aspects and new perspectives. J Exp Clin Cancer Res. 2010;29:19. [PubMed] [DOI] |
| 21. | Oberg K, Kvols L, Caplin M, Delle Fave G, de Herder W, Rindi G, Ruszniewski P, Woltering EA, Wiedenmann B. Consensus report on the use of somatostatin analogs for the management of neuroendocrine tumors of the gastroenteropancreatic system. Ann Oncol. 2004;15:966-973. [PubMed] [DOI] |
| 22. | Chua YJ, Michael M, Zalcberg JR, Hicks RJ, Goldstein D, Liauw W, Price T. Antitumor effect of somatostatin analogs in neuroendocrine tumors. J Clin Oncol. 2010;28:e41-e42; author reply e41-e42. [PubMed] [DOI] |
| 23. | Ferone D, Saveanu A, Culler MD, Arvigo M, Rebora A, Gatto F, Minuto F, Jaquet P. Novel chimeric somatostatin analogs: facts and perspectives. Eur J Endocrinol. 2007;156 Suppl 1:S23-S28. [PubMed] [DOI] |
| 24. | Zhang J, Jia Z, Li Q, Wang L, Rashid A, Zhu Z, Evans DB, Vauthey JN, Xie K, Yao JC. Elevated expression of vascular endothelial growth factor correlates with increased angiogenesis and decreased progression-free survival among patients with low-grade neuroendocrine tumors. Cancer. 2007;109:1478-1486. [PubMed] [DOI] |
| 25. | Kulke MH, Chan JA, Meyerhardt JA, Zhu AX, Abrams TA, Blaszkowsky LS, Regan E, Sidor C, Fuchs CS. A prospective phase II study of 2-methoxyestradiol administered in combination with bevacizumab in patients with metastatic carcinoid tumors. Cancer Chemother Pharmacol. 2011;68:293-300. [PubMed] [DOI] |
| 26. | Raymond E, Dahan L, Raoul JL, Bang YJ, Borbath I, Lombard-Bohas C, Valle J, Metrakos P, Smith D, Vinik A. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med. 2011;364:501-513. [PubMed] [DOI] |
| 27. | Raut CP, Kulke MH. Targeted therapy in advanced well-differentiated neuroendocrine tumors. Oncologist. 2011;16:286-295. [PubMed] [DOI] |
| 28. | Yao JC, Shah MH, Ito T, Bohas CL, Wolin EM, Van Cutsem E, Hobday TJ, Okusaka T, Capdevila J, de Vries EG. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med. 2011;364:514-523. [PubMed] [DOI] |
| 29. | Fjallskog ML, Janson ET, Falkmer UG, Vatn MH, Oberg KE, Eriksson BK. Treatment with combined streptozotocin and liposomal doxorubicin in metastatic endocrine pancreatic tumors. Neuroendocrinology. 2008;88:53-58. [PubMed] [DOI] |